老年缺血性脑卒中合并心房颤动及冠心病患者的6年预后随访研究
董敏,徐蕾,何清华,裴作为,曲祎玫,杨杰孚,汪芳*
急性缺血性脑卒中是最常见的卒中类型,在全球的发病率、致残率和致死率均较高,是仅次于冠心病和癌症的全球第三大死亡原因[1]。近些年,随着对动脉粥样硬化性心脑血管疾病危险因素的干预、二级预防和护理工作的有效实施,脑卒中的死亡率在欧美等发达国家逐年下降[2],但在我国和其他一些发展中国家,脑卒中的死亡负担仍然较重[3-4]。56%的心源性脑卒中患者与非瓣膜性心房颤动有关[5]。心房颤动(简称房颤)引起的缺血性脑卒中较其他原因引起的脑卒中临床症状更重、心血管并发症更多、预后更差[6]。
近些年,房颤合并冠心病患者在临床上越来越受到关注,这两种疾病有着共同的危险因素(如糖尿病、高血压),共同促进缺血事件、器官功能障碍及死亡等终点事件的发生和发展,成为影响人类健康和生活质量的“杀手”。欧洲心脏病协会(European Society of Cardiology,ESC)推荐CHA2DS2-VASc评分作为评估房颤患者(包括房颤合并冠心病)远期脑卒中及血栓栓塞事件风险的重要评估量表。近几年对于这部分特殊群体的研究主要集中于血栓栓塞事件和心肌梗死的预防和治疗,新近的临床研究更多的关注于新型口服抗凝药(new oral anticoagulants,NOACs)的选择、抗栓的种类及疗程,而对房颤合并冠心病患者的远期预后缺乏可靠的流行病学数据,且对结局的预测因素也尚未可知。为了对房颤合并冠心病患者的远期预后有一个早期预判,以更好地指导临床医生选择合适的治疗策略、合理化分配医疗资源,本研究通过评估老年房颤及冠心病患者发生缺血性脑卒中后远期的生存情况,进一步探讨影响预后的危险因素。
1 对象与方法
1.2 诊断标准 急性缺血性脑卒中诊断标准[7]:(1)急性起病;(2)局灶神经功能缺损(一侧面部或肢体无力或麻木,语言障碍等),少数为全面神经功能缺损;(3)症状或体征持续时间不限(当影像学显示有责任缺血病灶时);(4)排除非血管性病因;(5)颅脑CT/MRI排除脑出血。
房颤的诊断主要依靠心电图或动态心电图,或既往有明确房颤病史,其中包含瓣膜性房颤和非瓣膜性房颤患者。瓣膜性房颤定义为中、重度左房室狭窄(具有需要外科干预的可能性)以及机械瓣置换术后的房颤[8]。
冠心病的诊断标准应符合以下3条中的任一条:(1)冠状动脉造影证实冠状动脉主支或分支有一支以上狭窄≥50%,或左主干狭窄≥25%;(2)冠状动脉CT检查提示冠状动脉主要血管或分支有一支以上存在中度以上狭窄;(3)由于其他原因未行冠状动脉造影或冠状动脉CT检查,但临床资料高度提示冠心病:如心肌核素显像提示存在可逆性放射分布缺损,或超声心动图有节段性室壁运动异常,或临床心绞痛症状较典型且发作时心电图有典型的ST-T动态改变。
1.3 资料收集 收集的临床资料包含人口统计学信息、疾病种类、用药种类、血压、心率、合并心脏基础疾病〔如陈旧性心肌梗死、冠状动脉造影病变情况(三支病变、左主干病变)、心力衰竭、起搏器植入、纽约心脏病协会(NYHA)心功能分级〕及其他疾病(如高血压、高脂血症、糖尿病、慢性肾病、慢性胃肠病、肿瘤)、实验室指标、超声心动图结果、治疗方案〔抗血小板、抗凝、他汀类药物、血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)、β-受体阻滞剂、抗心律失常〕。分别通过CHA2DS2-VASc评分、CHADS2评分评估患者的脑卒中及血栓栓塞发生风险,应用HASBLED评分评估出血风险[9]。
本文创新点:
近年来,急性缺血性脑卒中在全球的发病率、致残率和致死率仍然较高,而其中部分患者同时存在心房颤动(简称房颤)及冠心病。针对这部分特殊群体,新近的临床研究主要集中于脑卒中和血栓栓塞事件的预防和治疗,而关于老年群体的整体预后研究较为少见。本研究通过回顾性队列研究,旨在评估老年缺血性脑卒中合并房颤及冠心病患者的远期预后及影响因素,为临床治疗提供进一步指导与参考。
雄关漫道真如铁,而今迈步从头越。改革开放再出发,天脊集团信心十足,阔步前行,自加压力,主动顺应供给侧结构性改革的历史趋势,坚持新发展理念,坚持“天脊品牌、中国品质、始终如一、良心制造”,加快转型升级步伐,以实际行动书写新时代高质量发展的天脊答卷。
本文局限性:
本研究中入组的60岁以上缺血性脑血管病合并房颤及冠心病患者均为住院患者,相对于门诊就诊的患者症状重,临床并发症多,存在一定的选择偏倚。由于纳入研究的样本量有限,部分患者失访,随访时间仍不够长,纳入多因素回归的模型虽然后续进行了敏感性分析,但仍可能存在一定的随机误差,使得一些统计学差异未能显现。研究中虽然未发现抗凝、抗血小板及肾素血管紧张素醛固酮系统(RAS)阻滞剂对远期预后的影响,但仍不能否认和忽视以上药物的治疗作用,期待今后更大规模和更长时间的临床研究,以探索更多影响脑血管病合并房颤及冠心病人群远期预后的因素。
CHA2DS2-VASc评分标准:C为充血性心力衰竭,包括有心力衰竭的症状、体征或左心室射血分数(LVEF)<40%;H为高血压,至少两次静息血压≥140/90 mm Hg(1 mm Hg=0.133 kPa)或正接受降压治疗;A为年龄>75岁记2分,年龄65~74岁记1分;D为糖尿病,空腹血糖>125 mg/dl(7 mmol/L)或口服降糖药物或胰岛素治疗;S为既往卒中/短暂性脑缺血发作(TIA)/血栓栓塞史,记2分;V为血管性疾病(既往心肌梗死、外周动脉疾病或主动脉斑块);Sc为女性。
CHADS2评分标准:C为充血性心力衰竭,包括有心力衰竭的症状、体征或LVEF<40%;H为高血压,至少两次静息血压≥140/90 mm Hg或正接受降压治疗;A为年龄>75岁记1分;D为糖尿病;S为既往卒中/TIA/血栓栓塞史,记2分。
HAS-BLED评分标准:H为高血压;A为肝功能异常或肾功能异常,各记1分,肝功能异常指慢性肝病(例如肝硬化)或具有肝功能明显受损的生化证据(如胆红素高于参考范围上限的2倍,天冬氨酸氨基转移酶/丙氨酸氨基转移酶/碱性磷酸酶高于参考范围上限的3倍等);肾功能异常指长期透析或肾移植或血清肌酐≥200 μmol/L;S为脑卒中;B为出血病史或出血倾向(包括贫血);L为国际标准化比值(INR)易波动;E为年龄>65岁;D为合并特殊药物或嗜酒,各记1分,合并特殊药物指同时应用抗血小板药、非甾体类抗炎药、皮质激素等。
实验室指标主要包括血红蛋白、血清蛋白、血清肌酐、低密度脂蛋白胆固醇(LDL-C)、D-二聚体和N末端B型钠尿肽前体(NT-proBNP)。肾功能的评价采用估算肾小球滤过率(eGFR)。eGFR采用CKDEPI公式[10],具体为:eGFR=a×(血肌酐浓度/b)c×(0.993)年龄,其中a=141,b=0.9(男性)或0.7(女性),c根据肌酐水平采用不同数值:男性血清肌酐≤0.9 mg/dl(80 μmol/L)时c=-0.411,肌酐>0.9 mg/dl时c=-1.209;女性血清肌酐≤0.7 mg/dl(62 μmol/L)时c=-0.329,肌酐>0.7 mg/dl时c=-1.209。
超声心动图结果均由超声心动室主治医师级别以上审核,录入参数包括左心房前后径(LAD)、左心室舒张末内径(LVEDD)和LVEF。
1.4 随访 患者出院后均进行定期随访,每年随访至少1次,通过电话随访、门诊及住院志查询等方式随访至少6年。随访内容包括主要不良心血管事件(MACE,包括缺血性脑卒中、TIA、体循环栓塞、非致死性心肌梗死、需要住院干预的心绞痛、心力衰竭或心律失常、出血事件和全因死亡)及再住院次数,随访终点事件为死亡,对于已死亡患者,需记录死亡时间及对死亡原因进行分类记录。随访截止日期为2020-10-31。
1.5 统计学方法 采用SPSS 25.0软件进行统计学分析。符合正态分布的计量资料以(±s)表示,两组间比较采用成组t检验;非正态分布计量资料以M(P25,P75)表示,组间比较采用秩和检验;计数资料以相对数表示,组间比较采用χ2检验;采用Cox比例风险回归模型分析患者死亡的影响因素;采用Kaplan-Meier法绘制生存曲线,生存曲线分析采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 两组患者年龄、性别、疾病种类、用药种类、收缩压、舒张压、心率、合并陈旧性心肌梗死比例、合并三支病变比例、合并左主干病变比例、合并心力衰竭比例、合并起搏器植入比例、NYHA心功能分级、合并高血压比例、合并糖尿病比例、合并慢性肾病比例、合并肿瘤病史比例、实验室指标、LAD、LVEF、治疗方案、MACE、再住院次数比较,差异均无统计学意义(P>0.05);脑血管病组合并高脂血症比例、慢性胃肠病比例低于非脑血管病组,LVEDD、CHA2DS2-VASc评分、CHADS2评分、HAS-BLED评分高于非脑血管病组,差异有统计学意义(P<0.05,见表1)。
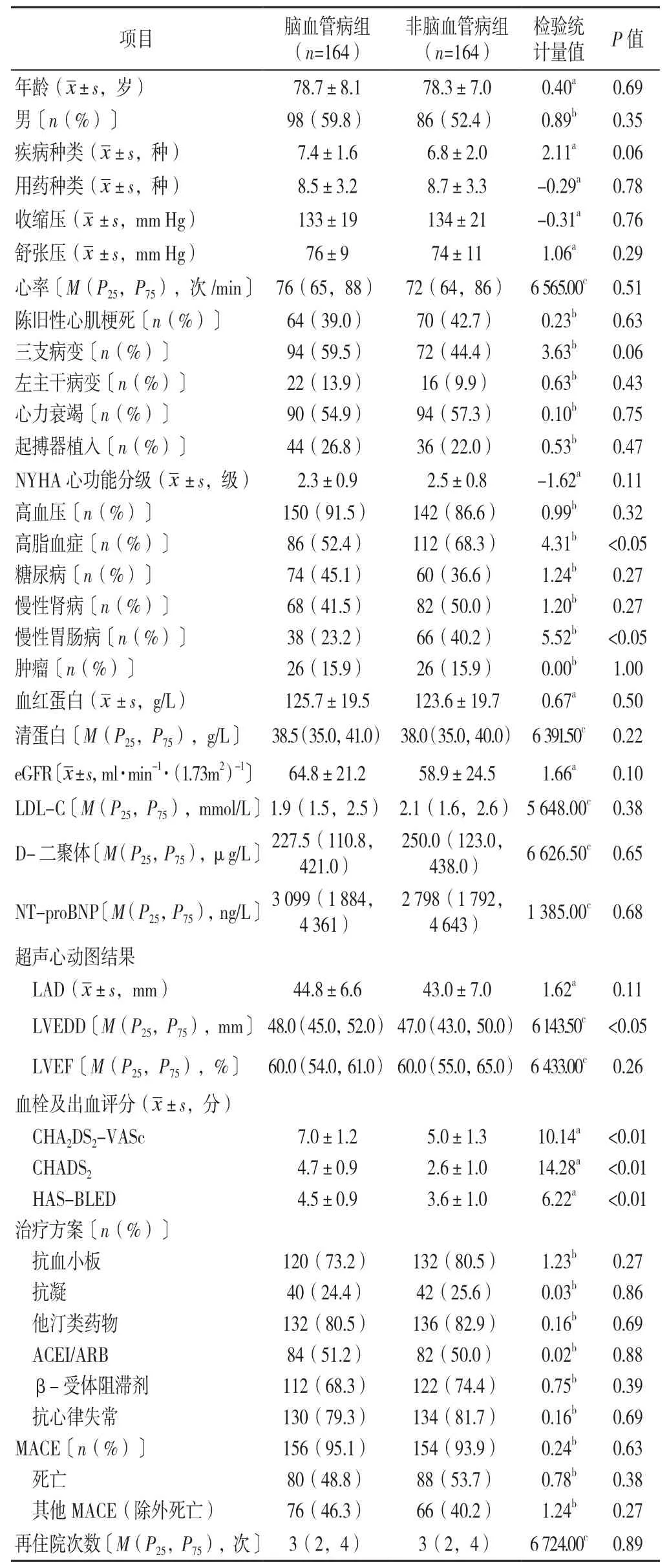
表1 脑血管病组和非脑血管病组临床资料比较Table 1 Comparison of clinical data of patients with cerebrovascular disease and non-cerebrovascular disease
2.2 死亡原因 6年的随访中,两组患者死亡原因比较,差异无统计学意义(χ2=1.60,P>0.05,见表2)。

表2 脑血管病组与非脑血管病组死亡原因比较〔n(%)〕Table 2 Comparison of causes of death between cerebrovascular disease group and non-cerebrovascular disease group
2.3 老年缺血性脑卒中合并房颤及冠心病患者死亡影响因素分析 脑血管病组164例患者失访2例(失访率1.2%),死亡80例(49.4%),根据生存结局分为死亡组(80例)和存活组(82例)。死亡组患者年龄大于存活组,收缩压、舒张压、合并高血压比例、合并高脂血症比例、血清蛋白、使用他汀类药物比例低于存活组,心率和合并陈旧性心肌梗死、心力衰竭、慢性肾病比例及NYHA心功能分级、D-二聚体、NT-proBNP高于存活组,差异有统计学意义(P<0.05,见表3)。

表3 死亡组和存活组患者临床资料比较Table 3 Comparison of clinical data between the dead group and the survival group
以死亡与否(赋值:是=1,否=2)为因变量,以年龄(赋值:60~69岁 =1,70~79岁 =2,80~89岁 =3,≥90岁=4)、收缩压(赋值:实测值)、舒张压(赋值:实测值)、心率(赋值:实测值)、陈旧性心肌梗死(赋值:是=1,否=2)、NYHA心功能分级(赋值:Ⅰ级=1,Ⅱ级=2,Ⅲ级=3,Ⅳ级=4)、高血压(赋值:是=1,否=2)、高脂血症(赋值:是=1,否=2)、慢性肾病(赋值:是=1,否=2)、血清蛋白(赋值:<39 g/L=1,≥39 g/L=2)、D-二聚体(赋值:<148 μg/L=1,≥ 148 μg/L=2)、NT-proBNP(赋值:<1 500 ng/L=1,≥1 500 ng/L=2)及使用他汀类药物(赋值:是=1,否=2)为自变量进行Cox比例风险回归模型分析,结果显示,年龄每增加10岁〔HR=1.63,95%CI(1.05,2.51)〕、陈旧性心肌梗死〔HR=2.19,95%CI(1.14,4.22)〕、D-二聚体≥148 μg/L〔HR=6.99,95%CI(2.10,23.28)〕是老年脑卒中合并房颤及冠心病患者远期死亡的独立危险因素(P<0.05),而高血压〔HR=0.28,95%CI(0.11,0.72)〕和使用他汀类药物〔HR=0.38,95%CI(0.19,0.78)〕是远期死亡的保护因素(P<0.05,见表4)。

表4 老年缺血性脑卒中合并房颤及冠心病患者远期死亡的Cox比例风险回归模型分析Table 4 Cox regression analysis of long-term mortality in elderly patients with ischemic stroke combined with atrial fibrillation and coronary heart disease
2.4 生存曲线 不同年龄组累积生存率比较,差异有统计学意义(χ2=10.16,P<0.01);高血压组累积生存率高于非高血压组,差异有统计学意义(χ2=5.59,P=0.02);无陈旧性心肌梗死的患者的累积生存率高于有陈旧性心肌梗死患者,差异有统计学意义(χ2=6.65,P=0.01);D-二聚体水平低的患者累积生存率高于D-二聚体水平高者,差异有统计学意义(χ2=22.24,P<0.01);服用他汀类药物的患者累积生存率高于未服用他汀类药物患者,差异有统计学意义(χ2=10.64,P<0.01,见图 1)。
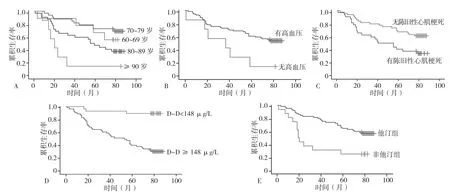
图1 不同临床因素对老年缺血性脑卒中合并房颤及冠心病患者远期预后的生存曲线Figure 1 Survival curves of different clinical factors on the long-term prognosis of elderly patients with ischemic stroke combined with atrial fibrillation and coronary heart disease
3 讨论
近些年来,随着全球医疗水平的提高,脑卒中的死亡率在发达国家已出现拐点,但在我国和其他一些发展中国家仍然居高不下。部分患者由于同时存在基础心脏疾病如房颤、冠心病,使其治疗难度和死亡风险进一步增加。目前,关于缺血性脑卒中合并房颤及冠心病患者的整体预后研究较少,而涉及该群体的老年患者的预后研究更是匮乏。因此,本研究通过回顾性队列研究,旨在评估老年缺血性脑卒中合并房颤及冠心病患者的远期预后及影响因素。
本研究结果显示,随访至6年时,老年缺血性脑卒中合并房颤及冠心病患者的生存率仅有50.6%(82/162),远低于同期其他亚洲及欧洲国家。东欧立陶宛的一项医保数据调研显示,该国家脑卒中患者5年生存率可高达70%[11]。而在另一项GROSS卒中研究中,白俄罗斯人群的5年生存率也可达58%[12]。造成如此差异的原因可能与并存的心脏疾病有关,部分房颤及冠心病患者在疾病后期可进展为心力衰竭,影响远期生存。此外,国家经济水平、医疗条件、患者社会经济地位、年龄、性别、卒中反复发作次数及严重程度、抗凝药物的选择、溶栓治疗的时间窗以及其他合并症的存在等因素均可影响脑卒中患者的远期预后[11-16]。一项来自美国的医保调研数据显示,缺血性脑卒中或心肌梗死幸存的患者在长达6年的随访中,7.2%出现心肌梗死复发,6年累计心肌梗死复发发生率为14.3%,两组队列中分别有70%和69%患者出现死亡,合并糖尿病的患者心肌梗死复发和行冠状动脉血运重建术的风险明显增加[17]。由此可见,缺血性脑卒中合并基础心脏疾病的幸存者后续再发心血管事件及死亡风险较高,预后更差。
本研究中的死亡患者约有一半为心源性猝亡,绝大多数与慢性心功能不全失代偿、心源性休克有关,少数死于恶性心律失常,感染为死亡的第二大原因,约占到1/5,脑血管病引起死亡排第三位。因此,脑血管病合并基础心脏病患者的远期预后堪比恶性肿瘤,心功能的恶化在病情后期进展中起了关键性作用,更应加强心功能的维护,而不能仅把治疗的重点落在脑血管病的二级预防及康复治疗上。
近几年,欧美国家虽然不断更新房颤指南,但总体原则均是根据CHA2DS2-VASc评分确定脑卒中和血栓栓塞高危人群,并及早启动抗凝治疗。若合并冠心病,总体原则是在抗凝(首选NOACs)基础上联合抗血小板治疗,并尽量缩短抗凝联合抗血小板治疗的时间,后续改为单独抗凝治疗,抗凝需贯穿整个病程的始终[8,18]。本研究患者均合并冠心病,且合并至少两种其他慢性疾病,CHA2DS2-VASc评分的整体评分均较高,依据ESC 2020指南均有抗凝适应证[18],而实际抗凝比例不到1/4,与指南差距较大。国内单中心研究发现,非瓣膜性房颤患者约有3/4为脑卒中高危人群,虽有明确抗凝指征,但61.5%的患者存在治疗过度、治疗不足和未抗栓治疗,甚至有研究报道高危房颤患者未接受抗凝治疗的比例高达68.3%~71.7%[19-20]。这种抗凝不足的现状前几年在国内非常普遍,尤其是对于老年患者,临床医生出于对出血并发症、肝肾功能减退、多种合并症及多重用药的顾虑,在急性脑血管病患者中又担心过早启动抗凝治疗容易诱发梗死后脑出血,使得抗凝治疗在人群中的总体获益无法真正体现。近期公布的ESC房颤指南依然推崇抗凝治疗,建议房颤患者一旦发生缺血性脑卒中、TIA,在无禁忌证时尽早进行二级预防启动抗凝治疗(优选NOACs),但不推荐超早期抗凝(<48 h),在一些特殊情况下可以先咨询神经内科专科医生后再定[18]。
本研究结果显示,增龄、有陈旧性心肌梗死史是脑血管病合并房颤及冠心病患者远期死亡的危险因素,并且生存曲线显示,随着随访时间的延长,年龄≥90岁患者与年龄60~69岁患者的累积生存率拉开差距逐渐增大,高龄患者的远期预后更差。增龄作为许多疾病模型发生发展的独立危险因素,在多层次、多方面上改变着机体的结构和功能,促使机体各脏器逐渐转向病理状态。研究显示,80岁以上高龄老年人中房颤相关脑卒中的发生率是其他年龄组患者的4.5倍[21]。在多种族人群的动脉粥样硬化研究(MESA)中,通过机器学习生成的多种心血管事件预测模型同样发现,年龄是众多心血管危险因素中预测全因死亡最重要的危险因素[22]。而既往有心肌梗死的病史常提示冠状动脉存在病变,即使已进行充分的血运重建术,已坏死心肌仍可能对远期心功能产生影响。瑞典一项纳入22 589例胸痛患者的调查研究显示,存在心肌标志物升高或心肌损伤患者(包含1型和2型心肌梗死)的远期心血管死亡率为43%~45%,相比于无心肌损伤患者预后更差[23]。此外,心肌梗死后伴射血分数下降患者的远期全因死亡率和心源性死亡率均显著高于射血分数保留的陈旧性心肌梗死患者[24]。RADISAUSKAS等[11]也在其研究中证实,年龄、既往心肌梗死史及糖尿病是卒中后1年及5年死亡率增加的独立危险因素。
本研究结果显示,脑血管病患者的总体血栓风险评分(CHADS2、CHA2DS2-VASc评分)和出血风险评分(HAS-BLED评分)均高于非脑血管病组,但在最终的死亡风险评估中未发现这些评分系统对预后有预测价值。但近些年来已有一些小规模研究和荟萃分析发现这些血栓评分系统能预测房颤患者短期死亡风险[25-26]。ORVIN等[27]通过对12 785例冠心病患者的长期随访发现,CHA2DS2-VASc评分能预测冠心病患者远期死亡风险(1年和5年),并且评分与临床结局(全因死亡、非致死性心肌梗死)呈线性相关。同样,KONISHI等[28]证实了HAS-BLED评分也可以预测冠心病患者介入治疗后的远期出血风险和死亡率,而与房颤的存在与否无关,明显扩宽了这些评分系统的应用领域。也期待在后续的研究中进一步扩大样本量和延长随访时间,以证实这些评分系统对预后的影响。
研究表明,房颤患者的快速心室率可引起心房内异常的炎症激活,加速左心房心肌纤维化及结构重塑,而炎症又可影响凝血级联效应,导致血液高凝或形成血栓前状态[29]。血清D-二聚体水平恰巧可反映机体内血栓负荷或一种血栓前状态,甚至在一些研究中被作为左心房增大的替代观察指标[30]。国内有学者将房颤患者的D-二聚体水平、炎性指标和CHA2DS2-VASc评分联合起来,建立了新的预测模型,其预测远期卒中风险优于传统的血栓风险评分[31]。NARUSE等[32]也将血清D-二聚体水平与eGFR联合来预测冠心病患者的全因死亡率,其预测能力优于其他任何单一因素建立的模型。本研究中也发现了D-二聚体水平对老年缺血性脑卒中合并房颤及冠心病患远期预后的影响,并且发现两组不同D-二聚体水平患者的生存曲线在研究初始即出现分离,后期死亡率差异逐渐增大。
本研究结果显示,高血压和服用他汀类药物是老年缺血性脑卒中合并房颤及冠心病患者远期预后的保护因素,推测可能与这部分人群合并颈动脉或颅内血管病变的比例高,为了保证颅内血管的灌注,血压不宜降得过低有关。国内研究也证实,急性缺血性脑卒中患者在机械取栓术后围术期血压维持在中等水平组(141~160 mm Hg)的预后优于低血压组(血压维持在120~140 mm Hg)和高血压组(血压维持在161~180 mm Hg)[33]。他汀类药物稳定斑块、延缓动脉粥样硬化的进展、降低远期心脑血管事件的风险及死亡率的效应早已被广泛循证证据所支持,并得到指南的推荐[34-35]。CHOI等[36]通过对2 153例急性缺血性脑卒中合并房颤的前瞻性队列研究发现,他汀类药物(尤其是高强度他汀)还可降低急性缺血性脑卒中合并房颤患者远期临床不良心脑血管事件的发生风险。小规模研究证实,他汀类药物改善侧支循环的作用显著,对于预防房颤相关的卒中风险是有益的[37]。另一项回顾性队列研究显示,高胆固醇血症和高血压患者若未坚持服用他汀类和降压药物,可显著增加致命性脑卒中的风险,但若坚持这些疗法中的一种,风险就会明显降低[38]。因此,上述研究一致表明他汀类药物可减少脑血管病患者的远期不良事件,这种治疗效应和生存获益在本研究的脑血管病合并房颤及冠心病的老年人群中再一次得到了印证。但是不同于心血管病患者,他汀类在脑血管病患者中的治疗靶目标仍存在一定争议。一项健康女性的大型前瞻性队列研究结果显示,过低的LDL-C水平(尤其是LDL-C<70 mg/dl)可能会使脑出血风险增加[39]。因此,在为脑血管病合并冠心病患者处方他汀类药物时,应当调整剂量将LDL-C控制在合理范围内。
综上所述,房颤合并冠心病患者在首次发生脑血管病后,其远期6年死亡率较高,虽与并存的脑血管病无关,但与增龄、陈旧性心肌梗死病史及D-二聚体水平有关,应当重视这些患者的早期危险因素识别并积极纠正,干预升高的D-二聚体水平,酌情加用抗凝药物,尽早并坚持使用他汀类药物,维持适当的血压水平,加强对这些患者的定期随访,以期改善其临床预后。
作者贡献:董敏、何清华进行文献/资料收集、整理;董敏进行统计学处理及撰写论文;曲祎玫进行数据校对及电话随访;董敏、徐蕾进行论文的修订;裴作为进行英文修订;杨杰孚负责文章的质量控制和可行性分析;汪芳对文章整体负责,监督管理。
本文无利益冲突。

