蛋白组学技术在脓毒症标志物研究中的应用进展
刘 欣,陈 琛,李 萌
(1.浙江中医药大学 第二临床医学院,浙江 杭州 310053;2.浙江医院 医学检验科,浙江 杭州 310013)
脓毒症是由感染引起的失控的炎症反应所导致的器官功能障碍[1],是重症监护病房(intensive care unit,ICU)患者死亡的常见原因。全球脓毒症的流行情况仍难以控制[2],早期识别、规范治疗及抗生素早期应用能降低脓毒症的病死率[3-4]。目前,临床主要通过生命体征、血流动力学指标、组织灌注情况等临床表现,乳酸、降钙素原(procalcitonin,PCT)和G实验/GM实验等实验室指标对脓毒症的诊断、病程监测及预后进行综合判断;同时,通过序贯器官衰竭评分(sequential organ failure assessment,SOFA)、快速序贯器官衰竭评分(quick sequential organ failure assessment,qSOFA)、急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)、治疗干预评分系统(therapeuticintervention scoring system,TISS)、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)、Logistic器官功能障碍评分(Logistic organ dysfunction system, LODS)等评分系统判断脓毒症的严重程度。由于脓毒症疾病的异质性和诊断标准判读的复杂性,现有的指标在临床实际应用中仍具有较大挑战,近年来基于质谱的蛋白组学技术已应用于脓毒症生物学标志物的筛选及建立中。
1 脓毒症与基于质谱的蛋白组学技术
脓毒症患者体内发生的血流动力学改变、炎症因子风暴、免疫平衡失调以及其他级联反应可引起一系列蛋白水平的改变。蛋白组学技术高通量、连续多点监测等优势为脓毒症的诊断、监测及机制研究提供了技术保障。基于质谱(mass spectrometry,MS)的蛋白组学技术较基于二维凝胶分离(two-dimensional polyacrylamide gel electrophoretograms,2D-PAGE)的蛋白组学技术在低丰度蛋白的分离鉴定中更为敏感。2013年后对脓毒症生物标志物的研究开始应用基于质谱的蛋白组学技术。脓毒症蛋白组学研究中采用的质谱主要为基质辅助激光解吸电离-飞行时间质谱(matrix-assisted laser desorption/ionisation time-of-flight mass spectrometry,MALDI-TOF-MS)和电喷雾质谱(electrospray ionization-mass spectrometry,ESI-MS)。与质谱联用的蛋白标记技术主要有非标定量和标记定量,临床样本较多采用血清、血浆、尿液等,可实现对样本中的蛋白进行定量测定。随着脓毒症标志物研究的深入,开始采用靶器官相关的体液样本来反映脓毒症器官功能障碍,如肺泡灌洗液反映肺损伤情况[5];直接应用组织进行蛋白组学研究,如脑组织[6]、肾皮质[7];有学者开始探索脓毒症组织蛋白组学与血清蛋白组学间的相关性[8-9]。通过筛选、鉴定、验证脓毒症患者不同状态或时间点的差异蛋白,寻找脓毒症诊断及预后的潜在生物学标志物。见图1。
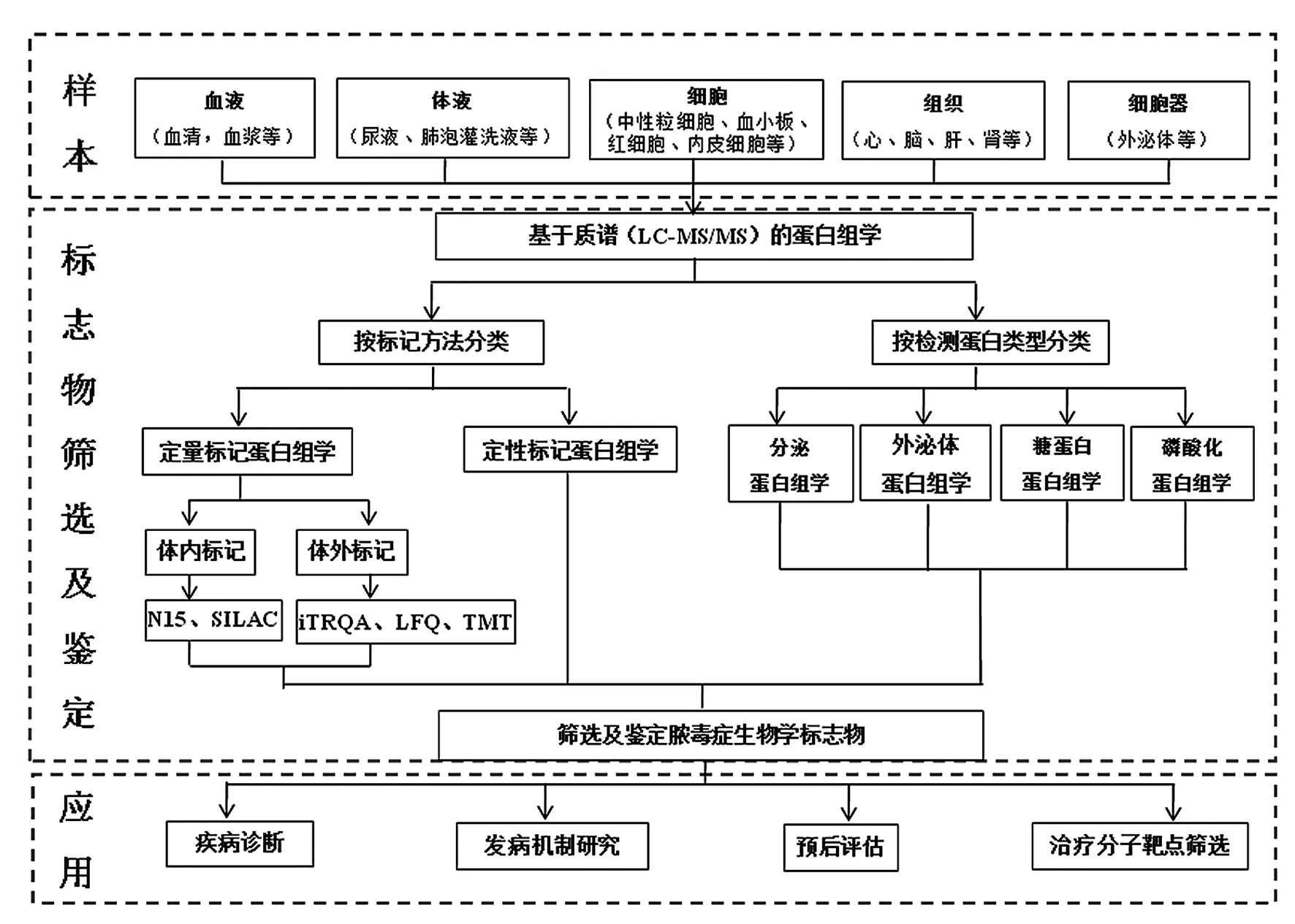
图1 基于质谱的蛋白组学在脓毒症研究中的应用Figure 1 Application of proteomics based on mass spectrometry in sepsis research
2 蛋白组学技术在脓毒症标志物筛选中的应用
Jiao等[10]应用蛋白组学技术分析脓毒症大鼠不同时间点的血清蛋白水平,研究表明α颗粒内多聚素1(multimerin 1)、纤维胶凝蛋白1(ficolin 1)、羧肽酶N2(carboxypeptidases N2,CPN2)、丝氨酸蛋白酶1(serine protease 1)和血小板因子4(platelet factor 4)与脓毒症密切相关;比较存活和非存活脓毒症大鼠在不同时间点的血清蛋白水平,Logistic回归分析证实α颗粒内多聚素1、血小板前碱性蛋白(pro-platelet basic protein)、纤维蛋白原-α(fibrinogen-α)和纤维蛋白原-β(fibrinogen-β)是脓毒症的预后指标。在脓毒症小鼠模型中,Cuello等[11]通过心肌组织的蛋白组学研究发现,pentraxin 3(PTX3)以八聚体的形式累积,引起脓毒症患者心肌功能障碍,且PTX3八聚体与脓毒症不良预后有关,可作为脓毒症患者并发心肌炎症的候选标志物。
Su等[12]通过脓毒症患者与全身炎症反应综合征患者的尿液蛋白组学研究,从34个差异蛋白中通过蛋白质-蛋白质相互作用网络筛选出钙黏蛋白1、结合珠蛋白、补体C39、α1抗胰蛋白酶和铜蓝蛋白5种蛋白,与脓毒症的诊断及预后有关。脓毒症28天幸存者组和非幸存者组尿液蛋白组学研究筛选出与脓毒症预后相关的7种蛋白,经鉴定尿液LAMP-1水平下降的脓毒症患者预后较差[13]。采用iTRAQ定量蛋白组学技术筛选出192个脓毒症血清差异表达蛋白,通过蛋白表达动力学和蛋白间相互作用的聚类分析,鉴定出脓毒症和脓毒症休克患者血清及淋巴细胞中波形蛋白(vimentin)水平明显高于健康对照组;波形蛋白可调节caspase-3相关的细胞凋亡、IL-2、IL-10和干扰素-α参与的炎症反应,提示波形蛋白有望成为脓毒症或感染性休克诊断和预后预测的新靶点[14]。
Pierrakos等[15]对178个脓毒症标志物的研究进展进行综述,其中34个为脓毒症早期诊断的标志物,但目前能应用于临床的非常有限。采用蛋白组学技术对CytoB/FMLF处理后的中性粒细胞进行分析,有12种蛋白大量并特异分泌[16],其中肝素结合蛋白(heparin-binding protein,HBP)已商品化,已应用于临床脓毒症诊断中[17]。通过选择性反应监测(selective reaction monitoring,SRM)-LC-MS/MS筛选出的C反应蛋白(C-reactive protein,CRP)、血浆胆固醇酯转移蛋白(cholesterol ester transfer protein,CETP)和载脂蛋白A4(apolipoprotein A4,ApoA4),对新生儿晚发性脓毒症诊断的曲线下面积(area under curve,AUC)为0.98(95%CI为0.917~1.000)[18],具有较好的诊断效能。蛋白组学技术的发展为脓毒症标志物的筛选提供了技术平台和发展前景。
3 蛋白组学技术在脓毒症机制研究中的应用
脓毒症作为一种复杂疾病,被称为“医学上最古老和最难以捉摸的综合征之一”[19]。危重患者的高度异质性给脓毒症的诊断和治疗带来不确定性。
脓毒症的发病率和死亡率随着年龄的增长而增加,尤其在65岁后。年龄作为风险因素的分子机制尚不完全清楚[20]。一项2 320名社区获得性肺炎患者多中心观察队列研究分别对50~65岁和70~85岁的脓毒症和非脓毒症患者进行血清蛋白组学分析,结果显示急性期反应、凝血途径和脂质代谢途径的蛋白质参与了老年脓毒症的发生发展;其中70~85岁的脓毒症患者CRP和纤维蛋白原α链水平显著降低,载脂蛋白CⅢ(apolipoprotein CⅢ,Apo CⅢ)水平显著升高,而这些指标在50~65岁的脓毒症患者中呈现相反的表达趋势[21]。这3种蛋白为老年人脓毒症高发病率提供了一定解释,为开发针对年龄和个性化的脓毒症治疗方案提供了思路。
氢气作为一种选择性抗氧化剂,吸入2%氢气对脓毒症有保护作用,但具体机制尚未完全阐明[22]。蛋白组学研究结果显示,氢气通过下调脑组织中母亲DPP同源物4(mothers against decapentaplegic homolog 4,SMAD4)、二氢嘧啶酶(dihydropyrimidase,DPYS)、前列腺素D2合酶蛋白表达水平,上调CUL4A表达水平,可降低脓毒症小鼠的脓毒症脑病的发生[6];氢气通过下调信号素7A(semaphorin-7A,Sema7A)、泛素硫酯酶(ubiquitin thioesterase,OTULIN)和促分裂原活化蛋白激酶激酶激酶(mitogen-activated protein kinase kinase kinase 1,MAP3K1)表达,上调转铁蛋白表达,可减轻脓毒症小鼠的急性肺损伤[5]。
脓毒症确诊后,尽早应用抗生素仍是目前有效的治疗策略[23]。但抗生素不能直接清除细菌内毒素,而体内的内毒素能刺激免疫反应、诱导炎症反应、诱导细胞凋亡和激活凝血途径,进而加速器官损伤[19]。机体对内毒素的临床反应轻重不一,小剂量的脂多糖(lipopolysaccharide,LPS)或类似物质刺激机体或单核巨噬细胞系统后,部分脓毒症患者对致死剂量内毒素表现为低反应性或无反应性的内毒素耐受(endotoxin tolerance)。脓毒症患者内毒素耐受的机制一直备受关注,但尚未阐明。采用相对和绝对定量蛋白组学技术分析小鼠巨噬细胞,结果显示内毒素耐受组高迁移率族蛋白A1(high mobility group protein A1,HMGA1)和高迁移率族蛋白A2(high mobility group protein A2,HMGA2)的表达均高于脓毒症组,而高迁移率族蛋白B1(high mobility group protein B1,HMGB1)和高迁移率族蛋白B2(high mobility group protein B2,HMGB2)的表达降低[24]。这些蛋白质为脓毒症器官保护的机制研究提供了实验基础。
Hohn等[8]利用功能网络分析和层次聚类分析相结合的方法将脓毒症大鼠不同组织蛋白组学(心脏、脑、肝脏、肾脏等)研究结果与血清蛋白组学研究结果进行比较,发现无论是组织还是血清中的蛋白水平均呈高度动态变化;组织中,差异蛋白功能以氧化还原活性、细胞能量生成或代谢为主;血清中,差异蛋白功能与脂蛋白代谢、凝血功能、炎症反应和器官再生有关;但未能找到血清与组织中功能相关的蛋白。但Malmström 等[9]的研究结果显示,同批次正常小鼠血浆、白细胞及各组织表达的所有蛋白可聚类成9组,血浆和组织分别表达不同的蛋白聚类组,比如血浆中主要表达补体及凝血系统中的蛋白(cluster Ⅰ);血浆和组织中均表达cluster Ⅱ,包括蛋白酶抑制剂、细胞间黏附蛋白和宿主防御系统蛋白;cluster Ⅲ蛋白主要存在于组织和细胞中,但在血浆中难检测到;cluster Ⅳ~cluster Ⅸ为各组织特异蛋白。值得注意的是,在脓毒症小鼠血浆中有组织特异性蛋白表达增加,提示在血液中有望筛选出组织特异性的标志物,为脓毒症血清/血浆标志物的进一步研究提供更为清晰的思路,也凸显出生物信息学方法在脓毒症蛋白组学数据挖掘中的重要性。
4 基于蛋白组学技术筛选脓毒症标志物的发展前景
4.1 脓毒症蛋白组学的新发展 根据蛋白来源或组分特点,目前蛋白组学又可细分为分泌蛋白组学、外泌体蛋白组学、糖蛋白组学及磷酸化蛋白组学[25]等。同时,蛋白组学与代谢组学[26]等多组学联合分析,也对脓毒症这种复杂疾病有了更清晰的认识。
分泌蛋白参与细胞信号转导、增殖、凋亡等生命过程,分泌蛋白组(secretome)是通过蛋白组学方法对组织或细胞等分泌到胞外的蛋白进行分析,为组织、细胞与血清找到相关联的标志物提供了线索。脓毒症患者内皮细胞暴露于生物刺激因子和物理应激下,内皮细胞活跃分泌的蛋白质在脓毒症引发的炎症反应中发挥关键作用[27],这为内皮细胞在脓毒症中增加血管炎症和凝血作用的机制研究提供了线索。脓毒症患者储存在中性粒细胞颗粒中的蛋白质释放,通过比较中性粒细胞内与分泌的蛋白,可以观察到中性粒细胞携带的蛋白质在脓毒症患者的血液循环中显著增加[16]。
Wang等[28]通过相对和绝对定量蛋白组学方法分析了LPS诱导的脓毒症中巨噬细胞来源的外泌体中的蛋白组成。在巨噬细胞-外泌体中共鉴定出5 056个蛋白,341个蛋白表达增加,363个蛋白表达减少。肝细胞可以摄取巨噬细胞-外泌体,随后NOD样受体含热蛋白结构域蛋白3(NOD-like receptor, pyrin domain containing protein protein 3,NLRP3)炎性小体被激活,提示巨噬细胞外泌体在脓毒症肝损伤中的重要性。
蛋白质的翻译后修饰使许多蛋白具有生物学活性,其中糖基化是重要的修饰方式之一。糖基化蛋白在免疫应答、细胞生长、炎症的产生等方面有着重要作用。血浆糖蛋白组学研究[29]发现,在脓毒症死亡者中,内源性凝血途径中抗凝血酶-Ⅲ和补体因子VⅢ蛋白上调;在脓毒症存活者中,外源性凝血途径的组织因子抑制物和补体因子V增加。因此,凝血途径的蛋白在脓毒症幸存者和死亡者中差异表达,这与糖蛋白差异表达有关。
4.2 基于蛋白组学筛选的脓毒症标志物临床应用的研究方向 基于蛋白组学筛选的脓毒症标志物研究有了较大发展,但目前能应用于临床的蛋白标志物还非常有限,还需进一步寻找发展的突破口和方向。
首先,蛋白组学技术的飞速发展有助于筛选更为精准的脓毒症蛋白标志物。基于纳米级的“组学”富集技术的脂质纳米粒(AmBisome©)浓缩平台有可能大幅改善血浆蛋白组学分析,为蛋白标志物的研发提供更为稳定的平台[30]。血浆样本经17% OptiPrepTM密度梯度离心液可帮助外泌体制备,有助于外泌体蛋白组学研究[31]。顶级蛋白组学技术—慢速率修饰的蛋白适体技术(Slow-Off rate Modified Aptamer,SOMAmer)[32]也为脓毒症的研究提供更精准的技术平台。
其次,生物信息技术对蛋白间的相互联系或功能分类分析让我们在验证、分析这些蛋白质时有了更清晰全面的认识。Pimienta等[33]联合LFQ和TMT两种定量蛋白组学技术对5种不同细菌感染导致脓毒症的小鼠模型进行血浆蛋白组学研究,通过软件分析,建立了84个蛋白的脓毒症血浆蛋白组特征谱(plasma proteome signature of sepsis,PPSS), 包括参与免疫抑制、血管稳态、凝血、补体、中性粒细胞功能、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)/胰岛素样生长因子1受体基因(IGF1R)轴和TAM酪氨酸激酶受体(Tyro3、Axl、MerTK)轴7个功能不同的亚网络;结果显示,PPSS可量化、可取代目前基于临床症状诊断脓毒症的方法。Shubin等[32]分析儿童脓毒症和非感染引起的全身炎症反应患者中差异表达蛋白,通过加权基因共表达网络(weighted gene correlation network analysis,WGCNA),界定出与脓毒症强相关性的“棕色”蛋白模型和与脓毒症中度相关的“蓝色”蛋白模型。生物信息分析方法的应用为发现和评估新的治疗策略提供技术保障,使诊断评估更具模型化、更便利。
综上所述,从体液、组织蛋白组学研究,到内皮细胞、中性粒细胞、血小板等细胞水平蛋白组学研究;从液体、组织蛋白组学到分类更为细致的分泌蛋白组学、外泌体蛋白组学、糖蛋白组学研究;从单一蛋白组学到蛋白组与代谢组的多组学联合研究,蛋白组学技术的发展为脓毒症标志物的筛选及机制研究提供了更为广阔的技术平台。

