基于线粒体控制区的江苏湖鲚群体遗传多样性和遗传结构分析
李大命,唐晟凯,刘燕山,谷先坤,殷稼雯,蒋琦辰,朱 凛,李春宁,张彤晴,潘建林
(江苏省淡水水产研究所,江苏省内陆水域渔业资源重点实验室,南京 210017)
鱼类线粒体DNA(mitochondrial DNA,mtDNA)呈共价闭合环装,是细胞核外具自主复制、转录和翻译能力的遗传因子。与核DNA相比,鱼类mtDNA具有分子小、结构简单、进化速度快、遗传相对独立和母系遗传等特点,是一个相对独立的复制单位[1-2],也是鱼类分子群体遗传学和系统学研究中常用的分子标记。控制区(displacement loop region,D-loop)是mtDNA上的一段非编码区,其在整个mtDNA中是碱基突变和长度变异最大、进化速度最快的序列,较适合用于鱼类种群遗传多样性和遗传结构分析[3-4]。采用线粒体D-loop序列作为分子标记,用于分析多种鱼类的遗传多样性和遗传结构,可为渔业资源保护及合理利用提供重要依据[5-7]。
目前大部分鱼类群体遗传学研究对象主要集中在经济鱼类或者濒危鱼类,而对经济价值相对偏低的小型鱼类的研究常被忽视[8]。湖鲚(Coilianasustaihuensis)隶属于鲱形目,鳀科,鲚属,是我国常见的一种小型鱼类,一般认为其是洄游性刀鲚的湖泊定居生态型,主要分布在通江的江河及其附属湖泊,终生生活在江河及湖中,不进行生殖洄游,在生态习性和形态上与洄游型刀鲚有一定差别[9-10]。湖鲚游泳迅速,拓殖能力强,具有性成熟早、繁殖率高、食性广等优势,近十年来湖鲚种群数量大幅增加,已成为湖泊鱼类群落的绝对优势种群,在维持湖泊生态系统的稳定中占据重要地位,能对湖泊的整个渔业资源及水质环境起到指示作用[11-15]。湖鲚作为湖泊渔业资源的重要捕捞对象,同时面临着资源过度开发利用、种群结构低龄化等亟待解决的问题[16-17]。而迄今有关湖鲚的研究主要集中在生长、年龄、食性等基础生物学方面[16,18-21],遗传学资料相对较少。
江苏省位于长江、淮河下游,湖泊众多,渔业资源丰富,是我国湖鲚资源的重要分布区。湖鲚是江淮下游附属湖泊太湖、洪泽湖鱼类群落中的优势种,也是渔业生产中重要的利用对象[12-13,15]。迄今,对太湖、洪泽湖湖鲚遗传多样性已有报道[10,22-25],但尚缺乏对江淮下游流域湖泊湖鲚遗传结构及其分布格局的系统研究。本研究以线粒体D-loop全序列为分子标记,对长江流域的太湖、滆湖和淮河流域的高邮湖、白马湖、洪泽湖和骆马湖共6个湖鲚群体的遗传多样性、遗传结构及进化历史进行分析,以期为湖鲚种质资源科学管理和合理利用提供重要依据。
1 材料与方法
1.1 样品采集和处理
用刺网采集太湖(TH)、滆湖(GH)、高邮湖(GYH)、白马湖(BMH)、洪泽湖(HZH)和骆马湖(LMH)共6个湖泊的湖鲚样本,采样时间为2016年10月至2018年10月。将样本用无水乙醇固定,带回实验室放入冰箱中保存备用。采样位置及样本基本的信息见图1和表1。
1.2 基因组DNA的提取
取样品的肌肉组织用于基因组DNA的提取。购买宝日医生物技术(北京)有限公司的广谱型基因组DNA小量试剂盒提取总DNA,将DNA溶于去离子水中。用琼脂糖凝胶电泳和分光光度计检测DNA的完整性和浓度,置DNA于-20℃保存备用。
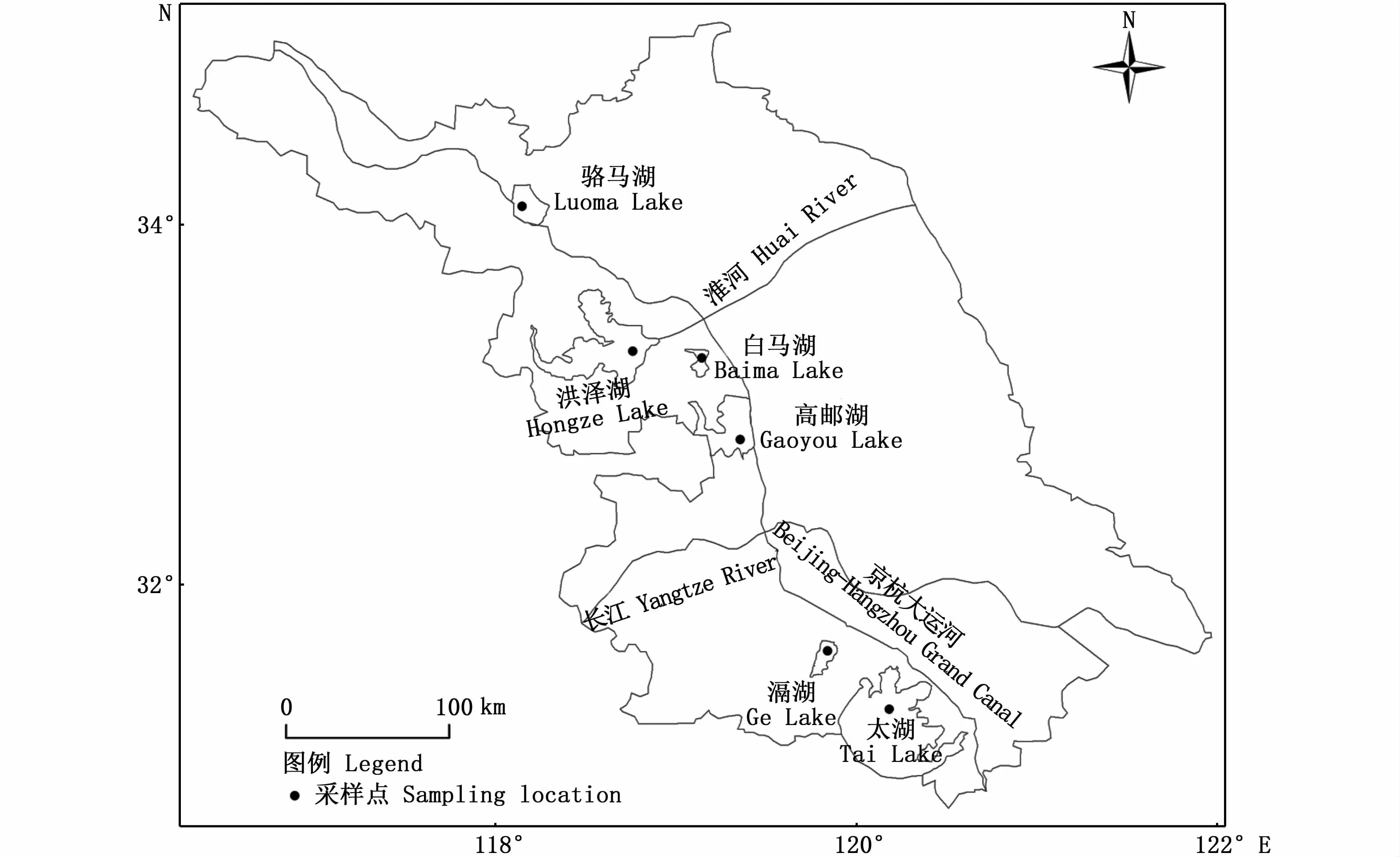
图1 湖鲚样本采样点位置Fig.1 Sam p ling location of Coilia nasus taihuensis sam p les
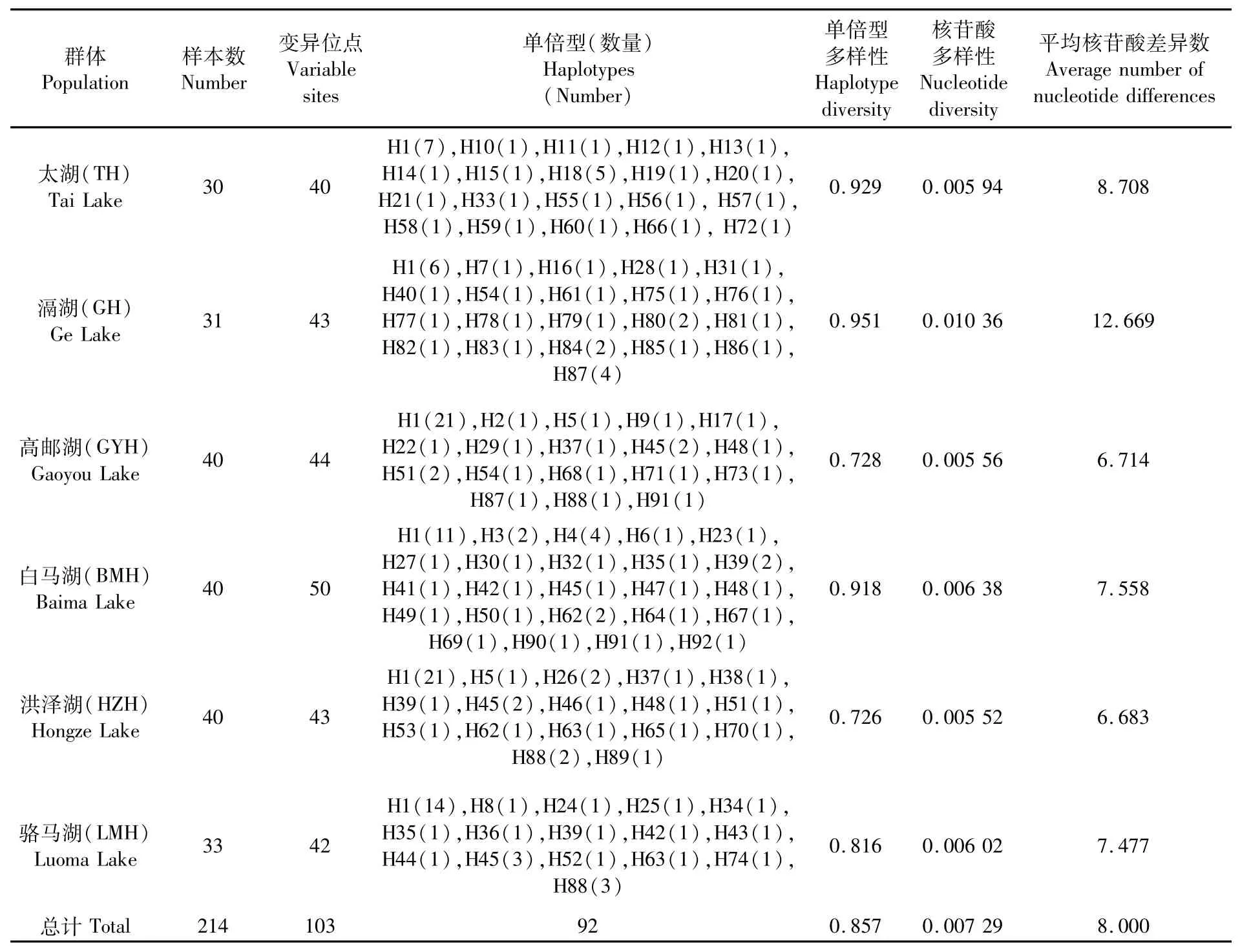
表1 基于线粒体D-loop序列的湖鲚群体的遗传多样性参数Tab.1 Genetic diversity parameters of C.nasus taihuensis based on m tDNA D-loop sequences
1.3 PCR扩增与测序
湖鲚线粒体D-loop区序列的上游引物为DF1(5′-CTAACTCCCAAAGCTAGAATTCT-3′),下游 引 物 为DR2(5′-ATCTTAGCATCTTCAGTG-3′)[26],引物由上海生工生物工程技术有限公司合成。PCR扩增反应总体积为50μL:10×PCR Buffer 5μL,5 U·μL-1TaqDNA聚合酶0.4μL,0.25 mmol·L-1dNTP 4μL,10μmol·L-1上下游引物各2μL,DNA模板1.5μL,加超纯水至总体积50μL。PCR扩增程序为:94℃预变性4 min;94℃40 s,55℃50 s,72℃60 s,35个循环;72℃延伸10 min,4℃保存。
PCR产物经琼脂糖凝胶电泳检测和纯化后,送至上海生工生物工程技术有限公司进行正反双向测序。
1.4 数据处理和分析
采用BioEdit7.0软件读取D-loop序列,并对序列进行编辑和拼接,利用ClustalX 1.83软件对D-loop序列进行比对和排序;采用Mega 7.0软件统计序列碱基组成和变异位点,并基于Kimura双参数模型计算群体间的遗传距离,采用邻接法(neighbour-joiningmethod,NJ)构建单倍型系统进化树,经1 000次重复抽样检测其置信度;采用DnaSP 5.1软件确定序列的单倍型、单倍型多样性、核苷酸多样性及平均核苷酸差异数等参数;应用Arleqin 3.5软件进行分子方差分析(AMOVA),评估群体间的遗传变异情况,利用遗传分化指数Fst来评价两两群体间的遗传差异,通过1 000次重抽样来检查两两群体间的Fst显著性。进行Tajima'sD和Fu'sFs中性检验和错配分析,推测种群的历史动态。利用Network 5.0软件构建单倍型最小网络图,分析单倍型间的进化关系。
2 结果与分析
2.1 湖鲚D-loop序列变异和群体遗传多样性
本研究共获得214条湖鲚的线粒体D-loop全序列,长度为1 214 bp至1 328 bp。214条序列共发现103个变异位点,其中简约信息位点56个,单一信息位点47个,存在5处插入/缺失序列。转换位点13个,颠换位点4个,转换/颠换比为3.5。6个群体的控制区序列的碱基组成相似,A、C、T和G的平均含量分别为33.3%、19.1%、33.4%和14.3%,碱基A+T的含量(66.6%)远大于G+C的含量(33.4%),体现出明显的AT碱基偏好性和典型的反G偏倚,吻合大多数脊椎动物线粒体DNA碱基组成特征[27]。
6个湖鲚群体214尾样本共检出92种单倍型(H1~H92),其中太湖群体有20种单倍型,滆湖群体有21种单倍型,高邮湖群体有18种单倍型,白马湖群体有24种单倍型,洪泽湖群体有17种单倍型,骆马湖有16种单倍型(表1)。H1是6个群体的共享单倍型,H5是洪泽湖和高邮湖群体的共享单倍型,H35和H42是白马湖和骆马湖群体的共享单倍型,H37和H51是高邮湖和洪泽湖群体的共享单倍型,H39是白马湖、洪泽湖和骆马湖群体的共享单倍型,H45是高邮湖、白马湖、洪泽湖和骆马湖群体的共享单倍型,H48是高邮湖、白马湖和洪泽湖群体的共享单倍型,H54和H87是高邮湖和滆湖群体的共享单倍型,H62是白马湖和洪泽湖群体的共享单倍型,H63是洪泽湖和骆马湖群体的共享单倍型,H88是高邮湖、洪泽湖和骆马湖群体的共享单倍型,H91是高邮湖和白马湖群体的共享单倍型,其他单倍型都是群体的独有单倍型。
6个群体的单倍型多样性为0.726~0.951,核苷酸多样性为0.005 52~0.010 36,6个群体整体的单倍型多样性和核苷酸多样性分别为0.857和0.007 29(表1)。可以看出,湖鲚群体具有丰富的遗传多样性,且湖鲚多样性呈现出高单倍型多样性和低核苷酸多样性特点。
2.2 湖鲚群体遗传结构
6个群体间的遗传距离在0.005 45至0.011 74之间变化,其中太湖与滆湖群体间的遗传距离最大,高邮湖与洪泽湖群体间的遗传距离最小(表2)。6个群体间的遗传分化系数Fst值在-0.022 05至0.192 21之间,其中长江流域的太湖和滆湖群体间的Fst值最大,而淮河流域的4个群体间Fst值较小(-0.022 05~0.043 91)。统计检验结果显示,滆湖群体与其他5个群体间有极显著的遗传分化(P<0.001),其他5个群体间没有显著的遗传差异(P>0.05)(表2)。
分子方差分析(AMOVA)结果显示,群体间分子变异占比为6.20%,群体内分子变异占比为93.80%,说明分子变异主要发生在群体内。群体总的遗传分化系数Fst值为0.061 99,且统计检验具有极显著性差异,说明群体间出现了显著遗传差异(表3)。将6个群体按水系划分为长江流域组(太湖和滆湖群体)和淮河流域组(高邮湖、白马湖、洪泽湖和骆马湖群体),对2组群进行分子方差分析,结果显示,组间分子变异占比为1.76%,组内群体间分子变异占比为5.28%,群体内分子变异占比为92.96%。组间的遗传分化系数值Fct为0.017 56,统计检验结果无显著性差异;组内群体间的遗传分化系数值Fsc值为0.057 36,群体内的Fst值为0.070 38,且统计检验均具有极显著性差异,表明组内群体间及群体内出现显著遗传分化(表3)。
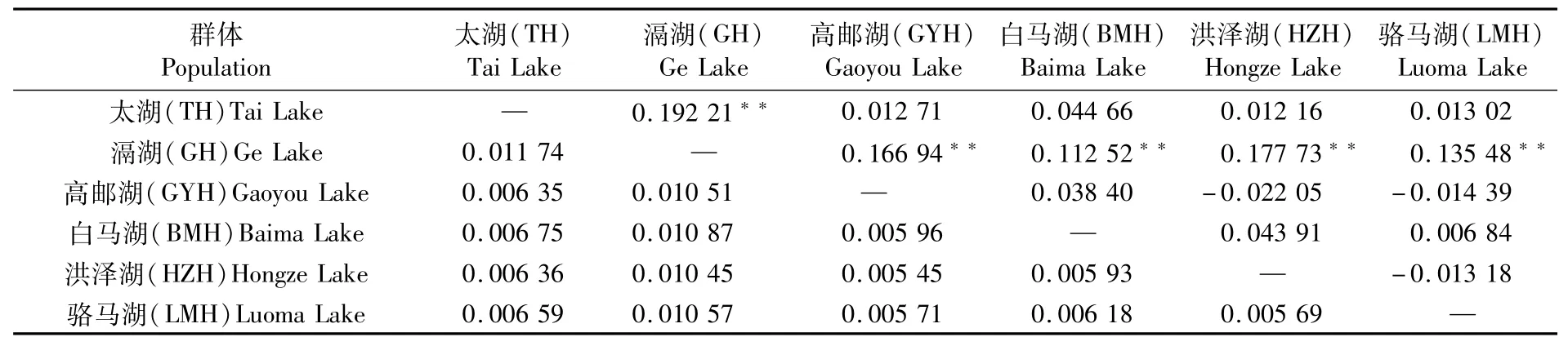
表2 湖鲚群体间遗传距离(对角线下)及遗传分化系数(对角线上)Tab.2 Genetic distiances(below diagonal)and F st(above diagonal)among C.nasus taihuensis populations

表3 湖鲚群体的分子方差分析结果Tab.3 Results of analysis ofmolecular variance(AMOVA)of C.nasus taihuensis populations
2.3 湖鲚单倍型系统树和网络进化图
以邻接法构建单倍型系统发育树(图2),结果显示,6个湖鲚群体可以划分为2个较大的谱系,其中谱系1由单倍型H1至H74组成,谱系支持率小于50%;谱系2由单倍型H75至H92组成,谱系支持率为76%。可以看出,同一群体的单倍型没有聚集为单系,而是分散在两个谱系中,说明还没有出现群体的谱系分化。
以中接法构建了湖鲚各单倍型进化网络图(图3),整个网络图呈非典型的星状结构,单倍型H1是6个群体的共享单倍型,也是数量最多的单倍型,位于网络进化图的中心,推测可能为群体的祖先单倍型。该单倍型关系图支持系统发育树结果,单倍型形成了2个进化分支,各单倍型相互散布在2分支中,未形成明显的系统地理格局。
2.4 湖鲚群体的历史动态
对6个湖鲚群体进行Tajima'sD和Fu'sFs中性检验,并估算群体的扩张时间(表4)。结果显示,滆湖群体的Tajima'sD和Fu'sFs检验均为负值,但并未达到显著水平(P>0.05);其他群体的Tajima'sD和Fu'sFs检验均为负值,但Tajima'sD检验未达到显著水平(P>0.05),Fu'sFs检验达到显著水平(P<0.05);将6个群体作为一个整体进行分析,结果表明Tajima'sD和Fu'sFs检验均为负值,并达到显著水平(P<0.05)。上述结果表明,太湖、高邮湖、白马湖、洪泽湖和骆马湖群体及湖鲚整体经历了种群扩张。根据群体的扩张参数Tau,以线粒体控制区的变异速率每百万年变异15%~20%推算[28],可估算出湖鲚群体扩张时间T发生在0.089~0.160百万年前的更新世晚期。
3 讨论
3.1 湖鲚群体遗传多样性
遗传多样性是生物多样性的核心,是物种适应复杂环境、维持生存与进化的重要基础。研究物种的遗传多样性水平、形成机制及分布格局,可以揭示物种的进化历程,准确评价种群的生存、扩张及环境适应能力。在众多的分子标记中,线粒体DNA具有诸多优势,是种群遗传研究的首选分子标记[29],而单倍型多样性(h)和核酸多样性(π)是衡量某一物种遗传多样性的2个常用指标[30]。
本研究应用mtDNA D-loop区序列对江苏省6个湖泊湖鲚群体遗传多样性进行分析,结果表明,6个湖鲚群体的单倍型多样性为0.726~0.951,核苷酸多样性为0.005 52~0.010 36,6个群体总的单倍型多样性和核苷酸多样性分别为0.857和0.007 29,且核苷酸多样性与平均核苷酸差异数变化趋势一致。有文献[24]报道4个湖泊(太湖、巢湖、鄱阳湖和洞庭湖)湖鲚群体的单倍型多样性为0.993~1.000,核苷酸多样性为0.006 2~0.011 5,本研究结果与其相一致,说明湖鲚群体的遗传多样性比较丰富,对环境的适应能力及进化潜力较大。另外,湖鲚游泳迅速,拓殖能力强,且具有性成熟早、繁殖率高、食性广等优势,以致其野生资源量急剧增加,形成了数量庞大的群体,成为湖泊鱼类群落中的优势种群,并对渔业资源及生态环境产生了重要影响[11-15]。依据GRANT和BOWEN[28]提出的海洋鱼类4种遗传多样性模式来划分,湖鲚群体属于第二种类型(高h低π),说明湖鲚群体易受环境变化的影响,经历过快速的扩张期,种群数量大幅增多,碱基的突变导致单倍型种类数量和单倍型多样性的增加,而核苷酸多样性没有获得足够的时间积累,这与文献报道的其他地理群体的研究结 果一致[23-25,31]。Tajima'sD[32]和Fu'sFs[33]中性检验结果也证明了湖鲚经历了种群扩张,扩张大约发生在0.089~0.160百万年前。湖鲚是一种小型鱼类,生命周期短,性成熟早,属于典型的r-策略生物[12,18-19],这种生活史特征对群体数量快速增加、高单倍型多样性的形成具有明显的促进作用。
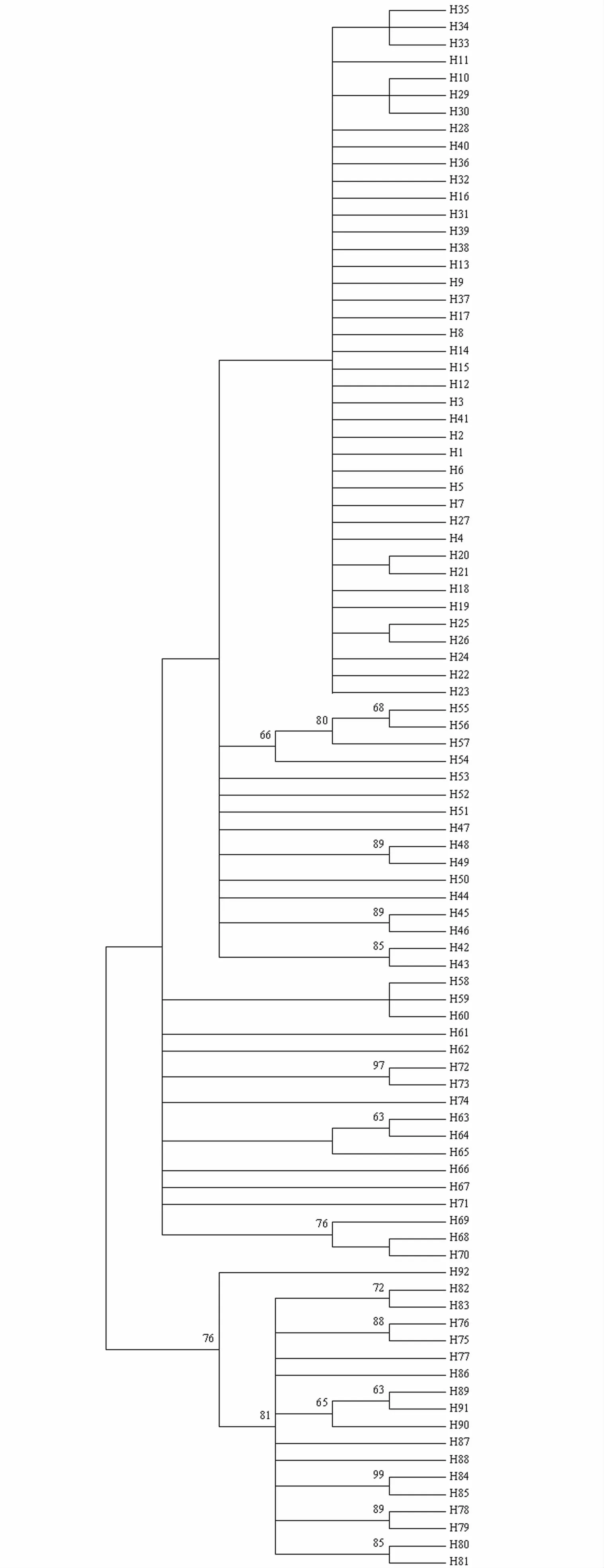
图2 基于D-loop序列构建的湖鲚单倍型系统树Fig.2 Phylogenetic tree of C.nasus taihuensis haplotypes based on D-loop sequences
3.2 湖鲚群体遗传结构
遗传分化系数Fst是衡量群体间遗传分化程度的重要参数,Fst值越大则表示遗传分化程度越大。FREELAND[34]提出,以Fst值分别是0.05、0.15和0.25为临界值指示遗传分化程度。本研究中,群体间的Fst值统计结果表明,滆湖群体与其他群体间的Fst值均大于0.15,且统计检验具有极显著性差异。除滆湖群体外,其他5个群体间Fst值为-0.022 05至0.044 66,且统计检验没有显著性差异。可以得出,滆湖群体与其他群体间具有显著遗传分化,而其他群体间无遗传分化。湖鲚群体总的Fst值为0.061 99,且具有极显著性差异,也说明部分群体间出现显著遗传差异。从单倍型系统进化树和网络进化图来看,较多的滆湖群体独享单倍型形成了置信度较高的进化谱系,支持了湖鲚群体的遗传结构。
一般来说,鱼类的遗传分化格局与其分布的水系格局及地理距离密切相关[35-36],并受到多种因素的影响,比如鱼类生活史、环境因素及进化历史等[24,31,37-38]。本研究结果显示,淮河水系的4个湖鲚群体没有出现显著性遗传差异,而长江水系的滆湖和太湖群体出现极显著的遗传分化;太湖群体与淮河水系的4个群体没有形成显著性遗传分化,而滆湖群体与淮河水系的4个群体形成显著的遗传差异。MA等[31]基于线粒体D-loop区序列对我国4个水系的10个湖鲚群体的遗传结构进行分析,发现10个群体之间存在遗传差异,基因交流受到限制,水文地理隔离是导致种群遗传分化的主要因素。湖鲚喜集群,且游泳迅速,具有较强的种群扩散能力,有利于群体间的基因交流[12]。另外,水系连通是鱼类扩散和基因交流的重要途径[39]。历史上,太湖与淮河水系的高邮湖、洪泽湖和骆马湖等湖泊通过京杭大运河流通;近年来,通过京杭大运河实施南水北
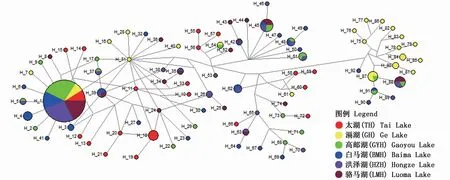
图3 湖鲚单倍型网络图Fig.3 Parsim ony network of C.nasus taihuensis hap lotypes
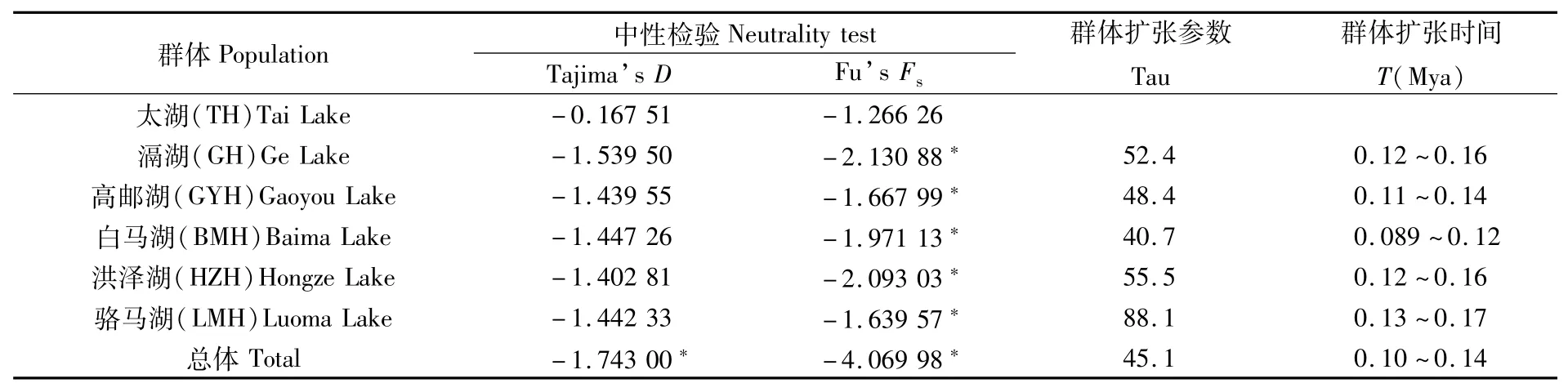
表4 基于D-loop序列的湖鲚群体中性检验及扩张时间估算Tab.4 Statistical tests for neutrality and time of expansion of C.nasus taihuensis based on D-loop sequences
调及引江济太等水利措施,均有利于湖泊间湖鲚种群扩散,消除群体间遗传差异[39]。滆湖虽与太湖同属长江水系,距离较近,但可能受堤坝涵闸的阻碍及生态环境差异而形成地理隔离。另外,从群体历史动态来看,除滆湖外的其他5个群体受环境影响较大,经历了显著的种群扩张过程,扩张时间约为0.160至0.089百万年前,这一时期处于更新世晚期,全球气候变化剧烈,历经第四纪冰期和间冰期气候的交替变化,对鱼类生物多样性及分布格局具有重要影响[8,35-37]。滆湖群体受环境影响较小,种群较为稳定,没有经历显著的种群扩张,滆湖群体的部分个体躲过了不利环境的干扰,经历了长时间相对的稳定进化,与其他群体形成了遗传分化。
3.3 湖鲚资源的管理和利用
作为一种小型鱼类,湖鲚已成为江苏省淡水湖泊鱼类群落中的优势种群,是渔业生产的重要捕捞对象,同时也面临资源过度开发利用、种群组成趋于低龄化等问题。本研究结果显示,江苏省6个湖鲚群体的遗传多样性较为丰富,具有高单倍型多态性和低核苷酸多态性的特点。6个群体中,滆湖群体的遗传多样性水平最高,拥有的独享单倍型最多,且与其他5个群体间有极显著的遗传分化,因此,应将滆湖群体单独作为一个进化显著单元进行管理,可建立滆湖湖鲚水产种质资源保护区,保护特有的湖鲚遗传资源;其他5个群体作为一个整体进行管理和利用,对其中高邮湖和洪泽湖等遗传多样性较低的群体,应进行重点保护。一方面,需要严格控制湖泊渔业资源的捕捞强度,禁止对湖鲚资源过度开发利用,可通过延长禁渔期、增大渔具网目尺寸及提高开捕年龄来优化湖鲚种群年龄组成。另一方面,可通过适量增殖放流肉食性的翘嘴鲌(Culter alburnus)、鳜(Sinipercachuatsi)等鱼类,调控湖鲚种群数量,改善湖泊鱼类群落结构,避免鱼类群落结构小型化,促进湖泊渔业资源可持续健康发展。
——高邮博物馆精华演绎

