黏虫UDP-葡萄糖基转移酶UGT33J12基因序列分析及对两种杀虫剂的响应
樊 东 ,王继伟,司修洋,郭 奇,周礼厚
(东北农业大学农学院,哈尔滨 150030)
UDP-葡萄糖基转移酶(UDP-glycosyltransfer⁃ases,UGTs)是一类广泛存在于动物、植物、细菌以及病毒内多功能超家族酶[1]。UGT糖基化作用参与多种生理代谢过程[2],如哺乳动物胆汁酸和甾类物质生理代谢[3-4],以及昆虫角质层、色素和嗅觉形成[5]。此外,昆虫还可利用其降解食物中有毒物质[6],甚至通过调节UGT基因表达水平改变杀虫剂抗性[7]。近年研究发现,UGT对杀虫剂解毒代谢具有十分重要作用[8-9]。例如,利用溴氰菊酯和吡唑硫磷分别处理棉铃虫Helicoverpa armigera和家蝇Musca domestica后,可显著提高虫体内UGT 活性,增强杀虫剂抵抗性[10-11]。该基因家族具有众多成员[12],昆虫体内可同时表达多个UGT 基因。过表达UGT2B17 基因可显著增强小菜蛾(Plutella xylo⁃stella)对氯虫苯甲酰胺抗性[13];棉蚜(Aphis gossy⁃pii)UGT348A2、UGT344B4 以及UGT344J2 基因过表达可提高棉蚜对噻虫嗪抗性[14]。研究表明,UGT基因在抗性品系中表现趋同进化模式,该基因可能与拟除虫菊酯[15]、氨基甲酸酯[16]和新烟碱类[17]等抗性相关。
高效氯氟氰菊酯和氯虫苯甲酰胺是两种常用杀虫剂,对田间黏虫幼虫具有较好防治效果。高效氯氟氰菊酯,是一种高效、速效Ⅱ型拟除虫菊酯类杀虫剂,以触杀作用为主,可有效防治多种农业害虫。作用机理为通过直接或间接刺激昆虫神经细胞,引发昆虫麻痹及神经性抽搐,致昆虫死亡[18]。氯虫苯甲酰胺是一类高效二酰胺类杀虫剂,对昆虫天敌相对安全[19]。作用机理是苯甲酰胺结合昆虫体内鱼尼丁受体(Ryanodine receptor,RyR),导致钙离子浓度升高,细胞内渗透压失衡,抑制昆虫取食,引起昆虫肌肉收缩,造成昆虫瘫痪、死亡[20]。伴随两种杀虫剂使用频率增加,害虫对于两种杀虫剂敏感性也随之降低。
黏虫(Mythimna seperata),是粮食作物重要害虫之一[21],除在我国新疆和西藏情况不明外,在其他省市地区均有分布[22]。该虫属于鳞翅目(Lepidop⁃tera),夜蛾科(Noctuidae),具有暴食性、杂食性、迁飞性等特点,对于禾本科作物危害十分严重[23]。目前,主要以杀虫剂等化学手段防治黏虫,但针对黏虫抗药性研究较少。研究表明,UDP-葡萄糖基转移酶可能参与昆虫对杀虫剂解毒代谢过程,该过程和昆虫抗药性有关[24]。但UDP-葡萄糖基转移酶对高效氯氟氰菊酯和氯虫苯甲酰胺两种杀虫剂响应却鲜有报道。本文基于黏虫转录组数据,获得黏虫一条新的UGT33J12基因,测定其在黏虫体内经高效氯氟氰菊酯与氯虫苯甲酰胺不同时间和浓度诱导下表达特征,为进一步研究黏虫抗性机理和黏虫防治奠定基础。
1 材料与方法
1.1 供试虫源、药剂
本试验所用黏虫采自东北农业大学向阳试验示范基地玉米试验田,采集后放入人工气候箱内,用新鲜玉米叶饲养,气候箱温度设置为(25±2)℃,相对湿度设置为70%,光周期为14L:10D。待养至成虫后,5%蜂蜜水饲喂,并在养虫笼中悬挂透明褶皱塑料绳,用以成虫产卵,待卵孵化出幼虫后,继续放入人工气候箱中,饲养至不同发育阶段备用。试验所用5%高效氯氟氰菊酯乳油购自德强生物股份有限公司;20%氯虫苯甲酰胺悬浮剂购自美国杜邦公司。
1.2 UGT33J12基因获得与分析
在黏虫不同发育阶段,分别选取黏虫卵、一至六龄幼虫、蛹期和成虫,送至安诺优达基因科技公司作转录组测序,基于数据分析及序列比对得到黏虫UDP-葡萄糖基转移酶基因,使用Primer 5 软件设计全长引物MsUDP-F和MsUDP-R(见表 1)。
通过PCR 扩增并测序后将结果与转录组数据库获得序列比对,验证基因正确性。将验证的UGT基因cDNA序列提交至UGT国际命名委员会命名并登录GenBank。
利用NCBI 预测基因开放阅读框(Open reading frame,ORF)并翻译成氨基酸序列;利用ProtParam工具(https://web.expasy.org/protparam/)分析氨基酸序列等电点和分子质量[25];利用SignalP 4.1 Server在线软件预测UGT信号肽[26];功能域分析参照王政全等UGT基因序列及进化分析方法[27];根据获得的黏虫UGT33J12 氨基酸序列,在NCBI 网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上比对并搜索下载昆虫UGT氨基酸序列,应用MEGA 7.0软件构建系统进化树[28]。
表1 引物序列及用途Table 1 Primer sequence and its application
1.3 黏虫UGT33J12对杀虫剂诱导的响应
1.3.1 杀虫剂处理黏虫
选用发育正常四龄第1天黏虫幼虫,将高效氯氟氰菊酯稀释成5 个不同浓度梯度,分别为1.04、2.08、4.17、8.33、16.67 μg·mL-1,以超纯水为对照。在黏虫幼虫第2~3腹节间点滴0.5 μL高效氯氟氰菊酯,点滴30头,设3次重复。处理后置于人工气候箱中正常饲养,24 h后观察死亡数量,根据供试虫数和死亡数,利用SPSS 21.0软件计算确定高效氯氟氰菊酯对黏虫LD10、LD30和LD50值。将高效氯氟氰菊酯稀释为3个不同剂量(LD10、LD30和LD50)。点滴0.5 μL LD10、LD30和LD50高效氯氟氰菊酯于四龄第1天黏虫幼虫第2~3腹节间,每组试验选取50头黏虫幼虫试验,3 次重复,取样时间为处理3、6、12、24和48 h后,每个重复收集5头存活幼虫,迅速放到液氮中处理,后保存于-80 ℃冰箱备用。
选用发育正常四龄第1天黏虫幼虫,将氯虫苯甲酰胺稀释成5 个不同浓度梯度,分别为0.3125、0.625、1.25、2.5、5 μg·mL-1,以超纯水为对照。将玉米叶片剪成1 cm2等面积碎片,碎片浸泡在氯虫苯甲酰胺药剂中2~3 s,风干后饲喂幼虫,试验组和对照组各饲喂30头,设3次重复。在人工气候箱中正常饲养24 h后调查黏虫死亡数,根据供试虫数和死亡数,利用SPSS 21.0 软件计算确定氯虫苯甲酰胺对黏虫LD10、LD30和LD50值。将氯虫苯甲酰胺稀释为3 个不同剂量(LD10、LD30和 LD50)。饲喂四龄第1 天黏虫幼虫LD10、LD30和LD50不同剂量氯虫苯甲酰胺,每个剂量处理和对照均饲喂50 头,设置3次重复,取样时期及方法同上。
1.3.2 黏虫总RNA提取和cDNA反转录
利用RNA 提取试剂盒TRIzol(购自Invitrogen)提取不同处理黏虫总RNA。试验所需研磨管、移液枪头等耗材需经0.1% DEPC 水浸泡24 h 并高温高压灭菌,防止提取过程中RNA 发生降解。试验过程均为无菌环境,需佩戴口罩、手套。提取RNA使用紫外分光光度计确定浓度。使用TOYOBO反转录试剂盒,按照使用说明,取2 μL RNA,在65 ℃金属浴中加热5 min后取出立即冷却,冷却后根据cDNA 反转录总体系,补充10 μL ddH2O,再加入 4 μL 混有gDNA Remover 的4×DN Master Mix,瞬离后转移至PCR 仪中37 ℃处理5 min,再加入4 μL 5×RT Master MixⅡ,37 ℃处理1 h,98 ℃处理5 min。反转录后cDNA于-20 ℃冰箱保存用于后续试验。
1.4 黏虫UGT33J12基因表达分析
设计荧光定量引物UGT33J12- q- F和UGT33J12-q-R(见表 1),以黏虫β-actin和MsGAP⁃DH作为内参基因,设计内参基因引物β-actin-F、β-actin-R和MsGAPDH-F、MsGAPDH-R(见表1),应用TOYOBO 公司荧光定量染料THUNDERBIRD SYBR qPCRMix和Bio-Rad公司荧光定量PCR仪作qRT-PCR 分析。采用双内参计算基因相对表达量[29],即取两个内参基因CT值几何平均值结合2-ΔΔCT法[30],应用SPSS 21.0软件统计分析数据。
2 结果与分析
2.1 黏虫UGT33J12基因序列分析
通过转录组测序数据鉴定得到一条新黏虫UDP-葡萄糖基转移酶基因,经UGT 国际命名委员会命名为UGT33J12,基因序列已提交至Gen⁃Bank,登录号为MT873954。UGT33J12 基因全长1 798 bp,含有一个开放阅读框,长度为1 557 bp,编码518个氨基酸(见图1)。UGT33J12基因编码氨基酸N 端区域包含一个长度为20 个氨基酸信号肽序列,以及起催化作用的组氨酸(H)和天冬氨酸(D);C 端区域包含两个供体结合区(Donor binding regions,DBRs)和一个保守特征性基序;在供体结合区中,鉴定得到8个关键氨基酸残基,包括与核苷酸相互作用丝氨酸(S)、色氨酸(W)、谷氨酰胺(Q)和谷氨酸(E),与含磷化合物相互作用苏氨酸(T)和谷氨酰胺(Q)以及糖苷相互作用天冬氨酸(D)和谷氨酰胺(Q)。利用在线软件ProtParam 预测UGT33J12 基因编码氨基酸理化性质,其分子质量为58.95 ku,等电点为8.62。

图1 黏虫UGT33J12基因核苷酸序列及蛋白序列比对分析Fig.1 Nucleotide sequence and amino acid sequence of UGT33J12 in M.separata
2.2 黏虫UGT33J12 基因氨基酸序列系统进化树构建
在NCBI数据库中选取其他夜蛾科昆虫UGT氨基酸序列,与黏虫UGT33J12氨基酸序列作多重序列比对(见图2)。参与比对的氨基酸序列长度较接近,均位于514~520 aa。黏虫M.separata(MT873954)与斜纹夜蛾Spodoptera litura(XP_022837581.1)UGT相似性最高,达78.19%;与草地贪夜蛾Spodoptera frugiperda(QGA73338.1)相似性为77.15%、海灰翅夜蛾Spodoptera littoralis(AHY99682.1)相 似 性为77.78%、甜菜夜蛾Spodoptera exigua(ANI21993.1)相似性为77.41%、棉铃虫H.armigera(AEW43118.1)相似性为 75.14% 、 烟芽夜蛾Heliothis virescens(PCG63789.1)相似性为73.22%、粉纹夜蛾Tricho⁃plusia ni(XP_026736016.1)相似性为62.12%。
在NCBI 数据库中通过Blastp 比对搜索,选取斜纹夜蛾S. litura(XP_022837581.1)、草地贪夜蛾S. frugiperda(QGA73338.1)、海灰翅夜蛾S. littoralis(AHY99682.1)、甜菜夜蛾S.exigua(ANI21993.1)、棉铃虫H.armigera(AEW43118.1)、烟芽夜蛾H.virescens(PCG63789.1)、粉纹夜蛾T.ni(XP_0267360 16.1)、玉带凤蝶Papilio polytes(XP_013139422.1)、柑橘凤蝶Papilio xuthus(XP_013168850.1)、烟草天蛾Man⁃duca sexta(XP_037300055.1)、亚洲玉米螟Ostrinia furnacalis(QNS26323.1)、二化螟Chilo suppressalis(QBK47157.1)氨基酸序列,与黏虫M. separata(MT873954)氨基酸序列通过MEGA 7.0 软件ML 法构建进化树(见图3)。

图2 黏虫UGT33J12与其他夜蛾科昆虫UGT氨基酸多重序列比对Fig.2 Multiple sequence alignment of UGT33J12 in M.separata and other UGT amino acids in Noctuidae insects

图3 黏虫与其他昆虫UGT蛋白系统发育树Fig.3 Phylogenetic tree of UGT protein in M.separata and other insects
由图3可知,黏虫M.separata(MT873954)与斜纹夜蛾S. litura(XP_022837581.1)、草地贪夜蛾S.frugiperda(QGA73338.1)、海灰翅夜蛾S. littoralis(AHY99682.1)、甜菜夜蛾S. exigua(ANI21993.1)、棉铃虫H.armigera(AEW43118.1)、烟芽夜蛾H.vi⁃rescens(PCG63789.1)聚在同一分支上,亲缘关系较近;与粉纹夜蛾T.ni(XP_026736016.1)亲缘关系稍远;与玉带凤蝶P.polytes(XP_013139422.1)、烟草天蛾M. sexta(XP_037300055.1)等昆虫亲缘关系更远。
2.3 杀虫剂对黏虫UGT33J12基因表达量的影响
2.3.1 高效氯氟氰菊酯对UGT33J12 基因表达量的影响
采用不同剂量高效氯氟氰菊酯对黏虫幼虫经不同时间处理后,UGT33J12 基因转录水平存在显著差异。相同剂量不同时间处理条件下,LD10处理3、6 和12 h,基因表达量无显著差异,处理24 和48 h,基因表达量显著升高;LD30处理3和48 h,基因表达量无显著差异,但处理12和24 h,基因表达量显著升高;LD50处理12和24 h,基因表达量显著升高。相同时间不同剂量处理条件下,处理3 h,基因表达量均下调,但不同剂量之间无明显差异;处理6 h,LD30剂量诱导下,基因表达量显著下调;处理12 h,LD30和LD50剂量诱导下,基因表达量显著升高;处理24 h,基因表达量均显著升高;处理48 h,LD10剂量诱导下,基因表达量显著升高(见图4)。
2.3.2 氯虫苯甲酰胺对UGT33J12 基因表达量的影响
采用不同剂量氯虫苯甲酰胺对黏虫幼虫处理不同时间后,UGT33J12 基因表达量存在显著差异。相同剂量不同时间处理条件下,LD10处理3、6和12 h,基因表达量显著下调,处理24 和48 h,基因表达量显著升高;LD30处理6 h,基因表达量显著下调表达,但处理3、12、24和48 h,基因表达量显著升高;LD50处理6 h,基因表达量显著下调表达,但处理3、24和48 h,基因表达量显著升高。相同时间不同剂量处理条件下,处理3 h,LD10剂量处理表达量显著下调,但LD30和LD50剂量处理表达量显著升高;处理6 h,基因表达量均显著下调;处理12 h,LD10剂量处理表达量显著下调,但LD30剂量处理表达量显著升高;处理24 和48 h,基因表达量均显著升高,其中LD30剂量显著诱导UGT33J12基因表达最高(见图5)。
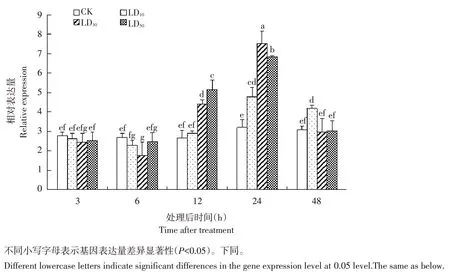
图4 高效氯氟氰菊酯处理不同剂量和不同时间黏虫UGT33J12基因相对表达量Fig.4 Relative expression levels of UGT33J12 treated by different doses lambda-cyhalothtin under different time
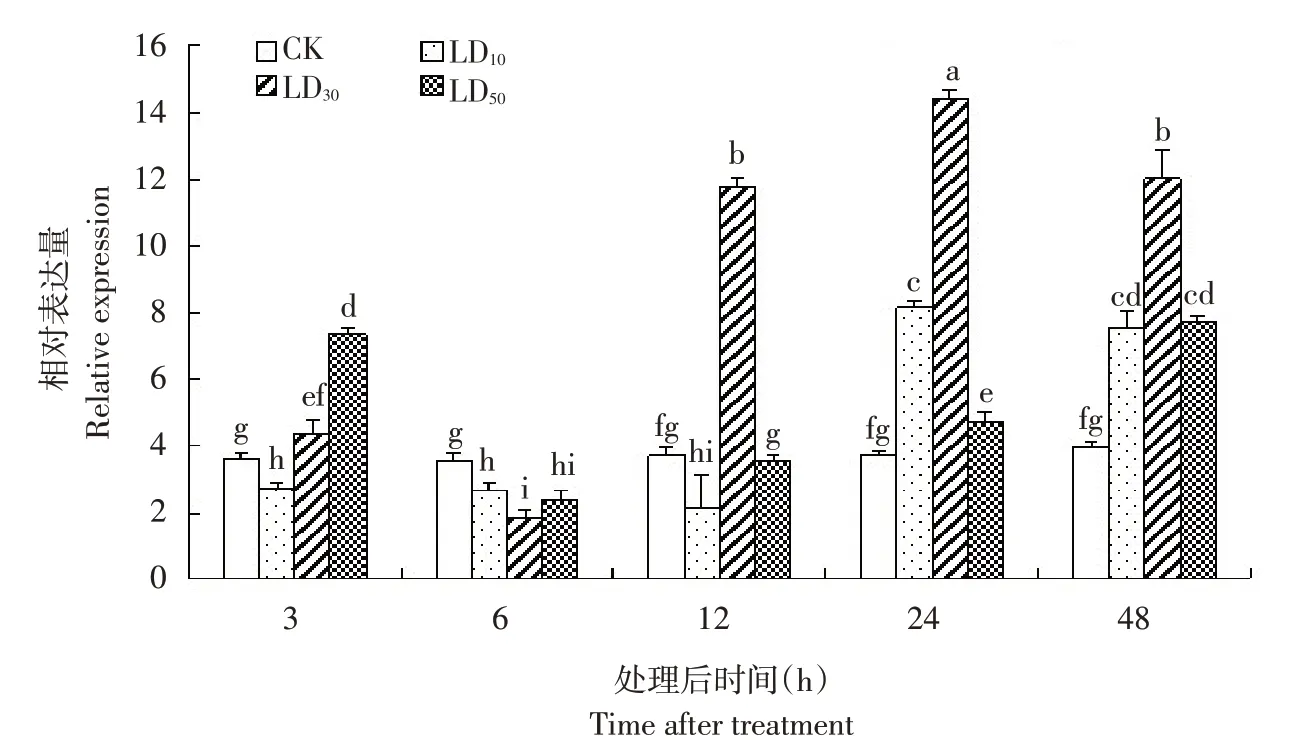
图5 氯虫苯甲酰胺不同剂量和不同时间处理后黏虫UGT33J12基因相对表达量Fig.5 Relative expression levels of UGT33J12 treated by different doses chlorantraniliprole under different treatment time
3 讨论与结论
UDP-葡萄糖基转移酶参与动物、植物、细菌和病毒等生物体内各种化合物解毒。将核苷酸糖中糖基团催化形成亲水性化合物并有效排泄[31]。本试验基于转录组数据鉴定并克隆一条新黏虫UDP-葡萄糖基转移酶基因cDNA全长序列,经UGT国际命名委员会命名为UGT33J12,并登录GenBank。经序列相似性比对,与其他昆虫UGT高度同源。
已有研究表明,UGTs 基因过度表达,有助于增强马铃薯叶甲对吡虫啉的抗性[32]。棉铃虫经啶虫脒、吡虫啉处理后,体内葡萄糖基转移酶表达量升高,推测该酶过量表达参与昆虫对杀虫剂的解毒代谢[33]。通过抑制棉蚜体内UGTs 活性,棉蚜对噻虫嗪处理的敏感度显著提高,说明棉蚜UGT 基因在对噻虫嗪抗性中发挥重要作用[14]。甜菜夜蛾脂肪体细胞经高效氯氟氰菊酯、氯虫苯甲酰胺等杀虫剂处理后,显著诱导UGT 基因表达,致使表达水平均明显升高[34]。褐飞虱UGT-1-7和UGT2B10基因被抑制后,显著降低对吡虫啉抗性[35]。
本试验研究黏虫UGT33J12 基因杀虫剂诱导后表达情况,经不同剂量与不同时间处理后,黏虫UGT33J12 基因表达水平也有差异。不同剂量高效氯氟氰菊酯处理12 和24 h,UGT33J12 相对表达量均出现上调表达,LD10处理48 h,基因表达也产生诱导作用,说明UGT33J12基因相对表达量提高与处理时间和剂量均有关系,UGT33J12 可能参与黏虫对高效氯氟氰菊酯解毒作用。处理3 和6 h,基因表达量均出现下调现象,可能是由于虫体点滴药剂后出现中毒现象,基因表达被抑制,短时间内无法调节。利用不同剂量氯虫苯甲酰胺处理24和 48 h, LD30、 LD50处 理 3 h, LD30处 理 12 h,UGT33J12 相对表达量均显著上调,说明氯虫苯甲酰胺对黏虫UGT33J12基因在不同时间和剂量处理下,同样具有诱导效应。处理6 h,各浓度相对表达量均被抑制,可能是在此时间段出现中毒反应。本研究初步探索黏虫UGT33J12基因功能以及高效氯氟氰菊酯和氯虫苯甲酰胺对基因表达的影响,为了解黏虫抗药机制及应用于黏虫防治提供理论依据。

