过氧化氢(H2O2)介导的光合诱导系统信号
姜佰文,许芳维,郝新雨,周笑竹,杨晓晗,李 威
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.黑龙江省寒地黑土保护与利用重点实验室,哈尔滨 150030;3.东北农业大学生命科学学院,哈尔滨 150030)
光是植物光合作用重要因素,对植物生长及发育发挥重要作用[1]。农业生态系统中,由于冠层及叶片相互遮挡,大部分作物叶片处于遮蔽状态[2]。研究表明,约80%光合有效辐射处于短期波动,光合有效辐射主要来自于光斑[3]。因此,高效利用该部分动态光能对农业生态系统植物至关重要[4]。叶片经充分暗适应,在一定光强照射下,其光合速率需经一段时间才达到最大值。光合速率上升过程,被称为光合作用诱导过程[5]。如农作物冠层内部及底部叶片存在快速光合诱导过程,将对叶片充分利用短期动态光能发挥重要作用,实现农业生态系统中植物碳积累效率最优化。
植物体某些组织或器官受刺激后,向不受刺激组织或器官发出信号,使其表现出与刺激相对应生理状态(Systemic signaling)[6]。Karpinski等发现拟南芥部分叶片受强光刺激后引发植株光破坏防御机制上调[7];Lake等发现,拟南芥幼叶发育主要受成熟叶片所处环境影响[8];王鑫等发现高粱新生叶片光合特性及解剖结构主要受老叶诱导,与自身所处光环境无关[9];Hou 等发现酸模成熟叶片存在系统信号[10]。目前,系统信号研究多集中于拟南芥、高粱等模式作物,而关于玉米报道较少。Guo等报道,光照番茄茎尖促进IAA(吲哚乙酸)信号传导光合作用系统诱导,触发过氧化氢(H2O2)积累[11]。H2O2被认为是植物对胁迫反应信号信使[12]。Karpinski 等报道H2O2诱导拟南芥高光强胁迫下光保护作用增强[7]。研究还表明,H2O2是响应二氧化碳和臭氧所需长距离信号重要组成部分[13]。
玉米分布范围广,光合速率高,生物量大,受国内外学者关注。田强等研究表明玉米在我国农业种植中具有重要地位,对国内建设农业经济战略规划有一定影响[14]。本试验以玉米幼苗为材料,通过预先光照顶部叶片,测定叶片光合诱导过程快慢,明确农业生态系统中光合作用系统信号,为玉米如何高效利用动态光能提供理论基础。
1 材料与方法
1.1 材料
本研究以玉米先玉335幼苗为试验材料,种植在塑料盆中(直径25 cm,高20 cm),土壤为草甸土,每盆种植1株,室外环境生长,待玉米幼苗长出4片成熟叶片、株高12~17 cm时测定。
试验处理分为5组,试验前,玉米幼苗用黑色不透明塑料布遮住叶片,试验于次日8: 00 开始。5 个处理分别为:处理1,1 200 μmol·m-2·s-1PFD(Photon flux density)光强处理顶部成熟叶片40 min,其余叶片均保持遮光,然后测定底部叶片光合诱导过程以及过氧化氢含量(H2O2),以整株叶片全遮光底部叶片为对照;处理 2,1 200 μmol·m-2·s-1PFD光强处理底部成熟叶片40 min,其余叶片均保持遮光,然后测定顶部成熟叶片光合诱导过程及H2O2含量,以整株叶片全遮光顶部成熟叶片为对照;处理3,整株叶片经充分暗适应后,对底部叶片喷施10 mL 10 mmol·L-1过氧化氢溶液,以喷施10 mL 蒸馏水(H2O)为对照,经60 min 后,测定喷施H2O2和H2O 底部叶片光合诱导过程及H2O2含量;处理4,整株叶片经充分暗适应后,光照前用1 mL 10% 三氯乙酸(TCA)对顶部叶片基部处理10 h,然后1 200 μmol·m-2·s-1PFD光强处理最上端成熟叶片40 min,随后测定底部叶片光合诱导过程及H2O2含量,以不施用TCA为对照;处理5,光照前0.5 mL 50 μmol·L-1二苯基碘化钾(DPI)处理顶部叶片基部 15 min,然后 1 200 μmol·m-2·s-1PFD 光强处理最上端成熟叶片40 min,随后测定底部叶片光合诱导过程及H2O2含量,以不施用DPI 为对照。处理叶片所用光源为可调式LED冷光源(英驰RB-101,北京)。
1.2 光合诱导曲线测定
采用LI-6400 便携式光合仪(LI-COR, Lincoln,NE,USA)测定气体交换参数。顶端目标叶片光照40 min后,在1 200 μmol·m-2·s-1PFD光强下测定目标叶片光合诱导过程,测定过程中光源由光合仪提供,CO2浓度保持 380 μmol·mol-1,温度保持25 ℃,诱导时间为30 min,每60 s 自动测定1 次,并自动记录结果。根据Hou等方法[10],对光合测定值作标准化,将每次测定最大光合值设定为100%,其余测定值为:Pn(%)=实际测定值/最大值×100%。测定光合诱导曲线,每个处理选用3 盆长势一致玉米幼苗作为重复。
1.3 叶片过氧化氢含量测定
将0.5 g叶片在液氮中研磨,并用5 mL 5%(W/V)三氯乙酸提取,将混合物以10 000 r·min-1离心5 min去除沉淀物。吸取3 mL上清液,加入0.4 mL 20%四氯化钛和0.6 mL NH4OH,收集沉淀物,溶解于 2 mL 2 mol·L-1H2SO4中,415 nm 处测定吸光值。利用已知浓度H2O2溶液绘制标准曲线,计算测定溶液中H2O2浓度。
2 结果与分析
2.1 照射顶部叶片对底部叶片光合诱导过程的影响
1 200 μmol·m-2·s-1PFD光强预先照射玉米幼苗顶部成熟叶片后(见图1A),由图1 B可知,底部目标测定叶片光合诱导速率显著升高,光合速率从最低值达到最高值所用时间低于对照组,可见,强光光照玉米最顶部成熟叶片对底部叶片产生信号作用,有效缩短其光合诱导过程。顶部叶片预先受到1 200 μmol·m-2·s-1PFD 强光照射后,底部叶片在光合诱导过程12 min,光合速率已接近最高水平,而对照组叶片在光合诱导过程25 min,其光合速率接近最高水平。在光合诱导分析过程中,为更清晰明确对比光合过程所用时间,本研究对比玉米幼苗叶片光合速率达到最大光合速率50%和90%所需时间T50和T90。结果见图1C,玉米最顶部叶片预先受到 1 200 μmol·m-2·s-1PFD 光照后,底部叶片T50 和T90 极显著低于对照组(P<0.01)。其中,处理组T50 降低29%,T90 降低37%。同时,预先光照顶部叶片后,底部叶片H2O2含量极显著增加(P<0.01,见图1D)。

图1 预先光照玉米顶部叶片对玉米底部叶片光合诱导过程的影响Fig.1 Effect of pre-illuminating upper leaf on photosynthetic induction in the lower leaves of maize
2.2 照射底部叶片对顶部叶片光合诱导过程的影响
1 200 μmol·m-2·s-1PFD强光预先照射玉米幼苗底部叶片后(见图2A),由图2B可知,顶部目标测定叶片光合诱导速率无显著升高,光合速率从最低值达到最高值所需时间与对照组一致,可见,强光光照玉米底部成熟叶片无法对顶部叶片光合诱导过程产生促进作用。由图2C 可知,玉米底部叶片预先受到光照后,顶部叶片T50和T90与对照组无显著差异(P>0.05)。由图2D可知,预先光照底部叶片后,顶部叶片H2O2含量无显著增加(P>0.05)。
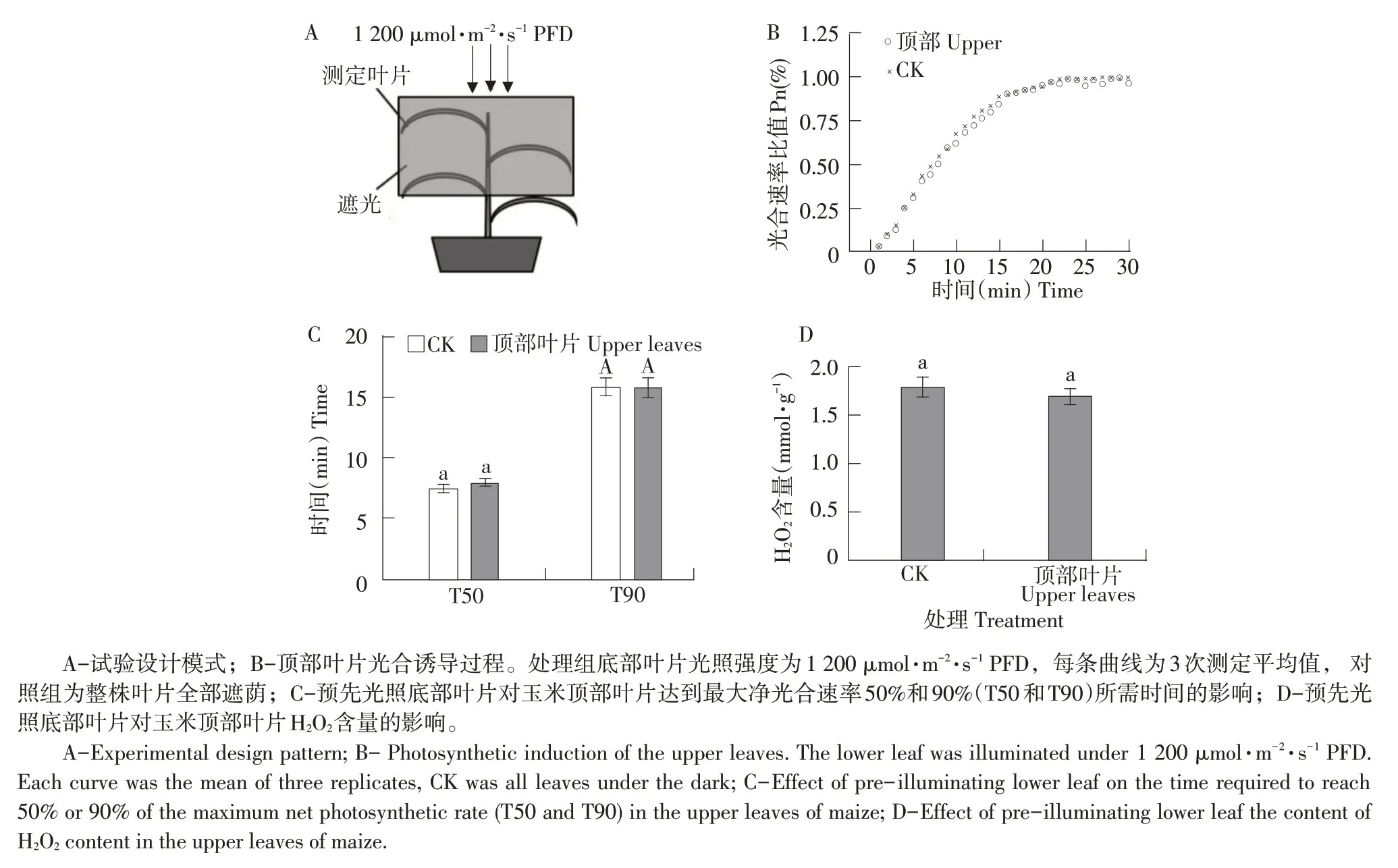
图2 预先光照玉米底部叶片对玉米顶部叶片光合诱导过程的影响Fig.2 Effect of pre-illuminating lower leaf on photosynthetic induction in the upper leaves of maize
2.3 喷施外源H2O2对底部叶片光合诱导的影响
玉米底部叶片喷施外源H2O2后(见图3A),由图3B 可知,在未预先光照顶部叶片情况下,底部叶片光合诱导速率显著升高,表明外源H2O2有促进光合诱导过程的作用。底部叶片喷施外源H2O2处理(见图3A)后,与底部叶片喷施H2O(见图3B)对比,其T50 和T90 显著降低(P<0.05,见图3C)。同时,喷施H2O2后,底部叶片H2O2含量也极显著增加(P<0.01,见图3D)。
2.4 TCA 处理顶部叶片基部对底部叶片光合诱导过程的影响
TCA 处理顶部叶片叶柄后(见图4A),即使顶部叶片预先受到1 200 μmol·m-2·s-1PFD 光照也并未促进底部叶片光合诱导速率(见图4B)。TCA 可杀死韧皮部细胞,阻止物质通过韧皮部转运,信号物质运输途径可能被阻断。当顶部叶片被1 200 μmol·m-2·s-1PFD 光强照射后,TCA 处理顶部叶片后,底部叶片H2O2含量极显著低于对照(P<0.01,见图4D),同时,其T50 和T90 显著高于对照(P<0.05,见图4C)。TCA 可杀死韧皮部细胞,阻断物质传递,表明H2O2可能通过韧皮部运输。
2.5 DPI 处理顶部叶片基部对底部叶片光合诱导的影响
由图5 可知,DPI 处理顶部叶片叶柄后(见图5A),与TCA 结果相似,即使顶部叶片受预先1 200 μmol·m-2·s-1PFD 光照,也并未促进底部叶片光合诱导速率(见图5B)。在顶部叶柄上施用DPI,在1 200 μmol·m-2·s-1PFD光照条件下,底部叶片T50、T90 以及H2O2含量仍受到抑制(见图5C、D)。说明DPI 对H2O2发挥淬灭作用,光合诱导过程可能与H2O2有关,同时光合诱导过程也受抑制。

图3 H2O2和H2O喷施玉米底部叶片对底部叶片光合诱导过程的影响Fig.3 Effect of lower leaves treated with H2O2 and H2O on photosynthetic induction in the lower leaves of maize

图4 TCA处理玉米顶部叶片基部对底部叶片光合诱导过程的影响Fig.4 Effect of the base of upper leaves treated with TCA on photosynthetic induction in the lower leaves of maize

图5 DPI处理玉米顶部叶片基部对底部叶片光合诱导过程的影响Fig.5 Effect of the base of upper leaves treated with DPI on photosynthetic induction in the lower leaves of maize
3 讨 论
生长在冠层底部或冠层内部叶片,因不同位置遮挡、空气扰动及云层遮挡等因素,难以保证持续稳定光照,一般情况为光斑照射[15-16]。研究表明,光层底部叶片接受光能70%以上属于短期波动光斑。所以,高效利用这部分短暂光能,是光层底层植物生存关键[17];同时,高效利用这部分短暂光能,对冠层底部或冠层内部叶片碳积累具有重要意义[18-19]。研究表明,冠层底部叶片具有较高Rubisco 活化酶活性,所以其具有较快光合诱导过程[20]。然而,因较高Rubisco 活化酶活性依赖于较高ATP/ADP 比率,维持较高Rubisco活化酶活性需消耗较多能量[21-22]。因此,遮阴状态下,维持较高Rubisco 活化酶活性造成植物消耗能量巨大。光斑仅覆盖植物较小部分,同时光斑也可能转移至植株其他部分,通过预先光照冠层顶部叶片产生的系统信号,可使其他叶片准备好预期光照,植物可能以最小的代价高效利用光斑。所以,系统调控对植物光合诱导具有至关重要的作用。
目前,Karpinski 等[7]、Lake 等[8]、Hou[10]等已发现拟南芥和酸模叶片存在长距离信号传递,拟南芥新生叶片解剖结构主要由老叶所处光环境决定,而与自身所处光环境关系不显著;而酸模成熟叶片之间,也存在光合诱导系统信号。本试验表明,预先光照玉米顶部叶片可促进中部和底部叶片光合诱导过程,表明玉米也存在光合诱导信号。这种信号对草本植物具有重要意义,使叶片更高效利用光能,增加碳同化量。但关于信号传递途径,尚不清楚。相关研究认为信号物质可能是通过木质部、韧皮部运输到目的组织或器官[23-24],也有研究认为是电讯号[25]。TCA 杀死韧皮部细胞,使物质无法通过韧皮部运输。
4 结论
从试验结果可见,玉米成熟叶片之间存在系统信号,这种信号显著提高光合诱导过程,提高玉米叶片对光斑利用效率。本试验研究表明,TCA处理顶部叶片后,即使顶部叶片受到强光照射,也无法促进底部叶片光合诱导过程。所以,光合诱导信号可能通过韧皮部介导。强光照射顶部叶片,使底部叶片H2O2含量升高;TCA 处理顶部叶片基部,即使顶部叶片照射强光也无法增加底部叶片H2O2含量,表明H2O2是通过韧皮部转运,同时,也抑制底部叶片光合诱导过程,表明H2O2可能是信号物质。为进一步证明H2O2信号物质作用,利用DPI处理顶部叶片基部,发现DPI处理后,即使顶部叶片照射强光也无法增加底部叶片H2O2含量,同时,也抑制底部叶片光合诱导过程。DPI可猝灭H2O2,进一步表明,H2O2在光合诱导中的信号物质作用,且信号具有方向性,仅从上至下传导。

