大豆再生相关性状QTL定位
滕卫丽,郑立娜,张 琦,赵 雪,韩英鹏,李文滨
(东北农业大学大豆研究所,大豆生物学教育部重点实验室,农业农村部东北大豆生物学与遗传育种重点实验室,哈尔滨150030)
大豆(Glycine maxL.)起源于中国,种植历史悠久,其种子富含植物蛋白质和油脂,是世界上重要粮油兼备作物[1]。近年来,转基因大豆种植面积逐年增加,是目前为止全球种植面积最大[2-3]、商业化程度最高的转基因农作物[4],主要栽培于美国、巴西、阿根廷、加拿大和印度[5]。转基因大豆种植提高社会经济效益,加快转基因育种步伐[6]。我国大豆产业存在单产偏低、种植成本偏高等现象,现已成为世界最大大豆消费国和进口国[7]。加快国内转基因技术研究对于改变大豆产业被动局面具有重要意义。
植物转基因技术是将外源基因通过生物技术导入受体植物基因组中并稳定表达,产生抗病虫、抗除草剂、抗逆、高产、营养品质改良等满足人类需求的技术[8]。转基因技术相比于传统育种技术,打破物种间生殖隔离,促进不同物种间遗传物质交流,降低不良突变效率[9]。大豆相较于玉米和水稻遗传转化效率较低[10]。转基因技术关键在于外源基因稳定高效导入受体细胞和转化细胞再生出完整植株。建立高效稳定大豆再生体系是开展大豆遗传转化的前提[11]。大豆基因型较大程度上决定大豆遗传转化效率,不同基因型之间农杆菌易感性和组织培养再生率存在显著差异[12],提高大豆遗传转化效率和再生效率关键在于筛选再生能力较强基因型。
王立平等综合国内外学者研究发现,器官发生再生系统和胚状体再生系统等主要遗传转化体系转化效率对大豆基因型具有较高依赖性[3]。翟锐等以17 个大豆品种作为易感基因型和高再生基因型筛选对象,结果表明TL-1 极显著优于其他基因型,Williams 82、HC-6、HC-3次之[13]。李文霞等以11 个大豆品种为材料研究基因型对农杆菌敏感度,结果表明,黑农35是最易感大豆基因型,其次为绥农14和合丰35,易感性最差品种是黑农44[14]。李思楠等以再生能力较好的东农50 在2,4-D 浓度为4 mg·L-1时再生率最高[15]。张伟伟等将抗逆转录因子基因HhERF转入再生能力强百脉根中分析抗逆能力,筛选获得抗性百脉根植株96 株,转化率达到24%[16]。
本研究利用高再生率大豆品种合丰25 和低再生率大豆品系L-28及其衍生重组自交系群体(RIL)100个家系作为试验材料,评价其再生率并作QTL定位分析,为探索大豆再生规律、提高大豆遗传转化效率、加快培育转基因大豆新品种奠定基础。
1 材料与方法
1.1 试验材料
本研究选用当地品种合丰25和L-28衍生重组自交系群体100个家系。
1.2 再生试验方法
1.2.1 种子灭菌及萌发
挑选颗粒完整且饱满、健康无病无斑、成熟干燥种子单层平铺于玻璃培养皿中,75%乙醇擦拭种皮表面,再将培养皿置于干燥器中(通风橱中完成),将1 个装有96 mL 次氯酸钠锥形瓶置于靠近干燥器内壁位置,加盖但保留缝隙,向锥形瓶中加入6 mL 浓盐酸,迅速盖严干燥器,灭菌16 h后,打开干燥器,盖好培养皿。
将灭菌后大豆种子在超净台中打开,风干30 min。取出接种到GM 萌发培养基,萌发5~6 d,直至种子发芽变绿。
1.2.2 外植体制备
将发芽大豆去掉种皮,切除多余下胚轴部分,保留全部子叶和2~3 mm下胚轴,在两片子叶沿中线纵向切开,且平分下胚轴,去子叶节点部位残留大芽,刮掉侧芽(见图1)。

图1 外植体制备Fig.1 Preparation of explants
1.2.3 丛生芽诱导
将子叶节接种在SSIM-恢复固体培养基中,经(25±1)℃,16 h/8 h培养13~15 d,诱导丛生芽,统计丛生芽诱导率。
1.2.4 伸长芽诱导
切除外植体子叶,刮掉不定芽上多余培养基,并切除丛生芽上诱导出的茎叶,仅留下诱导的一簇小芽,插入SEM伸长培养基中。
每隔14 d 继代1 次,每次继代均制备新的伤口,以便丛生芽更好吸收培养基中养分,接种至伸长培养基28 d后统计丛生芽伸长率。
1.2.5 生根与移栽
伸长出枝条长至3~5 cm 时,切下伸长出枝条,转移至RM生根培养基中,诱导生根。长出2~3条主根后,去除培养基,在三角瓶中加入自来水(水面在根上方)炼苗2~3 d,移栽到草炭土与蛭石为1∶1花盆。
1.2.6 大豆子叶节法再生体系过程
大豆子叶节法再生体系过程如图2所示。
1.2.7 培养基组成
外植体在组织培养各阶段所需培养基成分如表1所示。

图2 子叶节法评价再生率流程Fig.2 Flow chart of cotyledon section method for regeneration in soybean
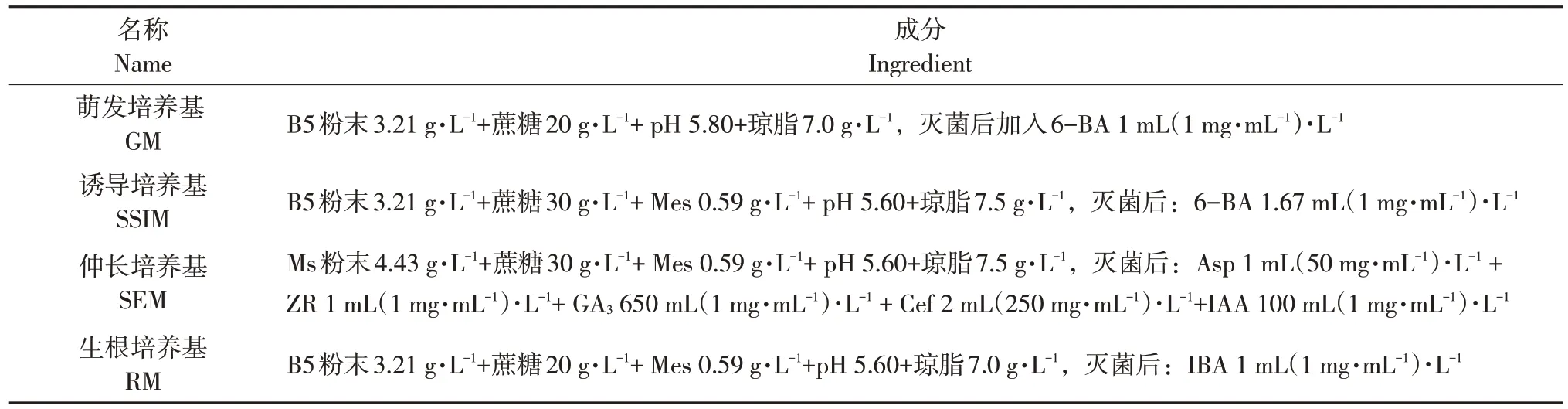
表1 培养基组成Table 1 Composition of the medium
1.2.8 再生率计算方法
每个试验品种每个处理40个外植体,3次重复。
不定芽诱导率(%)=出芽外植体数/接种外植体数×100;
不定芽伸长率(%)=芽长大于2 cm 外植体数/接种外植体数×100;
不定芽生根率(%)=生根外植体数/接种外植体数×100;
不定芽成苗率(%)=成苗外植体数/接种外植体数×100。
1.3 表型数据分析与处理
采用SPSS 19.0 数据处理系统统计分析大豆RIL群体再生评价指标。
1.4 QTL分析
利用IciMapping 4.0 软件中完备区间作图法(ICIM)分析大豆RIL群体4个再生性状QTL定位。
2 结果与分析
2.1 大豆RIL群体再生率评价
2.1.1 RIL群体再生性状方差分析
对高再生率大豆品种合丰25 与低再生率大豆品系L-28杂交衍生重组自交系群体100份家系4个再生性状作方差分析(见表2)。结果表明,丛生芽诱导率、伸长率、生根率和成苗率P值均小于0.01,即4个再生性状均达极显著,说明该性状在RIL群体不同家系间存在显著差异,不同大豆家系间再生率差异较大。
2.1.2 RIL群体再生性状相关性分析
分析大豆RIL 群体4 个再生性状相关性(见表3)。结果表明,丛生芽诱导率与伸长率、生根率和成苗率呈极显著正相关,伸长率与生根率和成苗率呈极显著正相关,生根率与成苗率呈极显著正相关。
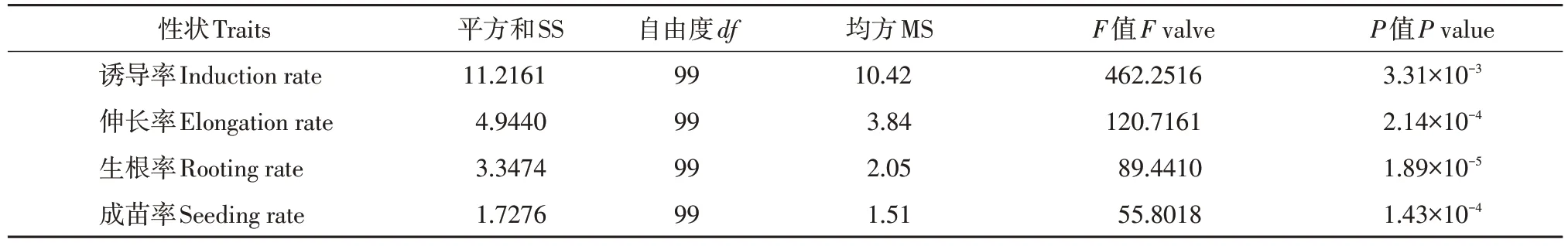
表2 大豆RIL群体4个再生性状方差分析Table 2 Variance analysis of four traits correlated with regeneration of RIL population in soybean
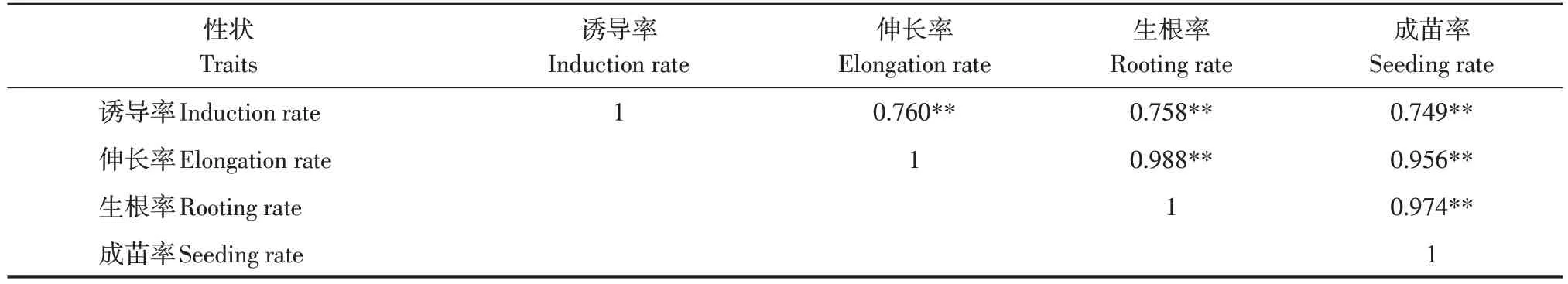
表3 大豆RIL群体4个再生性状相关性分析Table 3 Correlation analysis of four traits correlated with regeneration of RIL population in soybean
2.1.3 大豆再生性状分布特点
本研究分析大豆RIL群体100个家系丛生芽诱导率、伸长率、生根率和成苗率分布特点(见图3)。大豆丛生芽诱导率为22.41%~96.67% ,其中诱导率50%以上家系占66%,诱导率90%以上和30% 以下家系较少,分别占3%和2%,说明大部分家系再生诱导率较高,但无法用单一指标评价大豆家系再生能力。
大豆伸长率为0~93.33%,其中0~40%家系占62%;伸长率90%以上和10%以下家系较少,分别占1%和4%。说明大部分家系伸长率较低,可与诱导率结合筛选大豆再生率高家系。
大豆生根率为0~88.33%,其中40%以下家系占67%,生根率在80%以上家系较少,占2%。说明大部分家系生根率较低,在丛生芽伸长出枝条基础上生根,所以生根率与伸长率变化趋势接近。
大豆成苗率为0~80%,其中成苗率30%以下家系占65%,成苗率60%以上家系较少,占6%,说明大部分家系成苗率较低,成苗是在伸长和生根基础上,导致成苗率与伸长率、生根率变化趋势接近。移栽时受周围环境条件和自身生长情况影响,可能导致部分移栽苗在生长过程中死亡,所以大豆再生成苗率偏低。
分析大豆RIL 群体4 个再生性状频数分布(见图3),可看出,诱导率、伸长率、生根率和成苗率4个性状均表现为连续单峰曲线,符合正态分布特征,因此,上述大豆再生性状在RIL群体中分布属于典型多基因数量遗传。
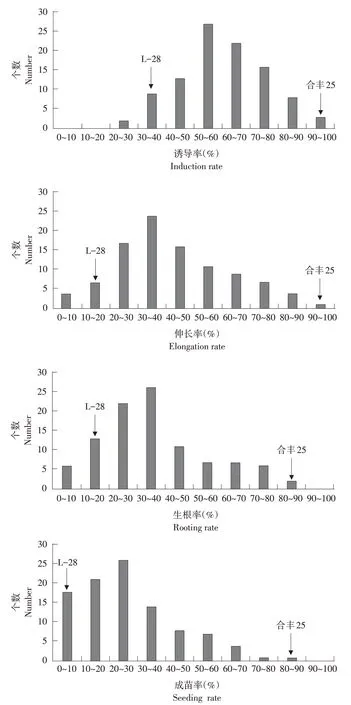
图3 大豆RIL群体4个再生性状分布Fig.3 Distribution of four traits correlated with regeneration of RIL population in soybean
以母本合丰25、父本L-28 以及4 个家系HP116、HP115、HP93 和 HP92 为例,研究丛生芽诱导、丛生芽伸长、生根和移苗4个时期生长势情况(见图4),合丰25、HP116和HP115丛生芽诱导率为85.00%~96.67%,L-28、HP93和HP92丛生芽诱导率为22.50%~45.61%,再生率为HP116>合丰25>HP115>HP92>HP93>L-28。
2.1.4 大豆RIL群体再生优异家系筛选
本研究评价大豆RIL 群体100 个家系再生情况,筛选出8个再生情况较好家系(见表4)。
由表4可知,HP116诱导率和伸长率均达90%以上,生根率和成苗率达80%以上。HP30 诱导率为91.67%,伸长率为71.67%,生根率为65%,成苗率为56.67%。HP122 诱导率为90.57%,伸长率为84.21%,生根率为75.44%,成苗率为64.91%。HP77 诱导率和伸长率均达80%以上,生根率和成苗率达70%以上。HP115 和HP104 诱导率和伸长率均达80%以上,生根率70%以上,成苗率60%以上。HP4 和HP111 诱导率均达80%以上,伸长率和生根率均达70%以上,成苗率均达50%以上。这8 个家系可为选育高再生率大豆品种提供基础材料。

图4 大豆各时期生长势情况Fig.4 Growth appearance of soybean at different stage
2.2 大豆RIL群体再生性状QTL定位
2.2.1 RIL群体Bin map概况
大豆RIL 群体100个家系使用滑动窗口法作基因分型,并筛选每条染色体bin标记,共得到5 221个重组bin标记(见表5),覆盖20 条染色体,全长6 458.02 cM。
其中6号染色体最长,为577.27 cM;16号染色体最短,为175.82 cM。18 号染色体包含bin 标记最多,为381 个;12 号染色体包含bin 标记最少,为161 个。平均两个bin 间遗传距离为1.24 cM,6号染色体平均遗传距离最大,为1.96 cM;7 号染色体平均遗传距离最小,为0.79 cM。

表4 大豆RIL群体中高再生率大豆家系Table 4 Soybean lines with high regeneration rate in RIL population
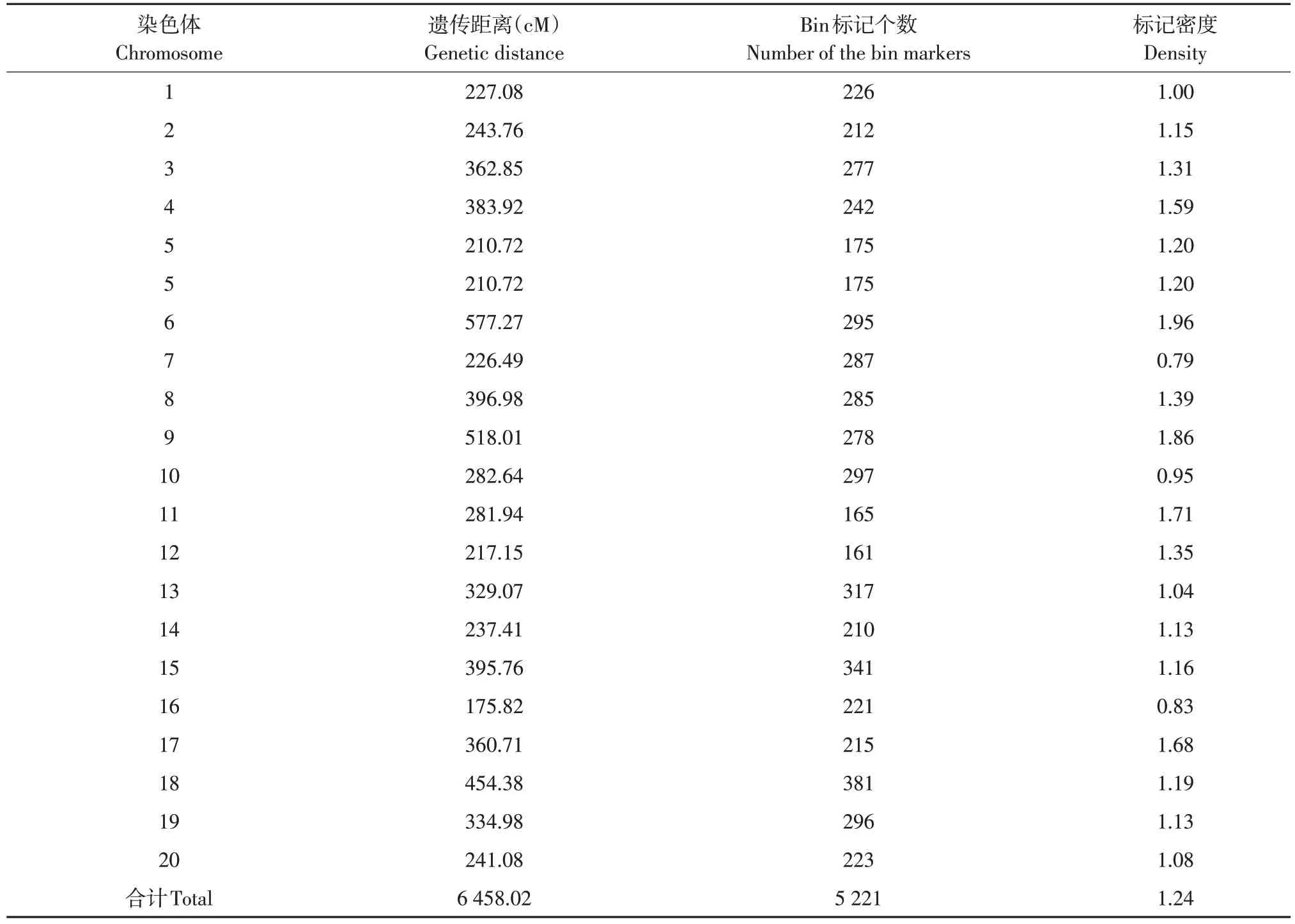
表5 RIL群体bin map概况Table 5 Summary of bin marker characteristic of RIL population
2.2.2 大豆RIL群体4个再生性状QTL定位
通过对大豆RIL 群体4 个再生性状QTL 定位,检测到与诱导率显著相关位点2个,分别位于4号和7 号染色体,贡献率分别为11.11%、13.40%(见表6)。检测到与伸长率显著相关位点3 个,分别位于2号、7号和10号染色体,贡献率为11.99%~13.48%。检测到与生根率显著相关位点3个,分别位于2 号、7 号和10 号染色体,贡献率为12.67%~13.69%。检测到与成苗率显著相关位点2个,分别位于2 号和7 号染色体,贡献率分别为12.01%和13.89%。
2.2.3 QTL定位稳定性和遗传重叠分析
在大豆 RIL 群体4 个再生性状10 个 QTL 位点中,可重复检测到位点(即同时控制两个以上再生性状QTL位点)共3个(见表7)。可知,同时与伸长率、生根率QTL 位点1 个,位于10 号染色体上,左右标记分别为Block5160和Block5159。同时与伸长率、生根率和成苗率QTL 位点2 个,分别位于2 号和7 号染色体上,左右标记分别为Block385 和Block384、Block4036和Block4035。

表6 与大豆再生性状显著相关QTL位点Table 6 QTL loci significantly associated with soybean regeneration indicators
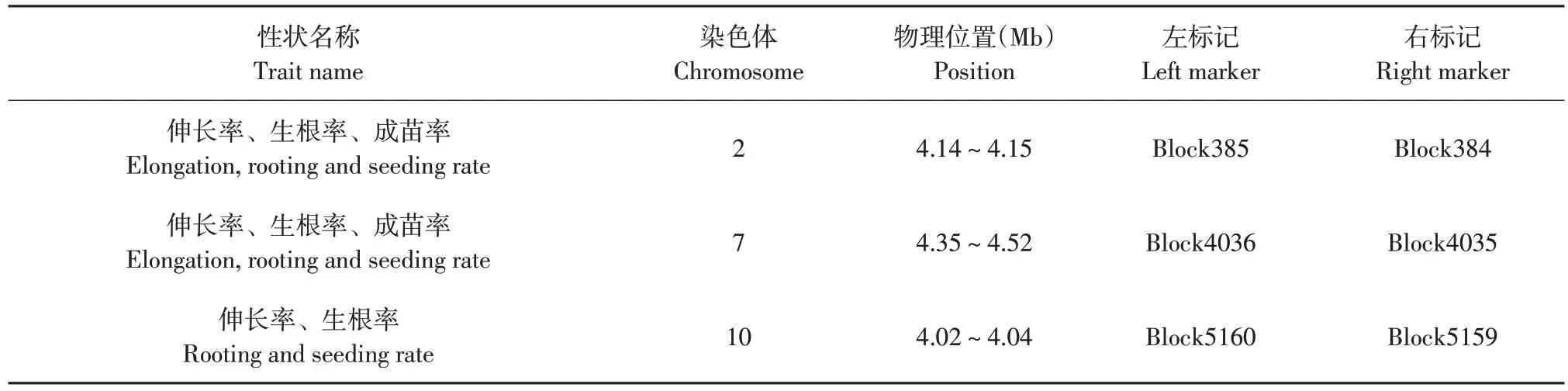
表7 控制不同性状位点重叠分析Table 7 Overlap analysis for controlling different traits loci
3 讨 论
3.1 不同基因型对大豆再生情况影响
大豆转化率较低,仅为0.2%~10.0%,远低于其他双子叶植物如番茄、拟南芥、烟草等。大豆遗传转化对基因型依赖性较强,不同大豆基因型对农杆菌敏感程度有差异,选取敏感度较强品种转化可提高转化效率[17]。曲桂芹等选取8个大豆基因型诱导体细胞胚发生,确定合丰25 和东农7819为优选基因型[18]。杨明明等以垦农18、B12088 和东农47 等3 种不同基因型高油大豆品种子叶节为外植体作遗传转化,发现垦农18 为最佳转化受体[19]。李换丽等选取10 个大豆品种探究基因型对大豆再生体系的影响,结果表明,晋豆37 号与中黄13 号在子叶节再生体系中再生能力比其他品种强,晋豆36号在胚尖再生体系中再生能力较强[20]。
本研究利用合丰25 与L-28 及其衍生RIL 群体为材料,评价大豆再生诱导率、伸长率、生根率和成苗率,筛选得到8个再生能力较强家系,分别是HP116、HP30、HP122、HP77、HP115、HP104、HP4和HP111,这些家系可为选育高再生率品种提供基础材料。
3.2 大豆再生性状QTL位点分析
利用组织培养技术建立再生体系是遗传转化和改良转基因作物性状的基础。近年来,针对大豆遗传转化和再生体系已开展多项技术,但大豆仍是公认的难转化作物之一。因为基因型、农杆菌菌株、培养环境、激素种类及浓度等条件均影响遗传转化效率。因此需研究不同大豆基因型再生能力遗传基础。Bolibok 等利用Nipponbare 和Kasalath 构建回交群体,定位5 个控制愈伤组织出芽率QTL 和4 个控制再生率QTL[21]。杨莉等以日本晴与泸恢99及其构建RIL群体188个家系为研究对象,对同一地点两年再生率及6个产量相关性状基因定位,检测到3 个与再生相关QTL[22]。王萌以172个拟南芥生态型为材料,以根为外植体,对F2代植株初级定位,结果表明,存在3个与性状相关QTL,贡献率分别为21.4%、27.37%和24.22%[23]。
本试验利用合丰25(子叶节再生率较高)和L-28(子叶节再生率较低)杂交衍生RIL群体作QTL定位,发现10 个QTL 与大豆再生性状显著相关,其中独立QTL 位点2 个,可重复检测到QTL 位点3个。与诱导率显著关联QTL位点2个,与伸长率显著关联QTL位点3个,与生根率显著关联QTL 位点3 个,与成苗率显著关联QTL 位点2 个。7 号染色体上存在与大豆4个再生性状相关QTL位点,说明该染色体上可能存在与再生相关基因簇。根据不同性状重叠位点标记区间内查找出的候选基因,后续将选取与再生相关基因作实时荧光定量,采用同源重组法作相关基因克隆。目前关于大豆子叶节再生系统QTL 定位尚未见报道,本研究定位的QTL 位点贡献率均在10%以上,说明这些QTL位点调控的基因可能参与大豆子叶节再生过程,研究结果将有助于建立大豆遗传转化系统。
4 结 论
a.在大豆RIL 群体4 个再生性状中,诱导率与伸长率、生根率和成苗率均呈极显著正相关,伸长率与生根率和成苗率呈极显著正相关,生根率与成苗率呈极显著正相关。
b.大豆RIL群体丛生芽诱导率主要分布在50%~60%,且诱导率50%以上家系占66%,伸长率和生根率主要分布在30%~40%,成苗率主要分布在20%~30%。4个性状均表现为连续单峰曲线,符合正态分布特点。
c.在大豆RIL群体中共检测到10个与大豆再生性状显著相关QTL 位点,其中独立QTL 位点2 个,可重复检测QTL位点3个。与诱导率显著相关QTL位点2个,与伸长率显著相关QTL 位点3个,与生根率显著相关QTL 位点3 个,与成苗率显著相关QTL位点2个。

