外源性表达NIC通过Hes1依赖的机制下调小鼠气道柱状上皮LA-4细胞表达TLR4*
张 瑶,陈丽展,欧阳海峰△
(1空军军医大学西京医院呼吸内科,陕西西安 710032;2西安国际医学中心医院呼吸内科,陕西西安 710100)
Notch 信号通路进化高度保守,在多种生物的发育过程中通过介导细胞间的相互作用而调控细胞分化方向。Notch 信号途径由配体(Jagged1、Jagged2、Dll1、Dll3 和Dll4)、Notch1~4 受体及下游信号转导分子和核内应答过程组成。Notch 受体和配体结合后,在早老素依赖的γ-分泌酶的作用下,释放受体活性胞内段(Notch intracellular domain,NIC),NIC 转入核内与转录因子RBP-J 结合,形成转录激活复合物,进而启动下游Hes和HERP等基因的转录表达,其中,抑制性转录因子Hes1 是Notch 通路在核内的主要效应分子。我们的前期工作证实,Notch 信号通路通过调控免疫细胞的发育分化过程及气道结构细胞的功能在哮喘发病中起到重要作用[1-4]。
多项研究证实,Notch 与TLR4 两条信号通路之间交互调节[5-8]。Notch 和TLR 可协同上调巨噬细胞中Notch配体Jagged1的表达[9]。Notch和TLR可协同上调Notch 下游分子Hes1、Hey 及TLR 下游的细胞因子肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和IL-12 的表达[8]。巨噬细胞中过表达NICD1(有活性的Notch1 受体胞内段)可抑制TLR4 信号通路下游分子TNF-α 和IL-6的表达[10]。因此,Notch 和TLR4 两条信号通路之间的交互作用方式存在多样性。事实上,染色质水平表观遗传机制的差异、胞内转录因子网络水平的差异及炎症细胞因子的差异均可造成Notch 和TLR 信号通路交互作用的多样性。因此,Notch 与TLR4 在气道柱状上皮细胞中的交互调控作用模式有待进一步的研究。
Poltorak 等[11]于1998 年克隆了小鼠TLR4基因。Rehli 等[12]于2000 年克隆了人TLR4基因的启动子序列并对其转录起始位点和基本的转录调控元件进行了初步分析,发现单核细胞特异性转录因子PU.1 和ICSBP可在单核细胞中正性调控TLR4基因的转录和表达。Roger等[13]于2005年证实小鼠TLR4基因转录起始位点上游350 bp 以内存在AP-1、Oct-1 及GATA-1 的结合位点,在巨噬细胞中AP-1 和Oct-1 可上调TLR4基因的转录和表达,而GATA-1 可下调TLR4基因的转录和表达。Ganley-Leal 等[14]证实,人B 细胞和单核细胞中TLR4基因的表达调控机制存在差异。细胞特异性的转录因子网络及表观遗传机制共同决定了TLR4基因表达调控模式的不同。气道上皮细胞中TLR4基因的表达调控模式如何?目前尚无文献报道。
本研究旨在观察外源性表达NIC 能否直接调控小鼠气道柱状上皮细胞表达TLR4,并阐明其具体分子机制。
材料和方法
1 细胞系
小鼠气道柱状上皮LA-4 细胞和大肠杆菌菌株DH5α由空军军医大学生物化学教研室惠赠。
2 主要试剂
pGL3-Basic 质粒和Dual-Luciferase Reporter As⁃say System 购自Promega;QuickChange Kit 购自Strata⁃gene;Lipofectamine 2000 Reagent 购自Invitrogen;SYBR Premix EX Taq 试剂盒购自TaKaRa;Notch1、Hes1、TLR4 和β-actin 抗体均购自Santa Cruz(sc-6014、sc-13844、sc-16240和I-19);Ⅱ抗购自中山生物公司;染色质免疫沉淀(chromatin immunoprecipita⁃tion,ChIP)Assay Kit购自Upstate Biotechnology。
3 主要方法
3.1 pGL3-TLR4 报告基因质粒的构建 以健康雄性C57/B6小鼠的基因组为模板,克隆小鼠TLR4的启动子序列,引物的正义链序列为5'-AGTGCTAGCAT⁃GGTGGAGCCTCTTGAGTTTCTC-3',反义链序列为5'-GGCAAGCTTTGTGCTCATGCATATACACACCTG-3',产物1 582 bp。插入T 载体,测序证实。再转入pGL3-Basic 质粒,构建pGL3-TLR4。以pGL3-TLR4质粒为模板,按QuickChange Kit 说明书构建Hes 蛋白结合位点N-box 的点突变报告基因质粒pGL3-TLR4-N-box1(-561 位)、pGL3-TLR4-N-box2(-289位)、pGL3-TLR4-N-box3(+175 位)和pGL3-TLR4-Nbox4(+295位)。
3.2 双萤光素酶报告基因实验 将LA-4 细胞以每孔2×104个的密度接种于96 孔板,第2 天进行瞬时转染,方法按Lipofectamine 2000 Reagent 试剂说明书进行。将0.1 μg 报告基因质粒、5 ng 内参照(phRL)质粒和梯度剂量(0、0.02、0.04、0.06、0.08 和0.1μg)的pEF-BOS-NIC 质粒转染细胞,pEF-BOS-neo 质粒将每孔的转染总量调整至相同。转染48 h后吸弃每孔培养液,PBS 洗涤1 次,按Dual-Luciferase Reporter Assay System 说明书进行双萤光素酶报告基因实验。
3.3 RT-qPCR 参照Trizol Reagent 说明书提取总RNA,按照RT-PCR 试剂盒程序以总RNA 为模板,oligo-dT 为引物合成cDNA。按SYBR Premix EX Taq试剂盒说明书建立PCR 反应体系,应用ABI PRISM 7300 Real-Time PCR 仪扩增小鼠TLR4 及内参照βactin。计算目的基因表达水平并以2-ΔΔCt表示。TLR4 的上游引物序列为5'-AGGAGAAAGCG⁃GATACCA-3',下游引物序列为5'-TGTGAGGAC⁃TACCGAGCC-3';β-actin 上游引物序列为5'-GCCT⁃CAAGATCATCAGCAAT-3',下游引物序列为5'-AG⁃GTCCACCACTGACACGTT-3'。
3.4 Western blot 实验 收集转染pEF-BOS-NIC 或pEF-BOS-neo 的LA-4 细胞,提取蛋白,分光光度计蛋白定量,用SDS-PAGE 分离,转移至NC 膜,蛋白封闭液封闭后孵育Ⅰ抗、Ⅱ抗,增强化学发光法显色。Notch1、Hes1、TLR4 和β-actin 均购自Snta Cuz(sc-6014、sc-13844、sc-16240、I-19)。Ⅱ抗购自中山生物公司。
3.5 ChIP 超声切割LA-4 细胞的染色质,按ChIP Asay Kt 说明书进行实验。以实验得到的DNA 沉淀为模板,real-time PCR 扩增含有N-box 位点的小鼠TLR4启动子序列片段,引物的正义链序列为5'-AG⁃TACGTTCTCCTTTTAAT-3',反义链序列为5'-GGC⁃TAGAATCGATCTGCCC-3',产物589 bp。β-actin 引物序列同3.3。
4 统计学处理
数据以均数±标准差(mean±SD)表示。用SPSS 20.0统计软件对结果进行t检验和单因素方差分析,评价各处理组间是否存在差异。以P<0.05 为差异有统计学意义。
结果
1 异位过表达NIC可以下调TLR4的表达
为观察Notch 信号能否调控TLR4 的表达,我们利用pEF-BOS-NIC 转染LA-4 细胞而上调Notch 信号后,检测TLR4 的mRNA 和蛋白表达水平。结果显示,与空对照质粒pEF-BOS-neo 组相比,pEF-BOSNIC 可以显著降低TLR4 的mRNA 和蛋白表达水平(P<0.05),见图1。

Figure 1.Ectopic overexpression of NIC down-regulated TLR4 expression.A:TLR4 mRNA expression in LA-4 cells transfected with pEF-BOS-NIC and pEF-BOS-neo was detected by RT-qPCR;B:TLR4 protein expression in LA-4 cells transfected with pEF-BOS-NIC and pEF-BOS-neo was detected by Western blot.Mean±SD. n=5.*P<0.05 vs pEF-BOS-NIC group.图1 异位过表达NIC可以下调TLR4的表达
2 人和小鼠TLR4基因启动子生物信息学分析结果
为明确Notch 信号能否直接调控TLR4启动子活性,我们比对分析了小鼠TLR4启动子(NC_000070.6)和人TLR4启动子(NC_000009.12)的基因组序列。如图2 所示,在小鼠和人TLR4启动子5'端转录起始位点附近的相似位置,存在多个Hes 结合位点N-box(CACNAG)。
3 小鼠TLR4启动子中Hes结合位点的调控作用
为了观察这些假定的转录因子结合位点能否调控转录活性,我们克隆了小鼠TLR4启动子序列,并构建了报告基因质粒pGL3-TLR4。共转染LA-4 细胞后显示,随着NIC 表达质粒pEF-BOS-NIC 剂量的增加,TLR4启动子活性逐渐降低(P<0.05),见图3A。为进一步观察TLR4启动子中这些N-box 位点的功能,我们定点突变了这些位点(图3B)并观察了点突变对TLR4启动子活性的影响。如图3C 所示,-289位N-box 突变导致TLR4启动子活性显著增高,而-561、+175 和+295 位N-box 突变对TLR4启动子活性没有显著影响。利用ChIP 的方法在LA-4 细胞中进一步观察了Hes1是否结合于小鼠TLR4启动子序列,即利用包含N-box(-289)位点的TLR4启动子区域的引物PCR扩增Hes1抗体共沉淀的染色体DNA 片段,结果显示含有Hes1 结合位点的片段可以被Hes1 抗体共沉淀(图3D)。
讨论
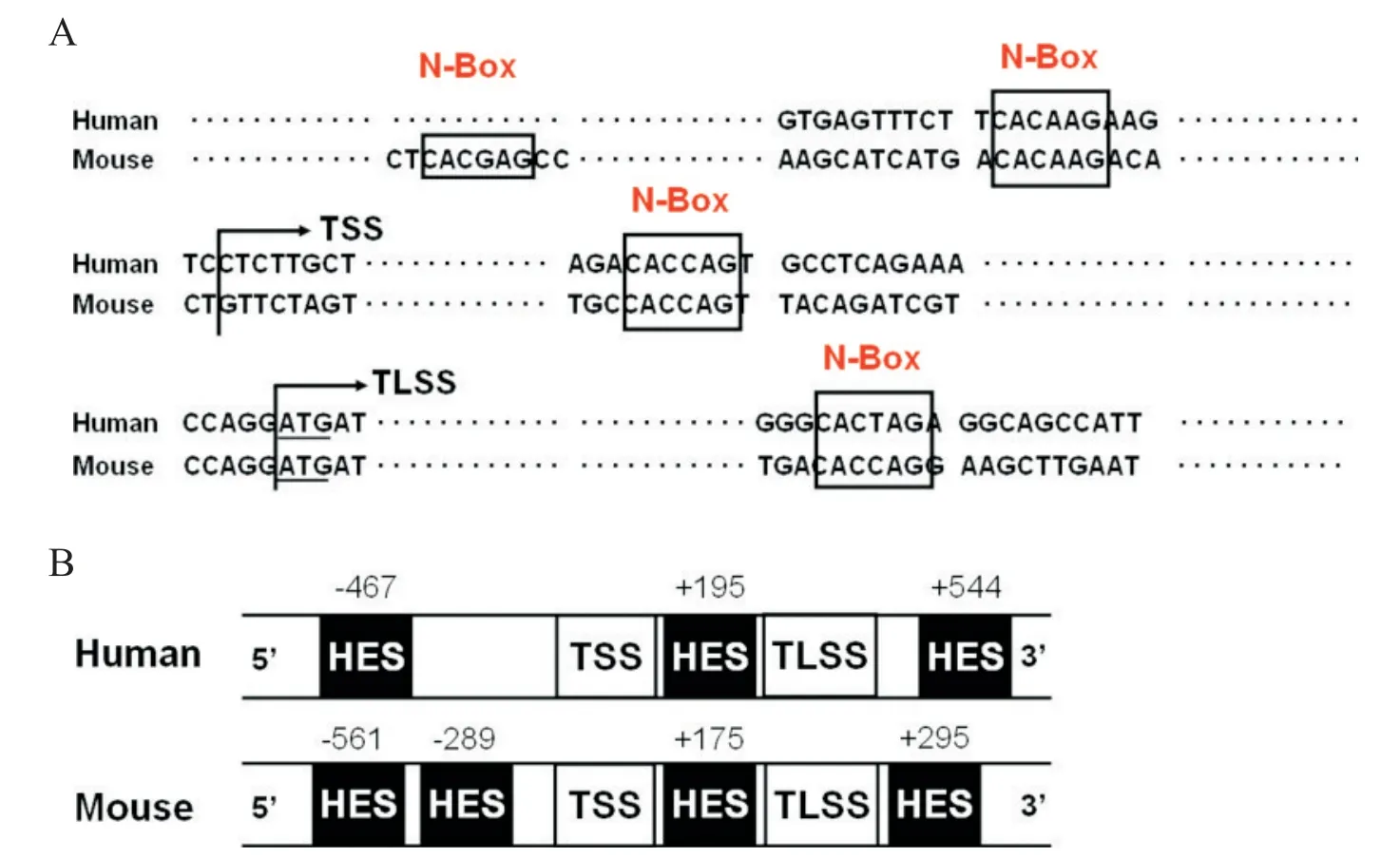
Figure 2.Sequence alignment of human and mouse TLR4 promoters.A:N-boxes in human and mouse TLR4 promoters;B:scheme of the 5′regions of the mouse and human TLR4 promoters,indicating the potential Hes recognition sites.TSS:transcrip⁃tion start site;TLSS:translation start site.图2 人和小鼠TLR4启动子序列比对分析
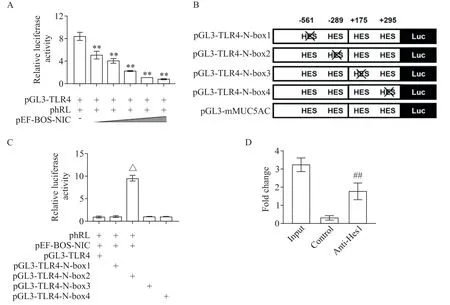
Figure 3.Effects of the Hes-binding sites on mouse TLR4 promoter.A:result of pGL3-TLR4 reporter assay;B:scheme of the site-di⁃rected mutant of mouse TLR4 in which the N-boxes were disrupted;C:result of site mutant reporter assay;D:result of chromatin immunoprecipitation(ChIP).Mean±SD. n=3.**P<0.01 vs pGL3-LR4+phRL group;△P<0.05 vs phRL+pEFBOS-NIC+pGL3-TLR4 group;##P<0.01 vs control group.图3 小鼠TLR4启动子中Hes结合位点的调控作用
在本研究中,显示异位过表达NIC 可以降低小鼠LA-4 细胞中TLR4 的mRNA 和蛋白表达水平。对人和小鼠TLR4基因5'端启动子序列进行生物信息学分析表明,在转录起始位点上、下游的多个相似位置均存在Notch 下游分子Hes 的结合位点N-box,这提示这些基序可能在TLR4 的表达中有调节作用。我们进一步的双萤光素酶报告基因实验证实小鼠LA-4 细胞中过表达NIC 可以下调TLR4启动子活性。点突变报告基因实验揭示Hes 蛋白可能通过作用于-289 位的N-box 位点而抑制小鼠TLR4启动子活性。而ChIP 实验证实Hes1 结合于TLR4基因启动子区域。因此,我们认为Notch 信号可以通过Hes1 依赖的机制调节TLR4的表达。
Notch 信号相关分子条件性敲除小鼠模型的研究表明,Notch 信号在Clara 前体细胞及气道上皮细胞的发育中有重要作用[15-16]。Notch/RBP-J/Hes1 在成年个体中也是细胞分化和功能维持的主要调节因素之一。Notch 信号调控了气道上皮细胞的黏液化生过程[15]。我们的前期研究也证实,Notch 信号通过Hes1 依赖的机制调控气道杯状细胞中MUC5AC 的表达[3]。在本研究中,显示Notch 信号可以通过Hes1依赖的机制直接调控气道柱状上皮细胞中TLR4 的表达。因此,Notch 信号在气道上皮细胞的功能维持中有重要作用。
气道上皮细胞表达TLR 和PAR1-PAR4 等多种模式识别受体[9,17-18]。近年来的一系列研究证实,气道上皮细胞受变应原刺激后可合成、分泌胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)[19]、IL-33[20]和IL-25[21]。上述细胞因子一方面能够募集、活化树突状细胞(dendritic cells,DCs),加重变应原特异性的Th2 免疫应答;另一方面,TSLP、IL-33 和IL-25 可不依赖于DCs 和Th2 细胞因子的存在,直接引起嗜酸性粒细胞性气道炎症和气道高反应性等哮喘表型[19-21]。此外,气道上皮细胞产生的IL-33 和IL-25 可诱导2 型固有淋巴样细胞(group 2 innate lymphoid cells,ILC2)的发育分化过程[22],进而不依赖于CD4+T 细胞通过2 型固有免疫应答的机制直接促成哮喘表型的形成[23]。因此,气道上皮细胞在哮喘发病中有极为重要的作用[21],而且这也与相关临床研究结果一致[24]。
研究报道,草花粉变应原刺激NCI-H292 细胞后,Notch 信号相关的74 个基因中,有38 个基因的表达水平有变化,其中,Notch1 和Hes1 的表达下调最显著,分别下调了2 倍和3.3 倍[25]。我们的研究表明,Hes1的下调可以上调TLR4的表达。而气道上皮细胞表达TLR4在哮喘发病中有重要作用。Hammad等[26]证实气道结构细胞(主要是气道上皮细胞)表达TLR4 是屋尘螨(house dust mite,HDM)抗原诱导小鼠产生哮喘表型的充分必要条件。Tan等[27]证实,气道结构细胞表达TLR4 是低剂量卵清蛋白(ovalbu⁃min,OVA)联合脂多糖诱导小鼠产生哮喘表型的必要条件。McAlees 等[28]利用气道上皮细胞条件性剔出TLR4 的小鼠模型证实,造血细胞表达TLR4 可诱导中性粒细胞性哮喘表型,而气道上皮细胞表达TLR4在HDM 和OVA 诱导的小鼠嗜酸性气道炎症中有重要作用。因此,Notch 信号通过Hes1 调控气道上皮细胞表达TLR4 这一机制可能在哮喘发病中有一定的作用。
Notch 信号通过调控T 细胞的分化在哮喘发病中起到重要作用[29]。但是,只有很少的研究报道了Notch 信号可以通过调控气道结构细胞的功能参与哮喘发病过程。将来需要进一步的研究来观察体内条件下气道上皮中Notch 信号对哮喘表型的调控作用。总之,我们的研究表明,Notch 信号通路可以在小鼠LA-4 细胞中通过Hes1 依赖的机制直接调控TLR4启动子活性;该通路有望成为哮喘防治中的靶点。
- 中国病理生理杂志的其它文章
- miR-23b通过靶基因Cxcl12调控肾性高血压*
- 基于冷冻电子显微术的阳离子通道结构与功能研究进展*
- 淫羊藿苷通过抑制内质网应激减轻异丙肾上腺素诱导的H9c2细胞肥大损伤*
- 机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5-羟色胺代谢异常*
- 肠道ChREBP缺陷导致小鼠对果糖不耐受*
- Spheroid transplantable and functional retinal pigment epithelium derived from non-colony dissociated human induced pluripotent stem cells*

