机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5-羟色胺代谢异常*
何苏月,马卓琳,范昕然,庞瑞萍
(中山大学中山医学院生理学教研室,中山大学疼痛研究中心,广东广州 510080)
肠易激综合征(irritable bowel syndrome,IBS)是一种普遍的胃肠道功能性疾病,主要表现为腹痛、腹胀、排便习惯和(或)大便性状的改变,但无明显的器质性变化。不少患者还有抑郁、焦虑、睡眠障碍等胃肠道外症状[1-3]。长期的慢性疾病对人们的日常生活和工作活动都带来了严重的影响,也加重了医疗负担。IBS的病因及发病机制尚无明确定论,目前的研究表明,精神因素、遗传因素、感染及内分泌因素导致IBS 的发生。对于发病机制,现有的理论研究、临床观察等证实了内脏感觉过敏、胃肠动力异常及脑-肠轴的改变与IBS的发生有着密切的关系[4-7]。
感受机械力对于维持正常的胃肠道功能非常重要,机械感受的功能障碍常常导致胃肠道功能紊乱及病变。机械敏感性离子通道(mechanosensitive ion channels,MSC)是一类能将机械力信号转变为电化学信号的离子通道,广泛分布于各组织器官中,在多种力学转导过程中都具有重要的生理作用,参与生物体内的多种生理过程,包括触觉、痛觉、听觉、剪应力等[8-9],但其分子特性尚未被充分认识。2010 年Coste 等[10]发现Piezo基因家族,包括Piezo1 和Piezo2,编码哺乳动物机械敏感性阳离子通道。目前研究显示,Piezo1在肺、心脏、血管、十二指肠、结肠等部位都有所表达,并且在多种力学转导过程中都具有重要的生理作用,是信号转导中重要的机械敏感性阳离子通道,可将机械刺激转化为电化学信号[11-12]。但是Piezo1在IBS中的作用尚不清楚。
在IBS的发病机制中,胃肠道分泌和动力异常具有重要的作用,而5-羟色胺(5-hydroxytryptamine,5-HT)是肠道动力和感受的关键信号分子,在调控胃肠运动及感知功能中发挥重要作用[13-15]。5-HT 主要来源于肠嗜铬(enterochromaffin,EC)细胞和脑干神经元,因为不能透过血脑屏障,所以体内95%的5-HT由EC细胞分泌的。肠道来源的5-HT大多数被血小板吸收,在特定的刺激作用下释放并参与多种生理活动如血小板聚集、肠道蠕动、肠道炎症等[16]。最近,Sugisawa 等[17]的研究结果显示,粪便中的单链RNA(signle-strand RNA,ssRNA)是Piezo1 的天然配体,肠道上皮组织特异性Piezo1敲除的小鼠肠蠕动减缓,血清中5-HT水平也相应降低,ssRNA-Piezo1轴介导了肠蠕动和肠道5-HT的分泌和合成。
本研究观察了机械敏感性Piezo1 离子通道在慢性避水应激(water avoidance stress,WAS)大鼠结肠组织中表达的情况,并探讨其与大鼠内脏敏感性和结肠组织5-HT 的相关性,为进一步研究机械感受在IBS发病机制中的作用提供实验依据[18]。
材料和方法
1 实验动物
SPF 级雄性Sprague-Dawley(SD)大鼠,6~8 周龄,体质量180~220 g,由中山大学动物实验中心提供,许可证号为SCXK(粤)2016-0029。
2 主要试剂
兔抗大鼠Piezo1(15939-1-AP)购于Proteintech;驴抗小鼠IgG 和驴抗兔IgG 购于Jackson Immuno Re⁃search;DAPI购于Beyotime;大鼠5-HT ELISA试剂盒(CSB-E08364r)购自武汉华美生物工程有限公司;RT-qPCR 试剂盒购自湖南艾科瑞生物工程有限公司;Western blot Ⅰ抗稀释液,以及免疫荧光封闭液、Ⅰ抗稀释液和Ⅱ抗稀释液购自碧云天;伊文斯蓝和甲基纤维素购自北京索莱宝生物科技有限公司;由捷瑞公司设计并合成引物;其余生化试剂均为进口分装或国产。
3 主要方法
3.1 IBS 的大鼠模型制备和实验分组 WAS 装置由一个有机玻璃水箱(45 cm×25 cm×25 cm)和一个固定在中央的有机玻璃台子(10 cm×8 cm×8 cm)组成。水箱里装满了干净水(25℃),距离有机玻璃台子顶部不到1 cm。根据WAS 方案,将动物放置在中间的有机玻璃台子上,每天1 h,连续10 d,具体实验流程见图1A,实验装置见图1B。对照(control,CON)组大鼠每天放在同样的装置(但无水)中1 h,连续10 d[18]。
3.2 胃肠道转运时间的检测 先将大鼠禁食不禁水过夜,然后用含有5%伊文思蓝和1.5%甲基纤维素的溶液灌胃,每只1 mL,然后将大鼠放进代谢笼内,给予正常的饲料和水,观察记录第一个蓝色粪便排出的时间[18-19]。
3.3 粪便含水量和粪便颗粒数的检测 将大鼠放在代谢笼里24 h,给予足够的食物和水。收集粪便,记录粪便颗粒数并称重记为湿重(M0),烘干后再称重记为干重(M1),则粪便含水量(fecal water content)为(M0-M1)/M0[20-21]。
3.4 内脏敏感性的测定和评分 实验开始前将大鼠禁食不禁水过夜,实验开始时先用少量异氟烷麻醉大鼠,把固定在导管一端的气囊经石蜡油润滑后,经大鼠肛门插入一定深度,用胶布把导管和大鼠尾巴根部缠在一起,以固定气囊。将大鼠放在不能转身的透明塑料笼内,待其适应至完全平静后,用血压计法缓慢向气囊内注气以扩张肠道(colorectal dis⁃tention,CRD),血压计注气的方式是按血压计每10 mmHg 上升的速度注入空气,分别观察在20、40、60和80 mmHg 不同压力值下腹壁撤退反射(abdominal withdrawal reflex,AWR),每次扩张持续20 s,每测量一次中间休息3 min,同时给予评分,以得分高低判断内脏敏感性程度。为了获得更准确的评分,每个分级的结直肠扩张重复3 次,并使用AWR 的平均评分进行统计分析[22-23]。
3.5 旷场实验(open-field test)将动物放入箱内底面中心,同时进行摄像和计时。观察一定时间后停止摄像,每次实验结束后清洗方箱内壁及底面,以免上次动物余留的信息(如动物的大便、小便、气味等)影响下次测试结果。更换动物,继续实验。每只动物进行1 次,持续10 min,最后根据旷场自带的软件(Topscan)进行分析[24]。
3.6 强迫游泳实验(forced swimming test)将直径20 cm、高45 cm 的透明游泳桶中注入新鲜水[水温(24±1)℃],水位高度为30 cm,确保大鼠的鼠尾不会接触桶底。依次将每只大鼠置于游泳桶中,每只大鼠测试1 次,观察大鼠6 min 内后4 min 的不动时间,并记录时长,一般来说漂浮不动时间越长绝望指数越高[25]。
3.7 Western blot 实验 各组动物腹腔注射20%乌拉坦(8 mL/kg)麻醉后,于冰上取结肠组织(直肠上1 cm)放入液氮中冷冻,加入SDS 裂解液(10 mL/g)和蛋白酶抑制剂匀浆并超声破碎,再低温离心后取上清液,-80℃保存待用;上清液经SDS-PAGE 分离,再湿转于PVDF 膜上;经5%牛血清白蛋白室温封闭1 h,再于4℃与Ⅰ抗(1∶1 000;Proteintech)轻摇孵育过夜;第2 天取出,室温复温1 h,TBST 洗3 遍,每遍5 min;与辣根过氧化物酶标记的Ⅱ抗(1∶2 000;Pro⁃teintech)孵育1 h 后,TBST 洗3 遍,ECL 显色曝光;使用ImageJ软件对图像进行灰度分析。
3.8 RT-qPCR实验 各组大鼠腹腔注射20%乌拉坦(8 mL/kg)麻醉,取结肠(直肠上1 cm)置于无酶EP管中,每管内加入500 μL Trizol,用事先DEPC处理且高压灭菌过的研磨棒将组织研磨碎;加入100 μL氯仿吹打混匀,静置3 min后于4℃、12 000×g离心15 min;吸出200 μL 上清液转移到新的无酶EP 管中,加入200 μL异丙醇,上下轻摇30次左右,静置10 min后于4℃、12 000×g离心10 min,弃上清;加入1 mL DEPC 水配制的75%乙醇溶液,4℃、7 500×g离心5 min,离心后将液体吸干,倒扣在滤纸上;待残余液体挥发后,加入适量DEPC 水溶解RNA 沉淀,使用超微量分光光度计(NanoDrop 2000)测定RNA 浓度和质量,A260/A280在1.8~2.0 之间的样品方可进行后续步骤。使用Evo M-MLV RT Premix(AG11706)试剂盒和S1000™PCR 仪(Bio-Rad)将RNA 逆转录为cDNA,使用SYBR Green Premix Pro Taq HS(AG11701)试剂盒和CFX96 Touch 实时荧光定量PCR 系统(Bio-Rad)测定Piezo1 的mRNA 表达。Piezo1 和内参照β-actin 的引物序列见表1。采用2-ΔΔCt法计算Piezo1 mRNA 相对表达量。

表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
3.9 免疫组化实验 大鼠麻醉后,心脏抽血将血抽干净后,取结肠组织1 cm,剪开肠壁组织并平铺于光滑的平面上,滴入4%的甲醛固定30 min,再装入事先准备好的加了1 mL 甲醛的EP 管中,后固定12 h后,石蜡包埋,纵切成5 μm 厚的切片。然后进行实验,首先烤片30 min,二甲苯脱蜡15 min×2,100%乙醇(I)15 min,100%乙醇(II)5 min,95%乙醇3 min×2,80%乙醇3 min,70%乙醇3 min,蒸馏水3 min,PBS 洗3 min×3;用EDTA(pH 9)进行抗原修复,微波炉高火15 min,中火15 min,冷却至室温30 min,PBS洗3 min×3;用3.0% H2O2消除内源性过氧化物酶10 min,然后3%~5%牛血清白蛋白室温封闭60 min;按照试剂盒说明加Ⅰ抗,再次PBS 洗10 min×3,用辣根过氧化物酶标记的通用型Ⅱ抗室温孵育60 min,PBS 洗5 min×3;使用Bx51 显微镜(Olympus)观察并拍照,用ImageJ对图片中的A值进行半定量分析[26]。
3.10 ELISA实验 将各种试剂移至室温(18~25℃)平衡至少30 min,在此期间配制好洗涤工作液,将酶标板取出,设一个空白对照孔(不加任何液体),每个标准点依次各设两孔,每孔加入标准品50 μL,其余每孔直接加待测样品50 μL。然后每孔加入同样体积的酶结合物(空白对照孔除外),再按同样的顺序加入同体积的抗体,混匀,贴上不干胶封片,置于37℃温育1 h。手工洗版,弃去孔内液体,每孔加入洗涤缓冲液200 μL,静置10 s 甩干,重复3 次。每孔加入显色剂A 液50 μL,显色剂B 液50 μL,振荡混匀后,37℃避光显色15 min,每孔加入同体积的终止液。最后用酶标仪在450 nm波长依序测量各孔的吸光度(A)。在反应终止10 min内进行检测。
3.11 HE 染色 先将组织放入烘箱30 min,然后放入二甲苯(I)中15 min,放入二甲苯(II)中15 min,100%乙醇(I)中15 min,100%乙醇(II)中5 min,95%乙醇5 min,90%乙醇5 min,80%乙醇5 min,70%乙醇5 min,蒸馏水3 min,苏木素染色5~15 min,流水冲洗2 min,盐酸酒精分化10 s,放入流水中50 min,放入蒸馏水3 min,伊红溶液染10 s,90%乙醇2 min,95%乙醇2 min,100%乙醇(I)中3 min,100%乙醇(II)中3 min,二甲苯(I)中5 min,二甲苯(II)中5 min,中性树脂封片,放入烘箱60 min后镜下观察。
4 统计学处理
通过SPSS 21.0 软件进行统计学分析。实验结果以均数±标准差(mean±SD)表示。AWR 数据组间比较用两因素方差分析(two-way ANOVA);Piezo1 表达水平与内脏敏感阈值和AWR 评分的关系采用采用两连续型随机变量间的Spearman 秩相关;Piezo1表达水平与5-HT 水平的关系采用两连续型随机变量间的Pearson 相关;其它数据组间比较用独立样本t检验;若数据不符合方差齐性,则采用Wilcoxon 秩和检验。以P<0.05为差异有统计学意义。
结果
1 慢性WAS 大鼠出现IBS 样肠道症状及内脏高敏感性
如图1A、B 所示,将大鼠每天1 h、连续10 d 进行WAS,至实验终点前每天监测动物体重,于造模完成后第1 天检测24 h 粪便颗粒数及含水量。结果显示,两组大鼠体重变化无显著差异(P>0.05),见图1C;与对照组相比,WAS 组大鼠24 h 粪便颗粒数及粪便含水量均显著增加(P<0.05),见图1D、E。
为了检测大鼠内脏敏感性的变化,我们进行了AWR 实验。如图2A 所示,随着结直肠扩张压力的逐渐增加(20、40、60和80 mmHg),对照组AWR 评分分别为0.75±0.25、2.00±0.67、3.25±0.92 分和4.00±0(n=6),而WAS 组分别为1.14±0.48、3.29±0.24、4.00±0和4.00±0(n=6),表明WAS组大鼠内脏敏感性显著增加(P<0.05)。以AWR 评分3 为疼痛阈值,显示对照组引起疼痛的压力阈值为(60.0±14.1)mmHg,而WAS 组为(43.3±7.5)mmHg,表明WAS 组大鼠出现显著的内脏高敏状态(P<0.05),见图2B。另外,肠道动力学实验结果表明,对照组大鼠胃肠道转运时间为(258.7±41.6)min,而WAS 组大鼠为(207.2±67.3)min,较对照组显著缩短(P<0.05),见图2C。
2 慢性WAS大鼠出现神经系统的变化
为了检测WAS 后动物是否出现神经精神相关症状,我们将两组大鼠分别进行旷场实验和强迫游泳实验。旷场实验结果表明,对照组和WAS 组大鼠进入中心位置的次数分别为29.0±15.0 和9.0±6.9,总的活动路程分别为(9.7±4.0)m 和(6.6±1.8)m,与对照组相比,WAS 组大鼠进入中心区域的次数及总的活动路程均显著减少(P<0.01),见图3A、B。强迫游泳实验结果表明,对照组和WAS 组大鼠漂浮时间分别为(135.0±52.1)s 和(210.4±32.9)s,与对照组相比,WAS 组大鼠漂浮不动时间显著延长(P<0.05),见图3C。这些行为学数据表明,与对照组相比,WAS 组大鼠出现了焦虑抑郁样症状。进一步的组织学检测结果表明,对照组和WAS 组大鼠结肠组织黏膜结构完整,固有层内有稠密的大肠腺,细胞形态正常,黏膜下可见少量淋巴细胞、中性粒细胞及巨噬细胞等,肌层完整,与对照组相比,WAS 组没有出现明显的结肠病理学改变,见图3D。
3 WAS对结肠黏膜和血清5-HT含量的影响

Figure 1.Foundation and intestinal symptoms of irritable bowel syndrome rat model induced by water avoidance stress(WAS).A:experiment design was shown;B:device of WAS;C:the change of weight;D and E:the fecal water content and the num⁃ber of fecal particles in control(CON)and WAS rats.Mean±SD. n=6.*P<0.05,**P<0.01 vs CON group.图1 避水应激肠易激大鼠模型的建立及肠道症状

Figure 2.Visceral hypersensitivity and whole gut transit time in water avoidance stress(WAS)-induced irritable bowel syndrome rat model.A:abdominal withdrawal reflex(AWR)scores measured in response to graded colorectal distension were signifi⁃cantly enhanced in WAS group compared with control(CON)group;B:the threshold of colorectal distention was obviously decreased in WAS group;C:the whole gut transit time was decreased in WAS rats.Mean±SD. n=6. *P<0.05,**P<0.01 vs CON group.图2 避水应激肠易激大鼠模型的内脏高敏感性及胃肠道转运时间
为了检测WAS是否影响大鼠5-HT的水平,我们检测了两组大鼠血清和结肠组织5-HT 含量。如图4所示,ELISA 结果显示,对照组和WAS 组血清中5-HT 含量分别为(8.00±2.1)μg/L 和(5.8±1.7)μg/L,结肠组织中5-HT 的含量分别为(3.1±0.5)μg/L 和(4.1±1.5)μg/L,与对照组相比,WAS 组大鼠结肠组织中5-HT 含量显著增加(P<0.05),而血清中5-HT含量呈下降趋势,但差异无统计学意义(P>0.05)。
4 WAS大鼠结肠黏膜Piezo1的表达情况
为了检测WAS 对大鼠结肠黏膜5-HT 含量的影响是否与Piezo1 表达有关,我们取对照组和WAS 大鼠结肠组织,分别进行RT-qPCR、Western blot及免疫组化实验来检测结肠组织Piezo1 表达情况。结果显示,与对照组相比,WAS 组大鼠结肠组织Piezo1 的mRNA 表达水平显著增加(P<0.01),蛋白表达水平也显著增加(P<0.01);免疫组化结果显示,Piezo1 主要分布在肠上皮中,与对照组相比,WAS组免疫活性显著增加(P<0.05),见图5。
5 结肠组织Piezo1 的表达水平与内脏高敏感性及5-HT含量的相关性
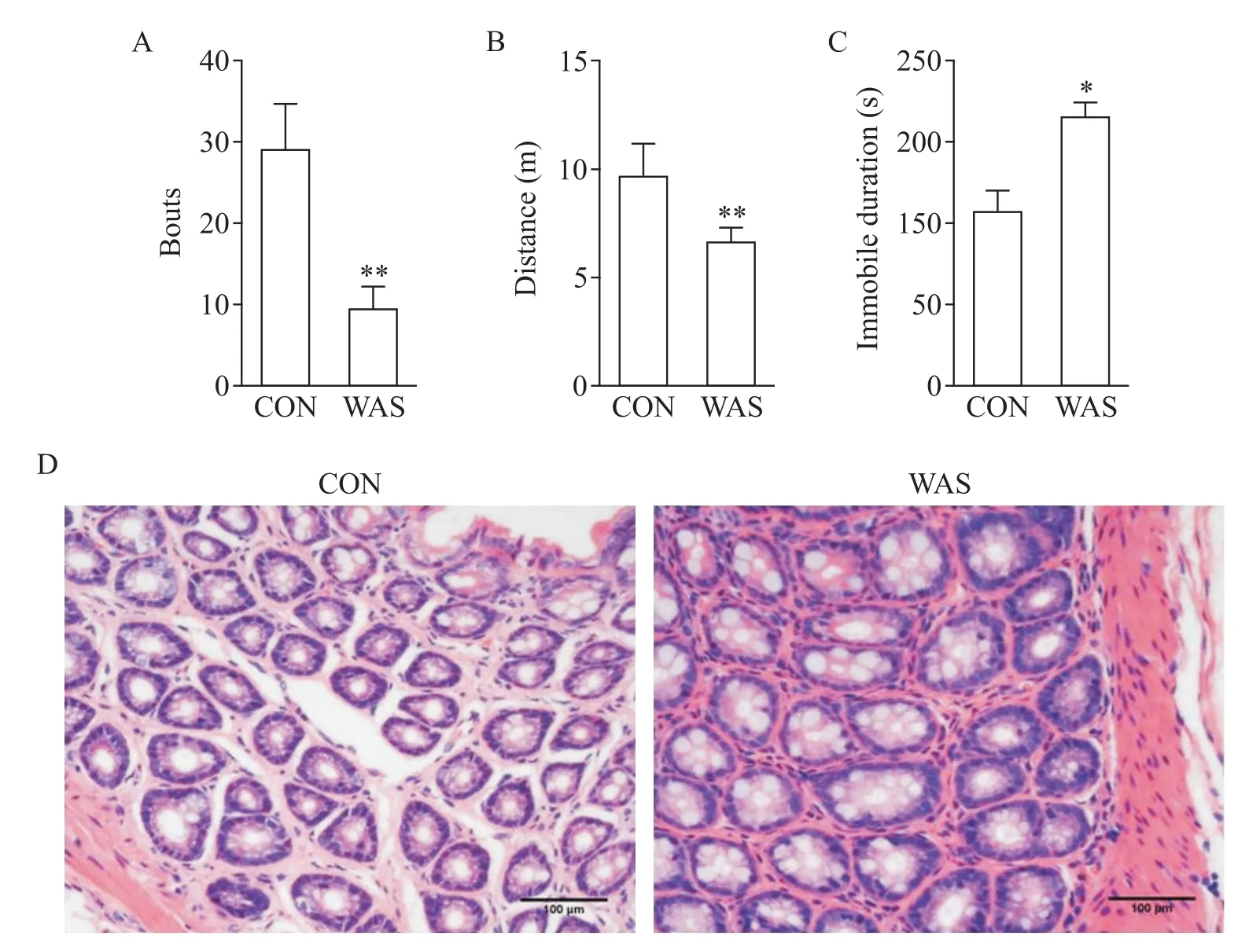
Figure 3.Nervous system symptoms and colon histological changes of irritable bowel syndrome rat model induced by water avoidance stress(WAS).A and B:the number of entering the center and the total distance in open-field test were significantly de⁃creased in WAS group compared with control(CON)group;C:the immobile duration in forced swimming test was pro⁃longed obviously in WAS group;D:representative images of the colon in CON and WAS rats with HE staining(scale bar=100 μm).Mean±SD. n=6.*P<0.05,**P<0.01 vs CON group.图3 避水应激肠易激大鼠模型的神经系统症状及组织学变化

Figure 4.The content of 5-HT in colon tissue(A)and serum(B)of irritable bowel syndrome rat model induced by water avoidance stress(WAS).Mean±SD. n=6.*P<0.05 vs control(CON)group.图4 避水应激肠易激大鼠模型结肠组织及血清中5-HT 含量的变化
为了检测慢性WAS 大鼠的内脏敏感性是否可以由结肠Piezo1 表达水平来衡量,我们分析了Piezo1 mRNA表达水平与内脏敏感阈值和AWR评分的相关性。如图6A、B 所示,Piezo1 mRNA 表达水平与结直肠扩张敏感阈值无显著相关性(R2=0.231 7,P=0.310 6),而与AWR 评分呈显著正相关(R2=0.542 0,P=0.037 3)。我们还检测了结肠Piezo1 表达水平与5-HT 含量的相关性,结果显示结肠Piezo1 mRNA 表达水平与5-HT 含量也呈显著正相关(R2=0.835 1,P=0.010 8),见图6C。
讨论
IBS 的发病机制中胃肠道功能紊乱和心理因素起主导作用[27]。EC 细胞作为机械敏感性细胞可以感受胃肠蠕动产生的机械力,并将机械刺激转换为细胞内的生物化学信号从而引起5-HT 和ATP 释放,因此在胃肠动力、分泌及内脏感受方面具有重要的生理功能。但EC 细胞作为机械感受器的分子机制尚未明了。我们的结果揭示在慢性WAS 诱导的IBS模型大鼠,结肠组织5-HT 含量增高的同时,机械敏感性离子通道Piezo1 的mRNA 及蛋白表达水平升高,并且与内脏敏感性显著正相关。这些结果提示在慢性WAS 诱导的IBS 大鼠结肠组织中机械敏感性离子通道Piezo1 被激活,引起结肠组织5-HT 分泌和释放增加,导致肠道功能紊乱和内脏敏感性增高,以及神经精神症状的出现。
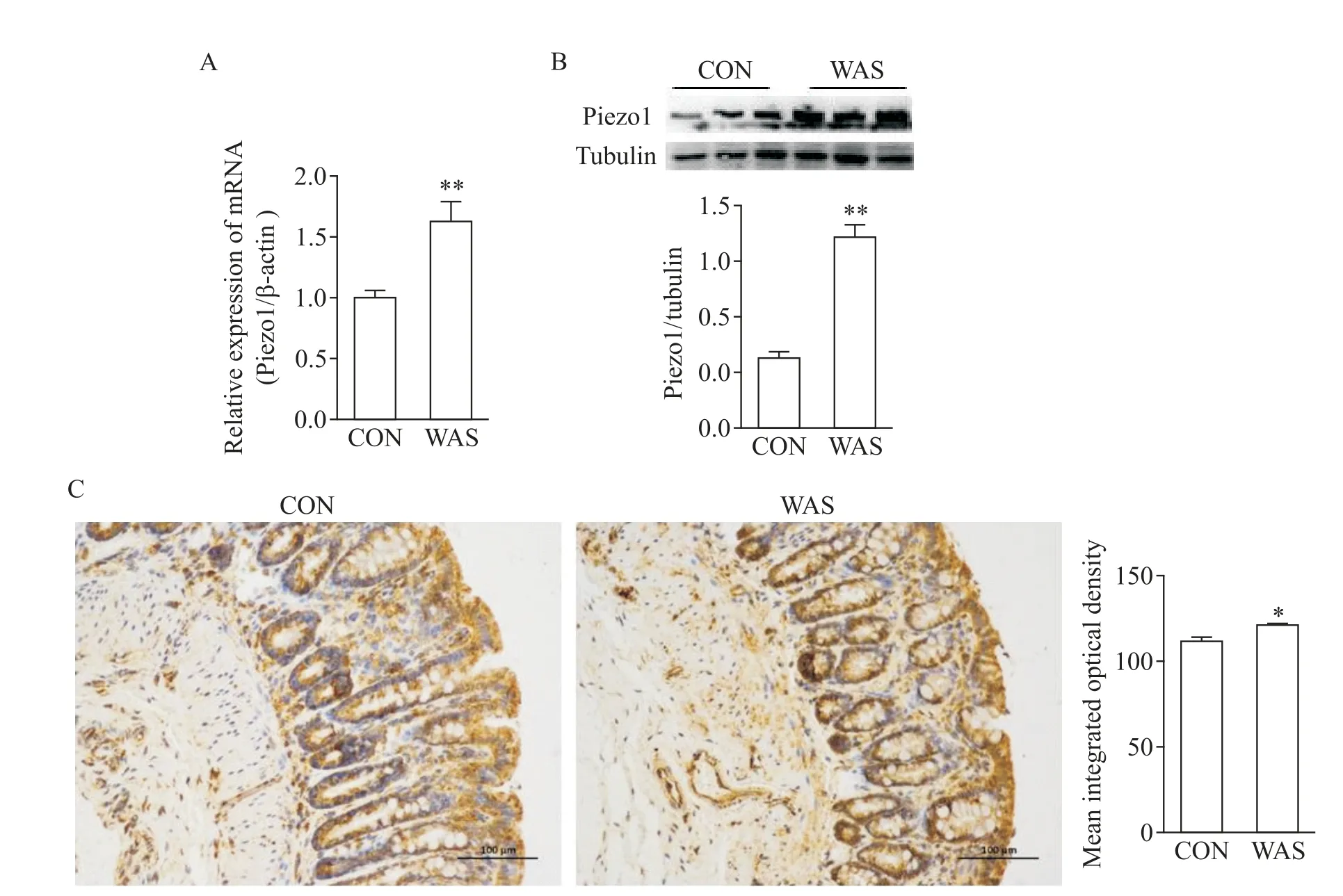
Figure 5.Expression of Piezo1 in irritable bowel syndrome rat model induced by water avoidance stress(WAS).A and B:the mRNA and protein expression levels of Piezo1 in the colon tissues were determined by RT-qPCR and Western blot;C:representa⁃tive immunohistochemistry images(scale bar=100 μm)and integrated absorbance of Piezo1 in the colon tissues of control(CON)and WAS rats.Mean±SD. n=6.*P<0.05,**P<0.01 vs CON group.图5 避水应激肠易激大鼠模型结肠组织中Piezo1的表达情况

Figure 6.Correlations between Piezo1 mRNA expression and visceral hypersensitivity or 5-HT content in the colon.A:there was no obvious correlation between the mRNA expression of Piezo1 and the threshold of colorectal distension;B:correlation be⁃tween the AWR scores and the mRNA expression of Piezo1 in the colon;C:correlation between the 5-HT content and the mRNA expression of Piezo1 in the colon.图6 结肠组织Piezo1的mRNA表达水平与内脏高敏感性及5-HT含量的相关性
Piezo 家族离子通道是机械敏感性离子通道,在整个胃肠道都有表达,并具有特定的生物学特性,如非选择性阳离子通透性,快速激活但慢速至中等速度失活(Piezo1),快速激活快速失活(Piezo2),可以被机械敏感性离子通道阻断剂钆离子(Gd3+)、钌红(ru⁃thenium red)及GsMTx-4特异性阻断[28]。胃肠道上皮细胞作为与外环境相互作用的第一道屏障,都是机械敏感性的,既可以感受静水压也可以感受急性力。感受静水压对于维持细胞密度的稳态非常重要。有研究表明Piezo1 在上皮肿瘤抑制机制中具有重要作用[29]。感受急性力在消化和动力过程中必不可少。在胃肠道上皮中,急性力是EC细胞所感受的[30]。EC细胞在机械和化学刺激作用下合成、贮存及释放大量的5-HT;5-HT 反过来对于正常胃肠道分泌、动力和感受非常重要[30]。Alcaino 等[31-32]的研究表明,机械敏感性EC 细胞需要Piezo2 来将机械力转变为5-HT 的释放。Bai 等[33]的研究表明,旋毛虫(Trichinel⁃la spiralis)感染后诱导的IBS 中,小鼠结肠Piezo2 表达水平与内脏敏感性相关。多项研究结果表明,机械刺激激活EC 细胞的机械感受器,诱导ATP 或UTP释放,通过自分泌或旁分泌方式来调节5-HT 释放[34]。但有很多问题尚未明了,如Piezo2 具有快速激活快速失活的特性,在机械刺激时,Piezo2 在大约10 ms内开放和失活,这个时间远远短于其后的5-HT释放[35]。这提示在机械感受过程中存在信号的放大作用,和(或)需要多个机械感受器共同参与机械转导过程。而除了Piezo2 外,机械敏感性离子通道Piezo1 也被证明对于胃肠道上皮感受静水压非常重要[36]。在软骨细胞,Piezo1与Piezo2共同参与机械感受性反应[37]。虽然我们尚不明确Piezo1 是否表达在EC 细胞,但Sugisawa 等[17]的研究表明肠道上皮细胞特异性敲除Piezo1会导致肠道和血清5-HT 含量减少,这表明Piezo1参与5-HT的合成和释放过程。
5-HT 具有多种重要的生理功能,包括激活肠神经分泌和运动反射、传递饱腹及疼痛信号、诱导呕吐等,并且在炎症的过程中也具有重要作用。在抑郁症等情感障碍病人的血清及脑脊液中均有不同程度的5-HT 代谢紊乱。5-HT 无论在胃肠道内还是肠道外都具有重要作用,因此完全消除其合成并非良策;选择性减少5-HT 释放和生物利用度从而改善胃肠功能紊乱、限制炎症等,将是一个比较好的策略。靶向调节5-HT 释放和EC 细胞水平的信号将成为胃肠功能紊乱及炎症性肠病的潜在治疗策略。目前5-HT3受体已经成为治疗恶心、呕吐、IBS和抑郁症的靶点[38]。临床试验显示5-HT 拮抗剂治疗腹泻型IBS 具有较好的效果[39-40]。
我们的动物实验结果虽然初步提示机械敏感性离子通道Piezo1 参与慢性WAS 诱导的IBS 大鼠的内脏高敏感性和肠道5-HT 代谢紊乱,但尚需更多严谨的在体动物实验和离体细胞实验来验证Piezo1 在IBS发病机制中的作用,并且动物试验的结果不能简单推广到人体,尚需与临床试验资料紧密结合、谨慎分析。由于胃肠道内分泌细胞散在分布在整个胃肠道,并且胃肠道细胞原代培养技术及肠道免疫荧光染色技术的限制,对于胃肠道上皮细胞的进一步研究受到极大制约。采用基因工程技术如CRISPR(clustered regularly interspaced short palindromic re⁃peats)或组织特异性基因敲除动物来研究Piezo 通道在胃肠道功能紊乱及相关疾病中的作用及机制将是下一步比较适合的方法和策略。

