miR-23b通过靶基因Cxcl12调控肾性高血压*
李 响,于闪闪,胡艳玲,王天贺,李洪志,赵冰海,邱德来,王会岩
(1延边大学医学院生理学与病理生理学教研室,吉林延吉 133002;2吉林医药学院,吉林吉林 132013;3北华大学基础医学院,吉林吉林 132013)
肾性高血压是一种常见的继发性高血压,肾脏实质性病变和肾动脉病变是引起肾性高血压的主要原因。肾性高血压占成年人高血压的5%,占未成年人高血压的60%,肾功能不全的患者发生高血压占58%~86%[1]。肾脏病变导致高血压的发生,而高血压的发生又对肾脏再次损害,二者相互促进使疾病不断发生发展,这种恶性循环对高血压的治疗造成了极大的困难[2]。综上所述,肾性高血压严重地威胁人类的身体健康,因此,如何快速有效的提高肾脏功能、降低血压是防治肾性高血压的关键。
微小RNA(microRNA,miRNA,miR)是一类长度约为21~23 个核苷酸的非编码的调控小RNA,它们通过与mRNA 结合,在转录后水平调控靶基因表达[3]。大量研究表明,一个miRNA 可与多个靶基因结合,而同一个靶基因又可受多个miRNA 调控,这些靶基因都可以发挥转录因子、转录蛋白、分泌因子及受体等生物学功能[4]。miRNA 在生物进化过程中高度保守,在细胞增殖、细胞凋亡、细胞分化、脂类代谢、激素分泌及在肿瘤等多种疾病的发生发展中扮演着重要角色[5]。近年来越来越多的研究发现,miRNA 参与冠状动脉粥样硬化心脏病、高血压、心肌肥厚和心律失常等心脏疾病的发生、发展机制[6],在心血管系统疾病及微血管病变中具有重要作用[7]。miRNA 主要功能为降解、稳定、促进靶基因表达,我们在近几年对miRNA 生物功能研究中发现,给予野生型小鼠特异性miR-23b 抑制剂可导致肾脏纤维化[8],但这种肾脏纤维化来源于何种类型的肾脏疾病并不清楚,因为肾脏纤维化是大多数肾脏疾病的终末病理变现,为了更加深入定位miR-23b 在肾脏疾病中的功能,我们利用CRISPRCas9 技术在小鼠体内敲除miR-23b进而研究其作用。本研究通过基因敲除小鼠和临床肾脏病理活检样本,讨论miR-23b 在肾性高血压中的调控作用,为研究肾性高血压的发生机制与临床诊断提供研究基础。
材料和方法
1 临床样本采集
本研究所有临床样本收集于吉林市中心医院及北华大学附属医院,包括肾病综合征患者肾活检,健康人群肾活检。临床样本在低温条件下30 min 之内送到实验室且-80℃保存。
2 实验动物和分组
选取8 周龄雄性C57BL/6(野生型,wild-type,WT)小鼠购自上海斯莱克实验动物有限公司,许可证号为SCXK(京)2016-0006;miR-23b基因敲除(miR-23bgene knockout,miR-23b KO)小鼠由北华大学基础医学院赵冰海教授馈赠。小鼠体重均在24~26 g,在IVC 级动物房饲养,光照与黑暗12 h 自动转换,温度24~25℃,湿度55%,饮食摄水自由,所用饲料和垫料均购自北京科奥协力饲料有限公司。实验分为WT 小鼠和miR-23b KO 小鼠共2 组,每组6 只。尿液样品用小鼠代谢笼收集24 h尿液。小鼠血清样本采用眼球取血至抗凝管,4 000 r/min 离心10 min,取上清低温保存。小鼠断颈处死,获取肾脏,取1/2皮质部分保存4%多聚甲醛溶液用于石蜡包埋,剩余的肾脏组织冰冻液氮保存。
3 方法
3.1 肾脏组织切片和形态学观察
3.1.1 HE 染色 将切片置于62℃烘箱中2 h,二甲苯脱蜡10 min,100%乙醇5 min,90%乙醇5 min,80%乙醇5 min,75%乙醇5 min,蒸馏水5 min,60℃预热的苏木素2 min,流水冲洗20 s,促蓝返蓝(0.5%盐酸乙醇)40 s,流水冲洗20 s,1%伊红溶液1 min,流水冲洗20 s,乙醇梯度脱水,二甲苯透化2 min,中性树胶封片,镜下观察拍照。
3.1.2 高碘酸-希夫(periodic acid-Schiff,PAS)染色 按照PAS Stain Kit(Abcam)说明书操作。
3.1.3 免疫组化染色 将切片置于62℃烘箱中2 h,二甲苯脱蜡10 min,100%乙醇5 min,90%乙醇5 min,80%乙醇5 min,75%乙醇5 min,蒸馏水5 min,0.25%TritonX-100(Sigma)透化10 min,2%牛血清白蛋白37℃封闭1 h,Ⅰ抗4℃过夜,PBS 洗3 遍,每次5 min,Ⅱ抗37℃孵育1 h,PBS 洗5 min×3 遍,DAB 显色10 min,PBS 洗3 遍,乙醇梯度脱水,二甲苯透化2 min,中性树胶封片,镜下观察拍照。
3.2 ELISA 实验 以肾素(renin)为例,取6 μL 血清与50 μL coating buffer(Abcam)混匀,4℃包被过夜,PBST 洗3 遍,2%牛血清白蛋白37℃封闭1 h,Ⅰ抗37℃孵育1 h,PBST 洗4 遍,Ⅱ抗37℃孵育30 min,PBST洗4遍,ECL显色,酶标仪化学发光检测。
3.3 RT-qPCR 检测RNA 表达 用Trizol RNA 提取试剂盒(Invitrogen)提取小鼠肾脏RNA,NanoDrop 测浓度。以提取的RNA 作为模板,用Transcriptor First Strand cDNA Synthesis Kit(Roche)对RNA 进行逆转录,PCR 体系为1 μg RNA;Anchored-Oligo(DT)18 Primer 1 μL;Random Hexamer Primer 2 μL;PCRgrade Water 至13 μL。反应条件为:60℃10 min,立即冰上静止10 min。5×buffer 5 μL;protector RNase inhibitor 0.5 μL;Deoxynucleotide Mix 2 μL;Tran⁃scriptor Reverse Transcriptase 0.5 μL;总体积20 μL。反应条件为:25℃10 min、50℃60 min,将RNA 逆转录为cDNA。使用Primer Premier 5.0 软件设计基因对应的引物,qPCR 反应体系为2×SYBR Green Mas⁃ter Mix 10 μL、Forward primer 0.8 μL、Reverse primer 0.8 μL、cDNA template 2 μL、RNase-free H2O 至20 μL。反应条件为:预变性95℃5 min;变性90℃30 s,退火60℃30 s,延伸72℃30 s,45 个循环,再延伸72℃5 min。鼠源内参照GAPDH 的正向引物序列为5'-ATGACATCAAGAAGGTGGTGAAG-3',反向引物序列为5'-TCCTTGGAGGCCATGTAGG-3';鼠源Cx⁃cl12基因正向引物序列为5'-TGCATCAGTGACGG⁃TAAACCA-3',反向引物序列5'-CACAGTTTGGAGT⁃GTTGAGGAT-3'。人源内参照GAPDH 的正向引物序列为5'-AGAAGGCTGGGGCTCATTTG-3',反向引物序列为5'-AGGGGCCATCCACAGTCTTC-3';人源Cxcl12基因的正向引物序列为5'-ATTCTCAA⁃CACTCCAAACTGTGC-3',反向引物序列为5'-ACTT⁃TAGCTTCGGGTCAATGC-3'。
3.4 双萤光素酶报告基因实验 根据NCBI 数据库中Cxcl12的序列信息,设计扩增引物,正向引物为5'-ATTCTAGTTGTTTAAACGAGCTCCATGCTTCATCT⁃GACTTCCGCTTCT-3',反向引物为5'-GCTTGCAT⁃GCCTGCAGGTCGACTCTAGAATCCCCACTGTG⁃GCTTCATGGCAAG-3',PCR 扩增,琼脂糖凝胶电泳鉴定并纯化,经酶切将基因Cxcl12序列连接到pmir⁃GLO Dual-Luciferase miRNA Target Expression Vector(Promega)上,测序提质粒,实验分为GLO 对照组、GLO-Cxcl12+miR-23b(+)组、GLO-Cxcl12+miR-23b(-)组和GLO-Cxcl12+miRNEG 组,转染到293T 细胞中,转染48 h 后,按照Dual-Glo®Luciferase Assay Sys⁃tem(E2920)说明操作进行萤光素酶活性测定。
3.5 肾脏样本的RNA 测序(RNA sequencing,RNASeq)建库与生物信息学分析 本实验通过Illumina的NEBNext RNA 文库制备试剂盒说明书制备测序文库(New England Biolabs)。RNA-Seq 数据可在NCBI GEO网站的登录查询,登录号为PRJNA524723。
4 统计学处理
本研究所得实验数据运用SPSS 21.0 软件进行分析。实验数据以均数±标准差(mean±SD)表示。两组间比较采用独立样本t检验;多组比较采用单因素方差分析(one-wayANOVA),两组间比较采用Bon⁃ferroni检验。以P<0.05为差异有统计学意义。
结果
1 从临床样本角度检测miR-23b 表达与肾病综合征的关系
用RT-qPCR 方法,对收集的临床肾病综合征患者和健康人的肾活检样本进行miR-23b 表达量的检测,与健康人群组(739.74±335.20,n=6)相比较,肾病综合征患者组miR-23b 在肾脏活检样本中的表达量(50.71±47.56,n=6)显著降低(P<0.01)。对肾病综合征患者的血清肌酐(serum creatinine)、尿酸(uric acid,UA)及24 h 尿蛋白(urine protein)与miR-23b 表达量进行相关分析发现,前3 个指标都与miR-23b的表达呈负相关(P<0.05),见图1A。
2 实验动物各组织器官miR-23b表达量检测
为了确保实验动物基因敲除成功,对miR-23b KO 小鼠进行基因型鉴定,正向引物为5'-TG⁃GTCCCTAAGGTATTGGTCTCAT-3',反向引物为5'-TTGTTTCCAAAGAGCCACAAGG-3',PCR 产物的电泳结果见图2。用Bulge-LoopTMmiRNA RT-qPCR Starter Kit(广州锐博生物技术有限公司)来检测miR-23b KO 小鼠和WT 小鼠的各组织器官miR-23b 表达水平,结果显示,与WT 组相比,miR-23b KO 小鼠各组织器官miR-23b 表达均显著降低(P<0.05 或P<0.01),见表1。
3 miR-23b基因敲除小鼠肾脏结构及功能改变
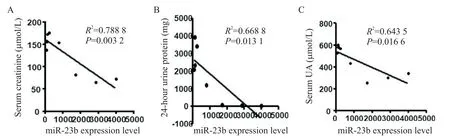
Figure 1.Relationship between miR-3b expression and renal function.A:the correlation between miR-23b expression level and se⁃rum creatinine level;B:the correlation between the expression of miR-23b and 24-hour urine protein;C:the correlation between the expression level of miR-23b and serum uric acid(UA).图1 miR-23b表达水平与反映肾脏功能指标的关系
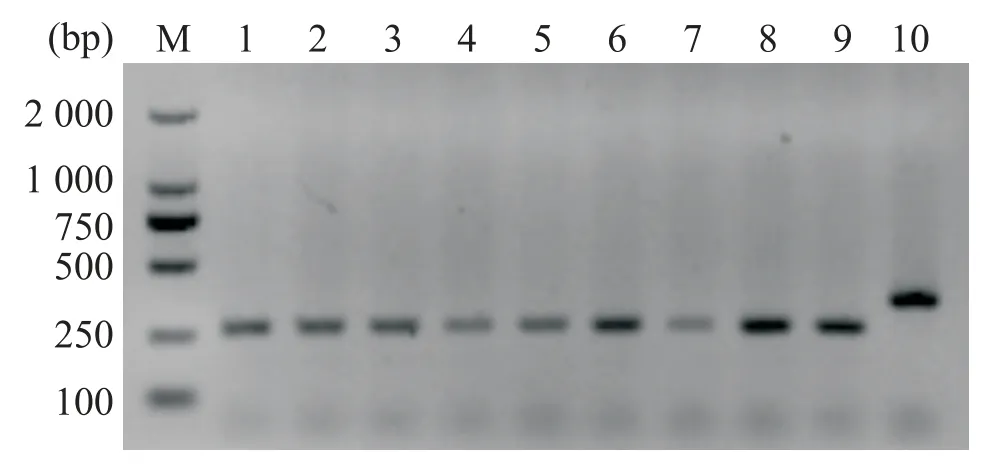
Figure 2.Genetyping of miR-23b mice.M:Marker DL2000;Lane 1―9:miR-23b KO mice(target fragment 267 bp);Lane 10:WT mice(target fragment 359 bp).图2 miR-23b KO小鼠基因型的鉴定

表1 miR-23b KO小鼠中miR-23b的表达Table 1.The expression of miR-23b in miR-23b KO mice(Mean±SD. n=6)
24 h 尿蛋白测定是早期判定肾脏出现病变的常见手段,我们通过ELISA(Assaypro,Mouse Albumin ELISA Kit)检测2 组小鼠24 h 尿液中微量白蛋白含量,结果显示,与WT 组比较,miR-23b KO 组小鼠尿微量白蛋白显著升高(P<0.01),提示miR-23b KO 小鼠肾脏发生损害,见表2。我们又通过肾脏磁共振成像(magnetic resonance imaging,MRI)和彩色多普勒血流成像(color Doppler flow imaging,CDFI)来进一步验证。肾脏MRI 显示,与WT 组相比,肾脏皮质变薄而且皮髓质交界模糊,测得miR-23b KO 组小鼠的肾皮质显著变薄(P<0.05),预示肾脏已经发生病变;CDFI 显示,与WT 组比较,测得miR-23b KO 小鼠肾脏血管阻力指数显著升高(P<0.01),而肾脏血管阻力指数的变化是高血压的一个重要特征,见图3及表2。
我们对2 组小鼠肾脏组织切片进行HE 和PAS染色及纤维连接蛋白(fibronectin,FN)免疫组化,结果发现,miR-23b KO 小鼠相比WT 小鼠出现肾小球系膜区扩张、肾小球FN 沉积增加和糖原增多等形态学改变,进一步验证了miR-23b 在肾脏中的重要作用,见图4。通过ELISA 检测2 组小鼠血清中肾素和血管紧张素水平,与WT 组比较,miR-23b KO 小鼠肾素和血管紧张素均显著增高(P<0.05),见表2。
4 miR-23b 基因敲除小鼠肾脏组织RNA-Seq 基因的变化
对2 组小鼠进行RNA-Seq,发现非靶基因上调176 个,下调184 个,靶基因上调11 个,下调9 个,见表3。miR-23b 靶基因显著改变有20 个,非显著改变有709 个,非靶基因显著改变有340 个,非显著改变有24 279 个,见表4。miR-23b KO 小鼠肾脏总体变化基因富集于血流(绿色标注),肾脏总体变化基因与TargetScan 数据库中的miR-23b 靶基因有交集,并且这些基因富集于血流,见图5。
5 miR-23b靶定Cxcl12发挥生物学作用
根据上述生物信息学分析,Cxcl12(miR-23b 靶基因)是与血流关系最密切的基因,对临床上收集的肾病综合征病患者和健康人的肾活检样本进行RTqPCR,与健康人群组相比,肾病综合征患者Cxcl12基因表达水平显著增高(P<0.01),见图6A。同时,对2 组小鼠肾脏组织进行RT-qPCR,与WT 小鼠比较,miR-23b KO 小鼠的Cxcl12基因表达也发生显著增高(P<0.05),见图6B。这些研究结果表明miR-23b的表达与Cxcl12基因呈负相关。
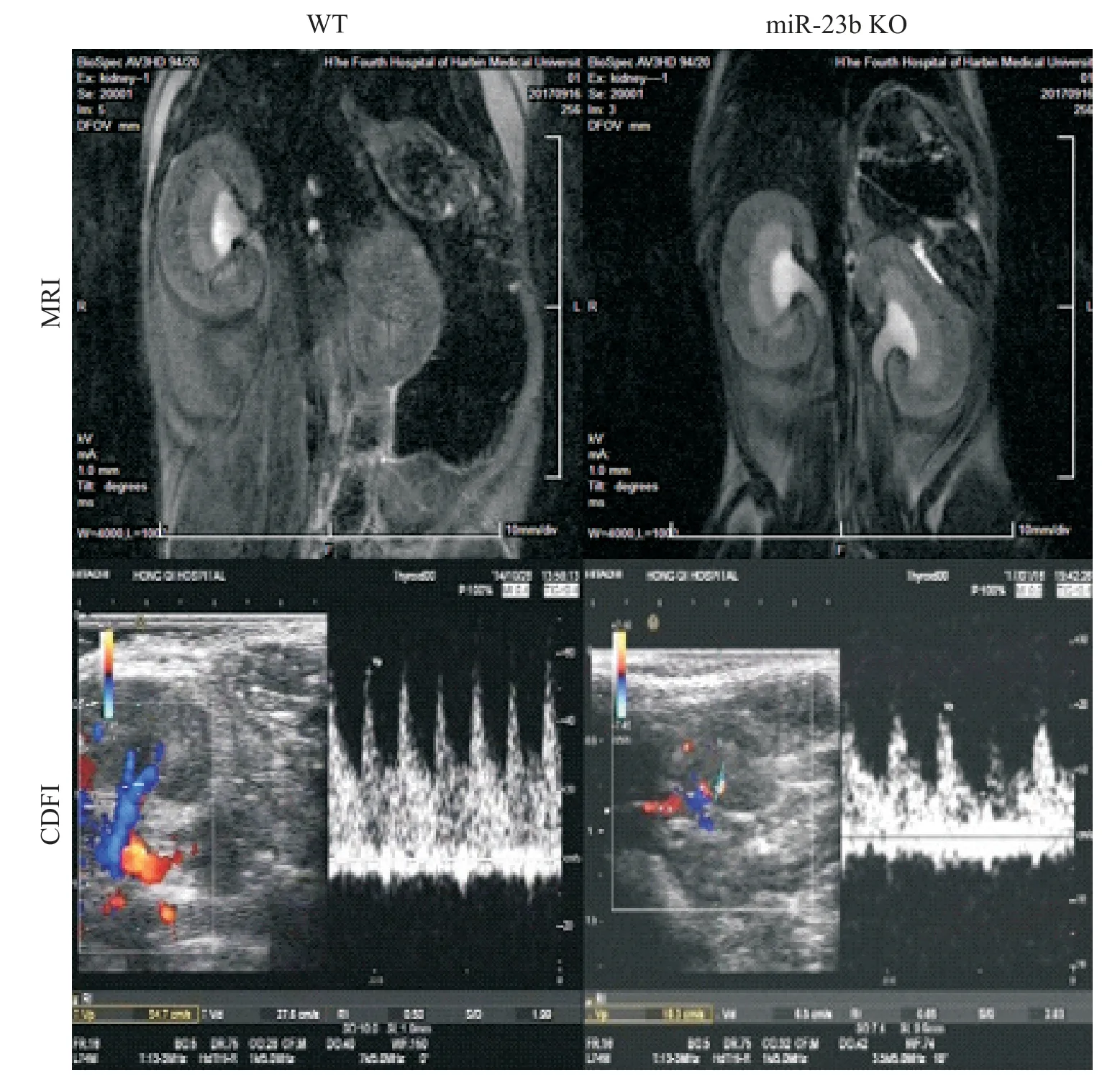
Figure 3.Renal magnetic resonance imaging(MRI)and color Doppler flow imaging(CDFI).Representative images of MRI and CDFI from miR-23b KO mice and WT mice showed that deletion of miR-23b induced renal hypertension.图3 肾脏磁共振成像和彩色多普勒血流成像

Figure 4.Representative images of HE staining,periodic acid-Schiff(PAS)staining and immunochemistry for fibronectin(FN)in mouse kidney(×400).图4 小鼠肾脏HE、PAS和FN免疫组化染色

表2 miR-23b KO小鼠尿微量白蛋白、血管阻力系数、肾皮质厚度和血清中肾素-血管紧张素的检测结果Table 2.Detection of urine microalbumin,vascular resistance coefficient,renal cortex thickness,and the serum levels of renin and angiotensin in the miR-23b KO mice(Mean±SD. n=6)

表3 WT 和miR-23b KO 小鼠肾脏RNA-Seq 后相关基因的变化Table 3.Changes of related genes in the kidneys of WT and miR-23b KO mice by RNA-Seq(n=6)
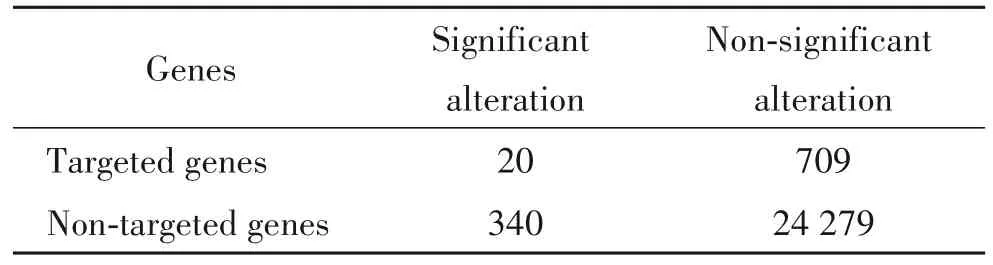
表4 WT 和miR-23b KO 小鼠肾脏RNA-Seq 相关基因与TargetScan数据库对比Table 4.Comparison of the kidneyrelated gene expression in the WT and miR-23b KO mice detected by RNA-Seq with the results of TargetScan database(n=6).
为了近一步检测miR-23b是否调控Cxcl12基因,我们进行体外萤光素酶报告基因实验,与WT 组比较,发现miR-23b过表达时可以显著抑制Cxcl12萤光素酶活性(P<0.01),而对miR-23b KO 和类似物实验时没有发生抑制,见图7。这些研究数据表明miR-23b通过调控靶基因Cxcl12发挥其生物学作用,进而调控小鼠血压的变化。
讨论
肾性高血压是肾脏发生病变引起的高血压,是慢性肾脏病最常见的并发症,随着肾脏的病变,高血压的发病率不断增加,近而对肾脏再次造成伤害。对于肾性高血压的治疗不仅要控制血压、还要延缓肾脏损伤[2,9]。目前,肥胖、高血脂症、糖尿病和吸烟等都是肾性高血压的诱因,由于肾性高血压的发生发展机制过于复杂,所以预防和治疗面临着一定的困难[10]。

Figure 5.KEGG database analysis of RNA-Seq results in the kidney of miR-23b KO mice.A:GO term enrichment analysis for global altered genes from miR-23b KO mice kidney,which showed that heart contraction and blood circulation were en⁃riched terms;B:GO term enrichment analysis for global changed genes overlapped with miR-23b target database,which showed that significantly altered miR-23b target genes were enriched in blood circulation.图5 miR-23b KO小鼠肾脏RNA-Seq结果的KEGG数据库分析
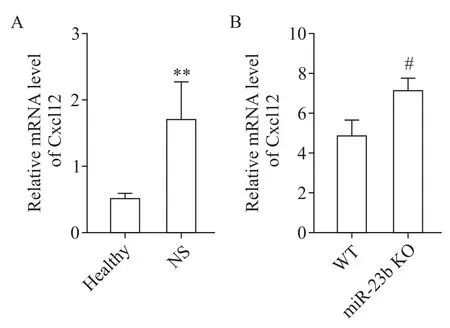
Figure 6.The mRNA expression of Cxcl12 gene in healthy controls,nephrotic syndrome(NS)patients(A),WT mice and miR-23b KO mice(B).Mean±SD. n=6.*P<0.05 healthy;##P<0.01 vs WT.图6 健康人群与肾病综合征患者及miR-23b KO 小鼠Cx⁃cl12基因检测

Figure 7.Luciferase reporter experiment.Mean±SD. n=6.*P<0.05,**P<0.01 vs WT group.图7 双萤光素酶报告实验
自从发现miRNA 以来,越来越多的证据表明它们在各种疾病中起着重要作用,包括糖尿病和肾功能不全等[11]。此外,足细胞特异性敲除Dicer(一种参与miRNAs处理的必需酶)会导致小鼠的肾小球和肾小管发生损伤[12-13]。miR-192/216a/217[14]、miR-200a[15]和miR-29a/b/c[16]等参与糖尿病肾病的发生发展。另外,miR-23b已被证明是肿瘤和一些炎症过程中免疫反应的重要调节因子[17-18],miR-23b 在免疫炎症疾病以及肿瘤疾病中的表达会降低,可以抑制肿瘤细胞扩散[17,19-20]。在本研究中,我们发现肾病综合征患者无论是血清还是肾脏组织中的miR-23b 的表达水平都显著降低。在miR-23b基因敲除小鼠上发现尿蛋白增高、肾小球系膜区扩张、肾小球纤维粘连蛋白沉积增加、肾皮质变薄等肾脏组织形态学上的改变,以及肾脏血管阻力指数显著增高、激活肾素-血管紧张系统发生高血压。RNA-Seq 测序发现肾脏总体变化基因富集于血流方面,肾脏总体变化基因与TargetScan 数据库中miR-23b 靶基因交集的显著变化富集于血流方面。根据上述生物信息学分析,Cxcl12是与血流关系最密切的基因[21-22],为了进一步阐明miR-23b 调节高血压的机制,我们采用RTqPCR 方法,发现临床肾病综合征患者的Cxcl12的表达变化与miR-23b KO 小鼠相同。这些数据强烈地提醒我们miR-23b 可调控Cxcl12基因。我们进行体外萤光素酶检测miR-23b是否调控靶基因Cxcl12,发现miR-23b 过表达时可以显著抑制Cxcl12萤光素酶测定。因此,我们更加确定miR-23b 通过调控靶基因Cxcl12发挥其生物学作用。
研究证实了抑制miR-23b 的表达可以促进Cxcl12的升高,同时,miR-23b 通过调节靶基因Cxcl12影响肾性高血压。研究表明miR-23b 可能成为治疗肾性高血压的一种有效的治疗方法。虽然对于肾性高血压的发生发展机制有很多的理论解释,但是miRNA 在肾性高血压的确切发生机制仍未完全阐明,在肾性高血压中,影响Cxcl12的表达会通过怎样的信号转导发挥作用还需要在以后的研究中进一步验证。本文的研究结果为后续发现诊断、治疗肾性高血压的标志物提供了有力的理论依据。
- 中国病理生理杂志的其它文章
- 利多卡因对脓毒症大鼠心肌损伤及Nrf2/HO-1通路的影响*
- 基于冷冻电子显微术的阳离子通道结构与功能研究进展*
- 淫羊藿苷通过抑制内质网应激减轻异丙肾上腺素诱导的H9c2细胞肥大损伤*
- 机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5-羟色胺代谢异常*
- 肠道ChREBP缺陷导致小鼠对果糖不耐受*
- Spheroid transplantable and functional retinal pigment epithelium derived from non-colony dissociated human induced pluripotent stem cells*

