利多卡因对脓毒症大鼠心肌损伤及Nrf2/HO-1通路的影响*
程 梅,董晓筠,朱 彬
(杭州市妇产科医院麻醉科,浙江杭州 310000)
脓毒症可引起肾、肺、心和肝等多种组织器官损伤及严重并发症,死亡率较高[1-3]。脓毒症早期即可出现心肌损伤,发生率高达50%,而心源性脓毒症休克患者病死率可高达70%[4],目前脓毒症心肌损伤主要有抗感染、体液复苏及使用儿茶酚胺强心类药物治疗等方法,但这些对心源性休克患者长期预后效果不佳,尚需寻找新的治疗方案[5-6]。利多卡因是一种临床常用的局部麻醉药及抗心律失常药,近来研究显示,利多卡因还具有抗炎效果,成为了脓毒症治疗研究中的一大热点[7],但其作用机制尚不完全明确。核因子E2 相关因子2/血红素加氧酶1(nuclear factor E2-related factor 2/heme oxygenase-1,Nrf2/HO-1)是重要的内源性抗氧化应激通路,与脓毒症急性肺损伤、心肌损伤等发生发展密切相关[8-10],但关于利多卡因对脓毒症大鼠心肌损伤及Nrf2/HO-1 通路的影响尚鲜有研究。本项工作拟探究利多卡因对脓毒症大鼠心肌损伤及Nrf2/HO-1 通路的影响,以期揭示其作用机制,为脓毒症心肌损伤的治疗提供参考资料。
材料和方法
1 实验动物
7~8 周龄健康雄性SPF 级SD 大鼠45 只,体质量250~300 g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2017-0005。本研究经过本院动物伦理委员会批准通过,符合中国实验动物制度伦理审查委员会关于动物实验的指导方针。
2 药品、主要试剂和仪器
碳酸利多卡因注射液(规格:5 mL∶86.5 mg)购自济川药业集团有限公司。丙二醛(malonaldehyde,MDA)检测试剂盒购自北京索莱宝莱科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒购自生工生物工程(上海)股份有限公司;大鼠肿瘤坏死因子α(tumor necrosis fac⁃tor-α,TNF-α)ELISA 试剂盒、肌红蛋白(myoglobin,Myo)ELISA 试剂盒、心肌肌钙蛋白Ⅰ(cardiac tropo⁃nin Ⅰ,cTnI)ELISA 试剂盒、高迁移率族蛋白B1(high mobility group box 1,HMGB1)ELISA 试剂盒,Nrf2、HO-1、β-actinⅠ抗和Ⅱ抗羊抗兔IgG均购自Ab⁃cam。IX75 奥林巴斯光学显微镜购自OLYMPUS;MODEL 550型酶标仪购自Bio-Rad。
3 方法
3.1 脓毒症大鼠模型制备及分组 45只SD 大鼠随机分为3组:假手术(sham)组、模型(model)组和利多卡因(lidocaine)组,每组15 只。模型组和利多卡因组参考文献[11]采用盲肠结扎穿孔法制备脓毒症大鼠模型。腹腔注射2%戊巴比妥钠(60 mg/kg)进行麻醉,切口处常规消毒后,于下腹正中做约2 cm 纵切口,打开腹膜,迁出盲肠,结扎回盲瓣至盲肠游离端外2/3,并用针头穿透至少量肠内容物挤出,将盲肠还纳腹腔,关腹,并逐层缝合。术中监测大鼠呼吸、心电图及血氧饱和度。以大鼠出现竖毛、少尿、腹泻腹胀、肛温降低等症状并结合组织病理变化提示脓毒症大鼠模型制备成功。假手术组大鼠只打开腹腔后缝合,不进行盲肠结扎穿孔。造模后利多卡因组大鼠立即给予利多卡因10 mg/kg 负荷剂量注射,然后以10 mg·kg-1·h-1的剂量尾静脉输注3 h,假手术组和模型组用等量生理盐水代替。24 h 后进行血清及组织标本采集,检测相关指标变化。
3.2 ELISA 检测血清TNF-α、HMGB1、Myo 和cTnI水平 造模24 h 后采集大鼠尾静脉血,常规离心后分离血清,采用ELISA检测血清TNF-α、HMGB1、Myo及cTnI水平,具体操作严格按照试剂盒说明书进行。
3.3 TTC 染色法检测心肌组织梗死区面积 每组随机选5 只大鼠尾静脉注射1%伊文思蓝染料2 mL,待全身蓝染后,处死大鼠,取心脏组织快速置于液氮中,从心尖沿心脏短轴均匀切成1.5 mm 厚度的切片,置于1% TTC 溶液中37℃孵育10 min,10%甲醛中固定,拍照,采用ImageJ 软件测量梗死区、危险区面积,心肌梗死率(%)=梗死区面积/危险区面积×100%。
3.4 HE 染色检测心肌组织病理损伤变化 处死各组剩余10 只大鼠,取部分心肌组织置于4%多聚甲醛中固定,另取部分心肌组织置于液氮中保存备用。取固定24 h 后的心肌组织进行石蜡包埋、切片(5 μm),进行HE 染色,经显微镜观察心肌组织损伤病理变化。
3.5 生物化学法检测心肌组织MDA和SOD水平取部分心肌组织制备匀浆液(体积比1∶10),采用生物化学法检测MDA 和SOD 水平,具体步骤严格参照试剂盒说明书进行。
3.6 RT-qPCR 法检测心肌组织Nrf2 和HO-1 mRNA的表达水平 采用RNA 提取试剂盒提取各组心肌组织中RNA,紫外分光光度计检测其浓度及纯度。反转录得到cDNA,置于-20℃保存备用。RT-qPCR扩增Nrf2 和HO-1 mRNA。20 μL 反应体系:2×TB Green Premix Ex Taq Ⅱ(TliRNaseH Plus)10.0 μL,ROX Dye Ⅱ(50×)0.4 μL,cDNA(50 mg/L)2.0 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 6.0 μL。反应条件:95℃30 s;95℃5 s,60℃34 s,40 个循环。采用2-ΔΔCt法定量分析心肌组织中Nrf2 和HO-1 mRNA的相对表达水平。
3.7 Western blot法检测心肌组织Nrf2和HO-1蛋白的表达量 提取各组大鼠心肌组织总蛋白,BCA 法测定蛋白浓度,置于-80℃保存备用。取50 μg 蛋白样品进行SDS-PAGE,PVDF 膜转膜,室温封闭,添加Nrf2(1∶1 000)、HO-1抗体(1∶2 000)、β-actin抗体(1∶5 000),4℃孵育过夜,TBST 缓冲液洗膜,添加Ⅱ抗羊抗兔IgG(1∶5 000)室温孵育2 h,显色,曝光胶片,观察结果并分析蛋白灰度值。
4 统计学处理
采用SPSS 25.0 软件对实验数据进行统计学处理。实验数据以均数±标准差(mean±SD)表示,多组数据比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1 各组大鼠血清TNF-α和HMGB1水平比较
与假手术组比较,模型组大鼠血清TNF-α 和HMGB1 水平显著升高(P<0.01);与模型组比较,利多卡因组大鼠血清TNF-α 和HMGB1 水平显著降低(P<0.01),见图1。
2 各组大鼠心肌梗死率的比较
假手术组、模型组和利多卡因组大鼠心肌梗死率分别为0、(48.52±4.67)%和(41.23±4.15)%,差异有统计学意义(P<0.01)。与模型组比较,利多卡因组大鼠心肌梗死率显著降低(P<0.01),见图2。
3 各组大鼠血清Myo和cTnI水平比较
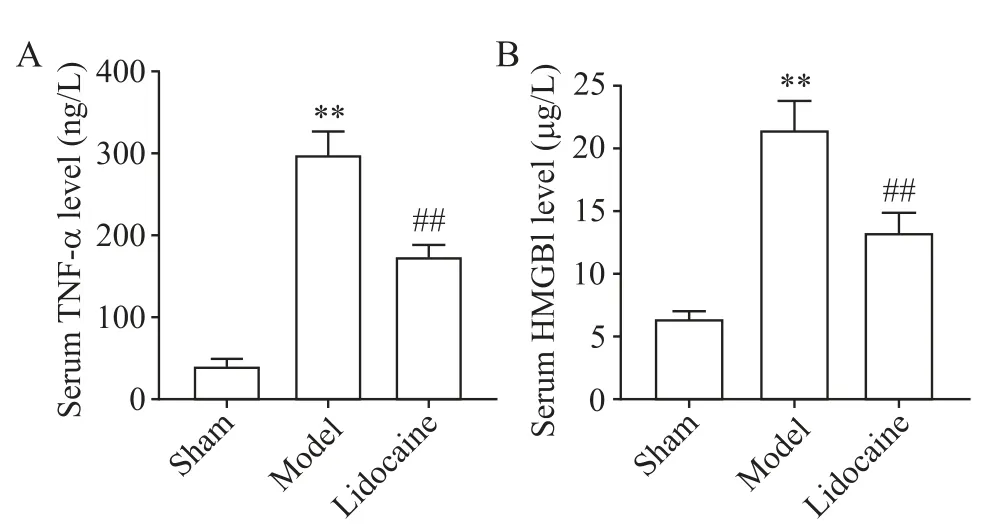
Figure 1.Comparsion of serum TNF-α(A)and HMGB1(B)levels of rats in each group.Mean±SD. n=15.**P<0.01 vs sham group;##P<0.01 vs model group.图1 各组大鼠血清TNF-α和HMGB1水平比较

Figure 2.TCC staining of rat myocardium in each group.图2 各组大鼠心肌TCC染色图
与假手术组比较,模型组大鼠血清Myo和cTnI水平显著升高(P<0.01);与模型组比较,利多卡因组大鼠血清Myo和cTnI水平显著降低(P<0.01),见图3。

Figure 3.Serum Myo(A)and cTnI(B)levels of rats were com⁃pared in each group.Mean±SD. n=5.**P<0.01 vs sham group;##P<0.01 vs model group.图3 各组大鼠血清Myo和cTnI水平比较
4 各组大鼠心肌组织病理学变化
假手术组大鼠心肌纤维结构排列紧密,无明显异常;模型组大鼠心肌组织排列紊乱、细胞水肿、炎症细胞浸润、间质血管扩张充血,可见局灶性心肌坏死;利多卡因组大鼠心肌病理损伤减轻,见图4。

Figure 4.Morphological changes of myocardial pathology in each group(HE staining,scale bar=100 μm).图4 各组大鼠心肌病理学形态变化
5 各组大鼠心肌组织MDA含量和SOD活性比较
与假手术组比较,模型组大鼠心肌组织MDA 含量显著升高,SOD 活性显著降低(P<0.01);与模型组比较,利多卡因组大鼠心肌组织MDA 含量显著降低,SOD活性显著升高(P<0.01),见图5。
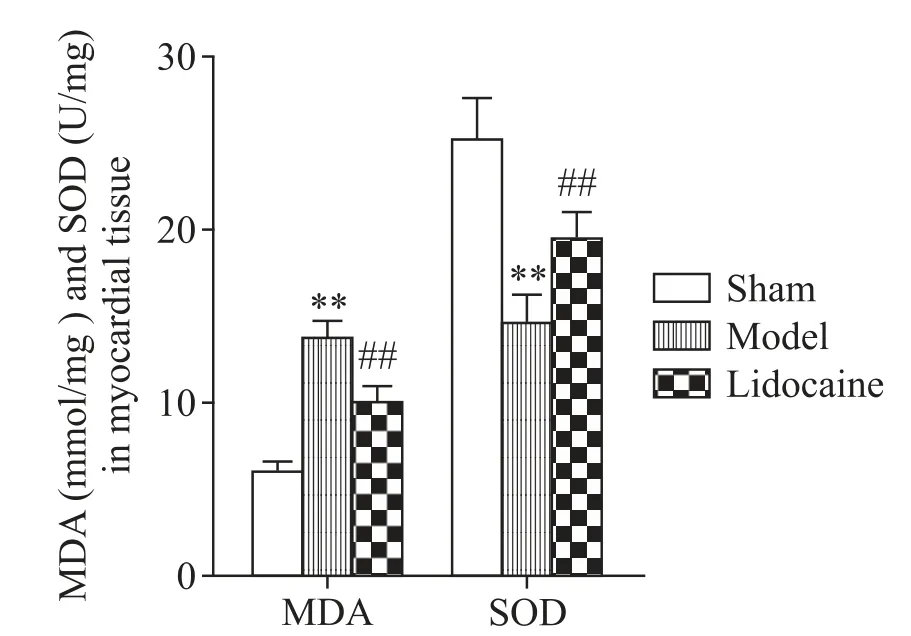
Figure 5.Comparison of MDA content and SOD activity in myo⁃cardial tissue of rats in each group.Mean±SD. n=10.**P<0.01 vs sham group;##P<0.01 vs model group.图5 各组大鼠心肌组织MDA含量和SOD活性比较
6 各组大鼠心肌组织Nrf2 和HO-1 mRNA 表达水平比较
与假手术组比较,模型组大鼠心肌组织Nrf2 和HO-1 mRNA 表达水平显著升高(P<0.01);与模型组比较,利多卡因组大鼠心肌组织Nrf2 和HO-1 mRNA表达水平进一步升高(P<0.01),见图6。
7 各组大鼠心肌组织Nrf2 和HO-1 蛋白表达量比较
与假手术组比较,模型组大鼠心肌组织Nrf2 和HO-1 蛋白表达量升高(P<0.01);与模型组比较,利多卡因组大鼠心肌组织Nrf2 和HO-1 蛋白表达量进一步升高(P<0.01),见图7。
讨论

Figure 6.Relative expression of Nrf2 and HO-1 mRNA in myo⁃cardial tissue of rats in each group.Mean±SD. n=10.**P<0.01 vs sham group;##P<0.01 vs model group.图6 各组大鼠心肌组织Nrf2和HO-1 mRNA水平的比较
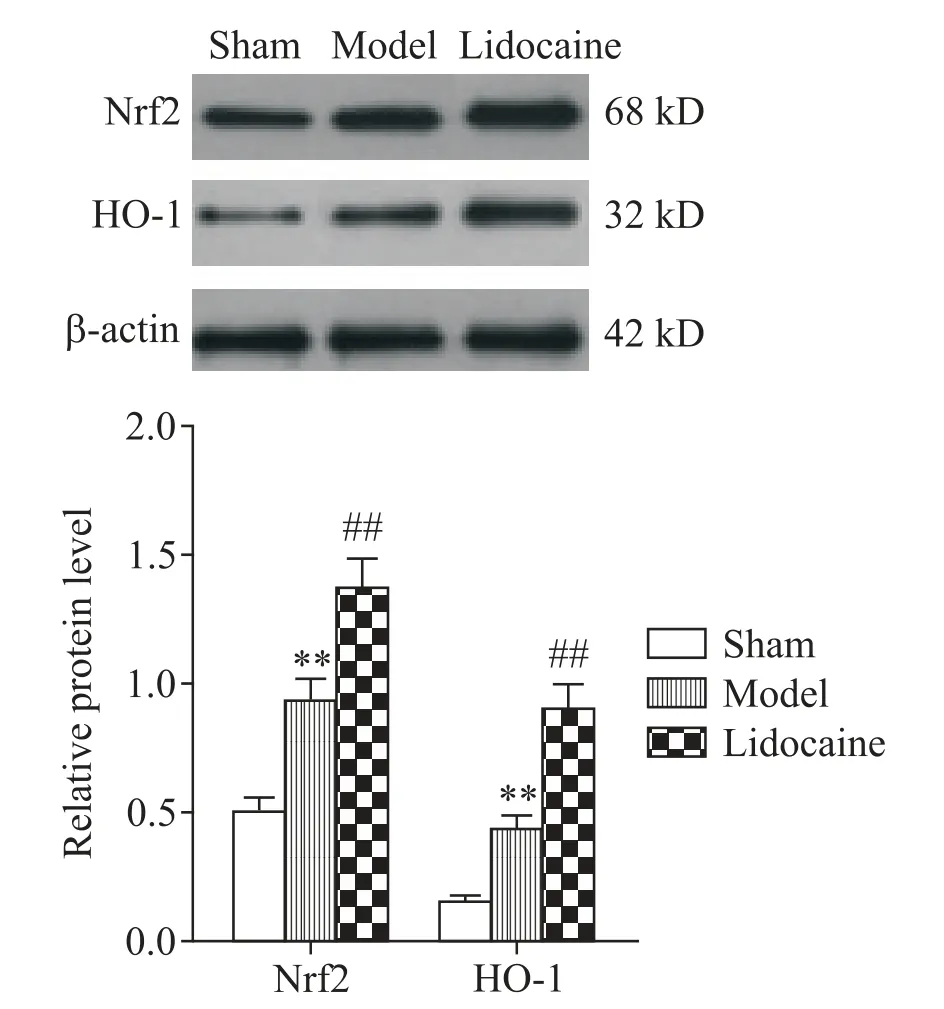
Figure 7.Relative protein expression of Nrf2 and HO-1 in myo⁃cardial tissue of rats in each group.Mean±SD. n=10.**P<0.01 vs sham group;##P<0.01 vs model group.图7 大鼠心肌组织Nrf2和HO-1蛋白表达
本研究采用经典盲肠结扎穿孔法制备脓毒症大鼠模型,脓毒症发生时,大量炎症因子如TNF-α、HMGB1 及白细胞介素6(interleukin-6,IL-6)等释放可导致多器官损伤。TNF-α 是脓毒症发生发展的重要促炎因子,HMGB1 是一种普遍存在的核蛋白,可介导先天免疫反应,是脓毒症致死效应的关键炎症介质,脓毒症晚期单核/巨噬细胞和树突状细胞可在TNF-α 等炎症因子刺激作用下分泌HMGB1 等促炎因子,HMGB1 表达水平与脓毒症严重程度及预后高度相关[12-13]。脓毒症可导致多器官功能障碍,心脏是易受损器官之一,心肌损伤是导致脓毒症死亡率增加的重要原因之一。Myo 和cTnI 是心肌损伤标志物,其中Myo 是一种氧结合的血红蛋白,主要存在于骨骼肌和心肌,对心肌损伤具有较高的敏感性。cT⁃nI 特异存在于心肌细胞中,心肌细胞损伤时释放入血,且持续时间较长。本研究结果显示,与假手术组比较,模型组大鼠血清TNF-α 和HMGB1 水平、大鼠心肌梗死率、血清Myo 和cTnI水平显著升高,提示脓毒症心肌损伤大鼠制备成功。而利多卡因可降低脓毒症心肌损伤模型大鼠血清TNF-α、HMGB1、Myo 和cTnI 水平,减轻心肌病理损伤,减少心肌梗死面积。利多卡因是一种临床常用药,具有价格低廉、抗炎、抗细胞损伤等作用,还可加快术后康复、促进抗癌细胞增殖等作用,持续静脉泵注射可有效降低脓毒症大鼠炎症因子TNF-α 和HMGB1 表达,抑制肺组织HMGB1 表达,减轻脓毒症肺损伤,提高动物存活率[14],提示利多卡因可抑制脓毒症心肌损伤大鼠炎症因子表达,减轻炎症反应及心肌梗死损伤程度,与郭志佳等[15]研究报道结果一致。
氧化应激反应过度激活是引起心肌损伤的重要环节,其中Nrf2/HO-1 通路是抗氧化应激反应的重要信号通路之一,Nrf2 是重要抗氧化因子,生理条件下,Nrf2 与Kelch 样环氧氯丙烷相关蛋白1(Kelch like epichlorohydrin associated protein 1,Keap1)相偶联处于抑制状态,氧自由基可刺激Nrf2增加并与Ke⁃ap1 解离,Nrf2 通过核转位进入细胞核与氧化反应元件(antioxidant responsive element,ARE)启动HO-1、SOD 和GSH-PX 等抗氧化酶表达,启动抗氧化反应[16-17]。研究认为,促进Nrf2/HO-1 通路激活可保护心肌梗死后不良的心脏重构[18],可能与促进下游SOD和GSH-PX等抗氧化酶表达,提高心肌抗氧化能力有关,而利多卡因减轻心肌损伤是否与该通路激活有关未见报道[19]。本研究结果显示,与假手术组比较,模型组大鼠心肌组织MDA 含量、心肌组织Nrf2 和HO-1 蛋白表达量显著升高,SOD 活性显著降低,可能与心肌损伤后机体出现自身代偿使Nrf2/HO-1 通路激活有关[20];利多卡因可显著降低脓毒症心肌损伤大鼠心肌组织MDA 含量,增加SOD 活性及心肌组织Nrf2 和HO-1 表达水平,与文献报道一致,提示利多卡因可能对Nrf2/HO-1 通路激活有促进作用,进而减轻脓毒症大鼠心肌损伤,提高其抗氧化应激能力。
综上所述,利多卡因可减轻脓毒症大鼠心肌损伤,其机制可能与促进Nrf2/HO-1 通路激活,提高心肌细胞抗氧化应激能力有关。但本项工作只是初步探究了利多卡因抗脓毒症心肌损伤的作用机制,关于其对Nrf2/HO-1 下游炎症相关信号通的影响尚不完全明确,有待深入研究。
- 中国病理生理杂志的其它文章
- miR-23b通过靶基因Cxcl12调控肾性高血压*
- 基于冷冻电子显微术的阳离子通道结构与功能研究进展*
- 淫羊藿苷通过抑制内质网应激减轻异丙肾上腺素诱导的H9c2细胞肥大损伤*
- 机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5-羟色胺代谢异常*
- 肠道ChREBP缺陷导致小鼠对果糖不耐受*
- Spheroid transplantable and functional retinal pigment epithelium derived from non-colony dissociated human induced pluripotent stem cells*

