经导管肺动脉瓣置换术和分支肺动脉支架置入术一站式治疗
张长东 尚小珂 陈澍 李庚 钟禹成 董念国
对于法洛四联症等复杂先天性心脏病而言,由于跨环补片修复技术的广泛应用,患者术后远期常常出现严重肺动脉瓣反流等合并症,晚期可导致进行性右心室扩张、三尖瓣反流、右心室功能障碍和死亡。经导管肺动脉瓣置换术(transcatheter pulmonary valve replacement,TPVR)目前已经被认为是这类患者的首选治疗方式[1],对于解剖条件合适者可替代外科手术。后天性分支肺动脉狭窄也是复杂先天性心脏病术后的常见远期并发症,除吻合口瘢痕收缩外,局部血管牵拉扭曲、局部内皮过度增生也是病因之一[2]。分支狭窄甚至闭塞可导致肺动脉压增高、患侧肺缺血及反复肺炎,同时加重了肺动脉扩张和肺动脉瓣反流,极大地影响患者的心肺功能、生存质量及预期寿命。近年来随着支架置入技术的改进、符合儿童肺动脉特点的新型支架的开发[3],支架置入术已成为肺动脉狭窄尤其是分支狭窄的首选治疗措施[4]。查阅国内外文献,对于同时存在肺动脉瓣反流和分支肺动脉狭窄的患者,TPVR和分支肺动脉支架置入术一站式治疗未见报道。两种术式同期实施操作难度较大,本例是这一技术方式的首次报道。
1 临床资料
患者 男,23岁。因“近1个月开始出现活动后心慌及水肿”2019年3月10日就诊于华中科技大学同济医学院附属协和医院。入院查体示:心界扩大,心律齐,P2消失,未闻及杂音。16年前曾行法洛四联症矫治术。既往无其他特殊病史。实验室检查基本在正常范围。心电图示:窦性心律,不完全性右束支传导阻滞,电轴右偏。X线胸片示:右肺纹理增粗模糊,右肺门增大浓密,左上肺野少许斑片条索影,心影增大。超声心动图示:法洛四联症术后,心室水平无分流,右心室流出道及肺动脉瓣血流通畅,肺动脉瓣重度关闭不全,左肺动脉起始段内径0.8 cm、流速增快至2.8 m/s,肺动脉主干管径约4.5 cm,右肺动脉起始段内径2.1 cm、流速2.0 m/s,双侧上腔静脉。心脏磁共振成像示:右心房右心室扩大,右心室舒张末期容积315 ml,右心室收缩期末容积186 ml,右心室射血分数44%。左肺动脉起始段狭窄(约0.6 cm),肺动脉瓣大量反流、三尖瓣中量反流、主动脉瓣少量反流。冠状动脉CT血管造影(CT angiography,CTA)示:右心房、右心室扩大,肺动脉直径增宽(分叉水平3.5 cm、主肺动脉最宽处4.9 cm、肺动脉瓣环水平4.6 cm、右心室流出道瘤最宽处4.8 cm、右心室流出道肌性出口3.8 cm,分叉与肌性出口平面距离5.8 cm,图1 A),右肺动脉高压,左肺动脉开口狭窄,最窄处0.54 cm,狭窄后稍增宽至1.45 cm,远端分支纤细(图1 B)。
经反复讨论,决定行TPVR+左肺动脉球囊扩张支架置入术一站式手术。手术在全身麻醉下进行,穿刺双侧股静脉通道,左侧股静脉入径同时插入2根血管鞘。右心导管检查右肺动脉压45/10(22)mmHg(1 mmHg=0.133 kPa),右心房压12/6(8)mmHg,全肺阻力511 dyn·s·cm-5。将猪尾导管送至右心室流出道后根据术前CTA参考的工作体位在多个角度下进行数字减影血管造影,显示支架置入和瓣膜释放的最佳投照角度(图1 D)。经左侧、右侧股静脉入径各送入1根MPA1导管(Cordis Company,US)分别至左肺动脉和右肺动脉远段末梢(图1 E),测量左肺动脉压力为17/7(10)mmHg。经左侧股静脉辅入径送入猪尾导管用于造影定位。将左肺动脉轨道交换为Amplatz SuperStiff导丝(Boston Scientific,US),右肺动脉交换为Lunderquist ExtraStiff导丝(Cook Medical,US)。沿左肺轨道送入90 cm 12 F导引鞘(Cook Medical,US)至左肺动脉狭窄以远,沿右肺轨道送入预装好的自膨胀式经导管肺动脉瓣膜PT-Valve(型号:PTV44-26,Med-Zenith,China)至肺动脉分叉水平(图1 F)。选择右前斜50°+头位20°作为工作体位,造影定位确认上述到位准确(图1 G)。于左侧导引鞘内送入预装载在12 mm Balloon-in-Balloon球囊(Numed,US)上的长度28 mm的Covered Cheatham-Platinum 支架(Numed,US)进入左肺动脉,回撤导引鞘,造影确定支架准确定位在狭窄部位后先后以5 atm(1 atm=101.325 kPa)、7 atm扩张内、外球囊,将左肺分支支架准确置入,撤出球囊和导引鞘,更换导管测量跨狭窄压差从术前28 mmHg降低至术后8 mmHg,造影效果满意,撤出左肺动脉轨道(图1 H)。造影确认位于肺动脉分叉水平的肺动脉瓣远端定位不变后开始逐步释放瓣膜,小心调整瓣膜置入位置,使其近端花冠锚定于右心室流出道肌性出口平面水平,瓣膜置入成功后退出输送系统,交换猪尾导管至肺动脉瓣上造影,测量无跨瓣压差,瓣周仅少量反流,瓣膜支架形态位置满意(图1 I),肺动脉压下降至32/20(24)mmHg,手术成功。术后超声心动图提示支架瓣膜功能良好,肺动脉瓣口峰值流速1.8 m/s,瓣周少量反流,左肺动脉开口流速1.8 m/s。复查CTA显示支架定位准确,形态正常(图1 C)。术后定期随访至今已有一年,患者一般情况良好,超声心动图指标均在正常范围,无并发症发生。
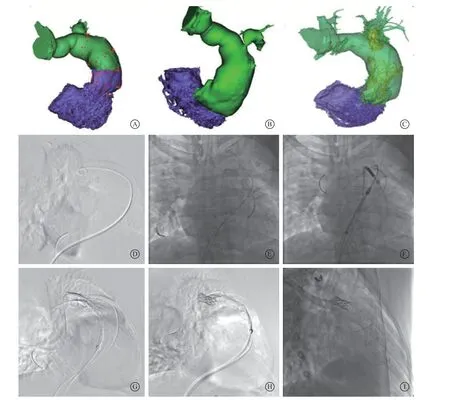
图 1 经导管肺动脉瓣置换术和分支肺动脉支架置入一站式治疗的术前术后CT血管造影分析和手术步骤 A. CT血管造影显示肺动脉及右心室流出道多水平所测量直径;B. CT三维重建显示左肺动脉开口重度狭窄;C. 手术后复查CT显示肺动脉瓣支架与左肺动脉支架位置准确,无移位;D. 在术前CT血管造影建议下的工作体位下进行肺动脉造影;E. 经左、右侧股静脉入径分别送1根MPA1导管进入左肺和右肺动脉远段末梢;F. 左肺、右肺动脉超硬导丝轨道分别送入12 F导引鞘和PT-Valve肺动脉瓣;G. 右前斜50° +头位20°工作体位下造影确认两侧支架到位准确;H. 先进行左肺动脉支架置入术,退出左肺动脉轨道;I. 后进行肺动脉瓣支架的定位和释放,最终瓣膜支架位置满意
2 讨论
TPVR主要用于治疗法洛四联症矫治术后残余肺动脉瓣反流,对于此前使用跨环补片技术的患者来说,因存在严重的右心室流出道和肺动脉扩张,只有少部分患者解剖学上适合进行TPVR。目前已出现了几种适用于自体流出道肺动脉瓣反流的经导管肺动脉瓣[5],包括杭州启明医疗的Venus P Valve、美敦力公司的Harmony Valve、韩国大宇公司的Pulsta Valve,但因其主要铆定方式为瓣环水平铆定,当瓣环径过大、超过32 mm时则难以实施TPVR。此外,当合并存在分支肺动脉狭窄时,TPVR常常被视为禁忌证或排除标准[6]。分支肺动脉狭窄或闭塞往往会导致肺动脉压增高、肺动脉扩张和肺动脉瓣反流进一步加重,也限制了患者实施TPVR的解剖适应证。本例患者使用的PTValve是国内开发的一种新型经导管肺动脉瓣,其为窄腰、对称性设计,锚定部位主要为两侧的花冠,因而适应证和瓣膜型号的选择不受瓣环直径限制,相应地扩大了手术的适应证,同时窄腰设计也使得腰部瓣位的支架与流出道无紧密接触,可使冠状动脉受压风险降至最低[7]。
本例是一站式TPVR和分支肺动脉支架置入术的首次报道,由于肺动脉瓣膜支架和分支支架对定位要求均较高,在经导管推送和置入释放时存在明显的相互影响和干扰。术前对于该患者具体实施分期手术还是一站式、手术操作流程等问题团队曾有过激烈的争论,如先置入CP支架则在推送肺动脉瓣膜支架时很可能导致CP支架移位,如后置入CP支架则存在12 F导引鞘通过生物瓣膜时导致瓣膜损伤的风险,且肺瓣支架较长、锚定位置局限,是否会在置入后与CP支架互相干扰也是突出的问题。CTA分析结果提示左肺动脉狭窄位于开口水平局限位置,而肺动脉瓣置入定位仅能选择流出道近端的单水平锚定,支架扩张和瓣膜释放的技术操作对术者也是极大的挑战,一旦支架定位不准确则可能导致无法收场的后果。经过反复讨论,团队决定采取两个支架互相干扰最少的一站式手术方式,即建立双侧肺动脉轨道,双侧股静脉入径同时送入各自的长导引鞘和支架,确定定位准确后,先后释放分支肺动脉支架和肺动脉瓣膜。在此最佳手术策略下,该例患者的手术结果优异,分支支架和瓣膜支架均精确锚定,功能良好,随访至今1年无支架移位断裂并发症出现。对于合并分支肺动脉狭窄的肺动脉瓣反流患者,在经过CTA充分评估风险和可行性后,一站式介入治疗是一种可选择的手术策略。

