MP 23S rRNA A2063G 基因变异的社区获得性肺炎患儿临床表型与胸部影像的关系
于 聪 吕 伟 张晓英
上海交通大学医学院附属第九人民医院(上海 200011)
儿童肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia,MPP)发病率占儿童社区获得性肺炎(community acquired pneumonia,CAP)的10%~40%[1],在密集人群中高达60%[2]。大环内酯类药物抗感染作用的结合位点位于MP 的核糖体50 S 亚单位23 S rRNA 基因,这些区域的碱基变异可降低大环内酯类抗生素和MP 的核糖体的亲和力从而引起耐药,主要耐药株包括A 2063 G 和A 2064 G 分离株[3-4],其中,A 2063 G 变异检出率高[5],致使临床上难治性及危重症MPP 逐年增多。由于MP 主要侵犯呼吸系统,亦可经血流播散至全身器官组织,引起全身症状及肺外表现,患儿体征与肺部病变程度、实验室检查常不一致,具有一定滞后性,易发生误诊及漏诊,给临床诊疗带来困难。由此可见,早期诊断对MP 感染具有重要意义。儿童MPP 胸部平片表现多样[1,6],MPP 胸部影像学特征与临床表型之间的相关性研究少有报道。为此,拟通过研究23 S rRNA A 2063 G MPP 患儿的临床表型与胸部影像学评分之间的关系,为早期诊断23 S rRNA A 2063 G MPP 提供新的思路。
1 对象与方法
1.1 研究对象
以2019 年3 月至2020 年3 月于上海交通大学医学院附属第九人民医院儿科住院治疗的CAP 患儿为研究对象。纳入标准:①年龄1 个月~14 岁;②符合CAP诊断标准[1,6-7];③排除半年内患有重症肺炎或既往肺炎未痊愈者或恢复期患儿,存在基础疾病如先天性心脏病、免疫缺陷或抑制、哮喘、慢性肺病、结核或其他系统疾病等患儿,医院内获得性肺炎患儿,使用四环素或氟喹诺酮类药物治疗后患儿,临床资料不完整者及监护人不同意者。
入组对象根据实验室结果(MP IgM≥1:160或恢复期和急性期MP-IgG 抗体滴度呈4 倍以上增高或减低[6])分为MPP 组和非MPP(N-MPP)组;MPP 组根据咽拭子核酸检测是否存在A2063G变异,再分为变异组(G-MPP)组和未变异组(A-MPP)组。本研究征得患儿家长知情同意签字,并经本院医学伦理委员会审核通过。
1.2 方法
1.2.1 资料收集 通过查阅住院电子病历收集CAP患儿临床资料。包括:①一般资料,年龄、性别、发热时段内最高体温、体温超过37.4 ℃的持续天数(热程)、住院天数、动脉血氧分压等;②实验室检查,白细胞(WBC)、中性粒细胞百分比(N%)、淋巴细胞百分比(L%)、血小板(PLT)、C-反应蛋白(CRP)、乳酸脱氢酶(LDH)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酸激酶(CK-MB)、MP-抗体(IgG/IgM)、咽拭子MP 聚合酶链反应(real-time PCR)、呼吸道病原体抗体谱等;③胸部影像学检查,胸部X线平片(病程3天内)。一般资料以入院时情况作为基线资料进行比较,各项实验室检查及影像学检查以入院后首次检查结果为基线资料进行比较。
1.2.2 MP-PCR检测 上海生工生物工程试剂公司提供的DNA提取试剂盒对MPP患儿咽拭子标本DNA进行提取,操作步骤参照说明书进行。实时荧光定量PCR 法对其进行检测,引物及探针参照参考文献[8]的研究方法。
1.2.3 MP耐药基因检测 采用PCR法扩增MP阳性标本23 S rRNA 基因区域,对扩增产物进行毛细管电泳检测及测序分析,通过与MP 标准株序列比较判断有无A2063G[9]。
1.2.4 胸部影像学评分方法 参照殷人易等[10]肺炎胸片(患病急性期)吸收评价量表(评分部分),由2名主治及以上医师对胸部X线平片进行评分。
1.3 统计学分析
采用SPSS 25.0统计软件进行数据处理。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t 检验;非正态分布计量资料以中位数(四分位数范围)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况比较
共纳入142 例CAP 患儿,其中男78 例、女46例,中位年龄5 岁(范围1 个月~14 岁)。根据病原体结果分为MPP 组89 例、N-MPP 组53 例。MPP 组和N-MPP 组间性别、胸部影像学评分差异均无统计学意义(P>0.05);两组患儿年龄的差异有统计学意义(P<0.05)。见表1。

表1 MPP组和N-MPP组年龄、性别及胸部影像学评分比较
2.2 G-MPP组与A-MPP组临床表型比较
89例MPP患儿,A-MPP 62例、G-MPP 27例,变异率为30.34%。G-MPP 组的热程、住院时间长于A-MPP组,低氧血症发生率及低氧患儿的胸部影像学评分均高于A-MPP组,差异有统计学意义(P<0.05)。两组经大环内酯类药物治疗后,发热、咳嗽好转时间及肺部啰音消散时间等临床表型比较差异无统计学意义(P>0.05)。见表2。
3 讨论
儿童对MP普遍易感,MP引起的呼吸道感染比例逐年上升,国内研究指出MP 感染几乎覆盖了1/3 的儿童呼吸道感染的人群[11]。文献报道表明MP 感染的高发人群为学龄儿童及青春期儿童[12],与本研究结果(中位年龄5岁)基本相符合。
近年来,国内外均有文献报道分离出对大环内酯类抗菌药物耐药的菌株。从全球MP耐药率分布来看,中国、日本等亚洲国家的MP 耐药率明显高于以色列(22%)、法国(9.8%)、美国(8.2%)、德国(3.2%)等欧美国家[13-16],可能与儿童抗生素使用不规范甚至滥用有关。本研究中MP 23 S rRNA A 2063 G 变异率为30.34%,低于国内其他学者的研究数据,可能与口咽部位的MP 数量较低、采集标本后未及时送检及患儿配合度较低等因素导致的误差有关,但仍高于一些欧美国家,说明目前我国 MP 耐药现状严重,临床医师应足够重视。
研究显示,MP 23S rRNA结构域V区基因位点变异后,大环内酯类抗生素与核糖体亲和力下降而引起耐药,患儿可能表现发热持续时间、咳嗽时间、住院时间等延长,也易并发肺外并发症[17]。本研究中G-MPP组较A-MPP组患儿的热程、住院时间延长,低氧血症发生率增高,与上述表现类似。回顾病史,G-MPP 组中有2 例重症MPP 患儿,均伴有胸腔积液和肝功能损害,而A-MPP 组中未见,提示重症MPP 可能存在A2063G变异。本研究参考国内学者制定的肺炎胸片吸收评价量表对所有CAP患儿胸部影像学进行评分,在两组患儿完成胸部X线平片时间相同的情况下(均在发病3天内),发现MPP组与N-MPP组患儿评分差异无统计学意义,进一步比较发现,G-MPP 和A-MPP的胸部影像学评分亦无统计学意义,但G-APP组患有低氧血症的患儿胸部影像学评分较A-MPP高,提示仅利用胸部影像学评分判断是否存在MP感染及是否耐药尚不具备可行性。
回顾病史还发现,MP 23 S rRNA A 2063 G 感染后结局亦不尽相同,除去2 例重症的表现形式外,确认为肺炎支原体耐药菌株(macrolide-resistance Mycoplasma pneumoniae,MRMP)感染的病例在接受大环内酯类药物或者同时使用小剂量激素治疗时,发热、咳嗽好转时间及肺部啰音消散时间等临床症状也能有效缓解,且这些症状缓解的时间与未发生基因变异的病例用药效果类似,差异无统计学意义。可见在临床上对于MRMP 使用大环内酯类药进行治疗仍能得到有效救治,因此MP 基因变异与临床实际使用大环内酯类药物的治疗效果之间的关系可能并不是绝对的。
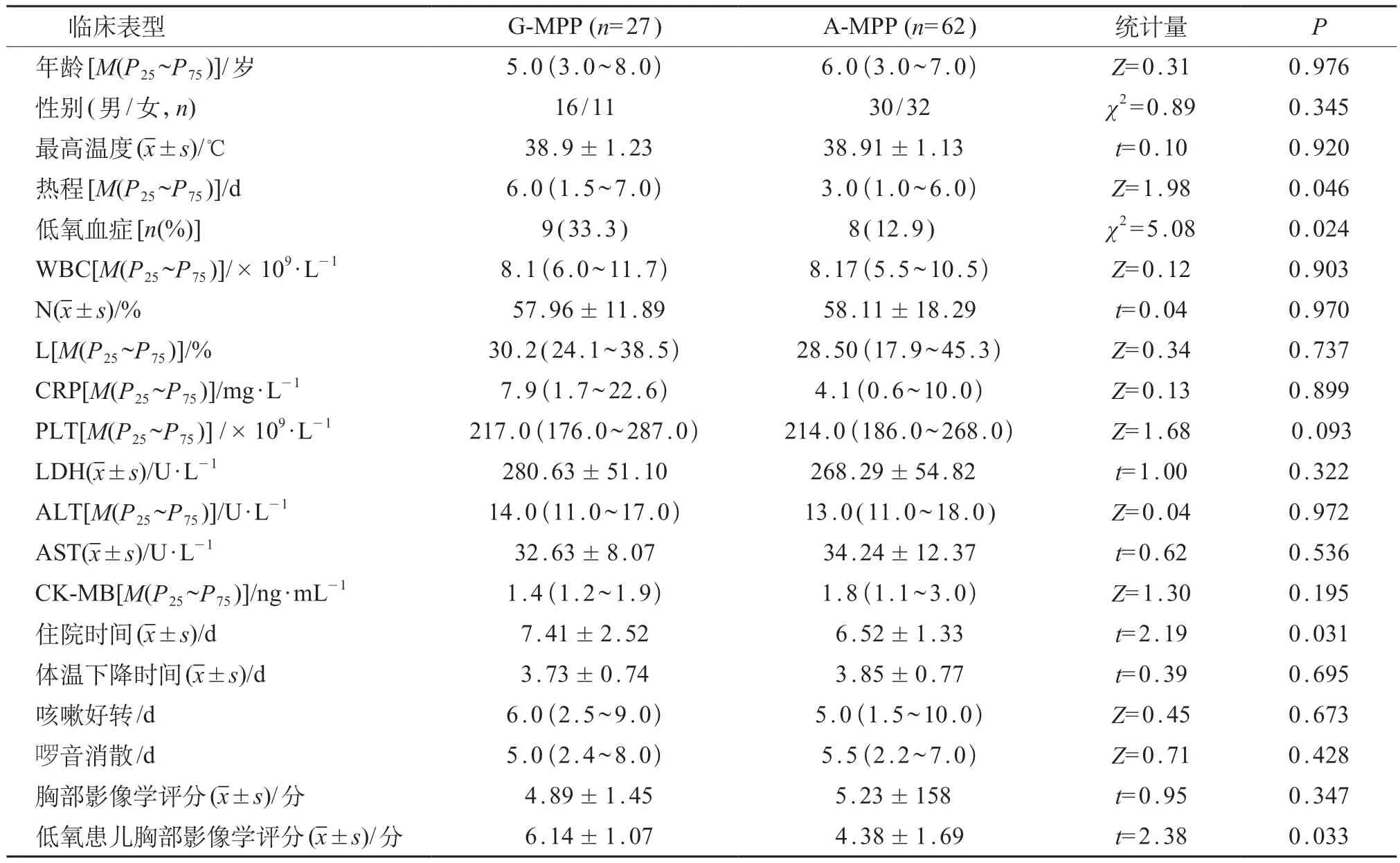
表2 G-MPP组与A-MPP组临床表型比较
综上所述,本研究表明G-MPP 患儿热程长,住院时间增加,低氧血症的发生率高,伴有低氧血症的G-MPP 患儿胸部影像学评分显著高于A-MPP 患儿。但由于本研究例数有限,胸部X 线平片敏感性较低,故尚不能仅依据胸部影像学评分诊断是否发生耐药MP感染,应全面综合考虑临床表型与影像学检查,为临床诊疗提供帮助。

