基于4种皂苷的定量分析评价干燥方式对菊叶薯蓣有效成分的影响
马境谦,崔乃菠,余河水,3,李正,,3,刘二伟,别松涛,3*(.天津中医药大学 中药制药工程学院,天津 3067;.组分中药国家重点实验室,天津 3067;3.中药制药工程市级实验教学示范中心,天津 3067)
干燥是中药材产地加工的重要环节,通过干燥处理可有效防止中药霉变、虫蛀、变色等现象的产生,方便药材运输及储藏。历史文献中记载了大量的传统干燥方式[1-2],其中晒干法和阴干法因成本低、操作简单而广泛应用于白芷、红参、黄芩等药材的干燥[3-5]。随着中药工业化规模生产,热风干制逐渐受到人们的关注,因其不受天气因素制约及干燥时间、温度可控等优点,被广泛应用于山药、大枣、柴胡、三七、山豆根、五味子等中药材的干燥[6-8]。
菊叶薯蓣(Dioscorea compositaHemsl.)是薯蓣科薯蓣属多年生缠绕性草本植物[9],原产于墨西哥,因用于提取甾体激素药物起始原料皂素而闻名[10]。菊叶薯蓣的有效成分为根茎中存在的呋甾型与螺甾型甾体皂苷[11-12],具有祛痰截疟、化湿利水、解毒消肿等功能,被用于风湿麻木、糖尿病、骨质疏松、肥胖和高尿酸血症的治疗[13];同时在现代医学研究中,菊叶薯蓣的抗炎、抗过敏、抗菌等药用作用被不断开发[14]。3年生菊叶薯蓣根茎的鲜品,单株重约15 kg,富含水分和淀粉,采挖后不宜储藏和运输,由于种植规模及产能的逐渐扩大,产地干制工序成为菊叶薯蓣产地加工的关键步骤。当前,工业上多采用将采收后菊叶薯蓣根茎的鲜品去除外部泥沙、切厚片,经传统干燥获得干片的方式进行产地干燥。中药材干燥的过程与其药性的形成密切相关[15],目前干燥方式对菊叶薯蓣皂苷类有效成分的影响未见报道。
本研究选用云南省会泽县3年生菊叶薯蓣根茎鲜品作为实验材料,采用阴干法、晒干法、60 ℃热风干制的方式,以原薯蓣皂苷、伪原薯蓣皂苷、重楼皂苷Ⅱ、薯蓣皂苷作为评价指标,采用HPLC-ELSD 的方法测定其含量变化,筛选出适宜的产地干制方式,旨在为菊叶薯蓣的产地加工及质量控制提供参考。
1 材料
1.1 仪器
Waters e2695HPLC 色谱系统(四元泵、真空在线脱气机、自动进样器、柱温箱和Empower 色谱工作站)、2424 蒸发光散射检测器(Waters);SB-5200DTD 型数控超声波清洗机(宁波新芝生物科技股份有限公司);AB135-S 电子分析天平(瑞典 Mettler Toledo 公司);中草药粉碎机(天津市泰斯仪器有限公司);全自动新型鼓风干燥箱(上海智城分析仪器制造有限公司);Milli-Q超纯水处理系统(美国 Millipore 公司)。
1.2 试药
原薯蓣皂苷对照品(批号:P13A9F58572,纯度≥98%)、伪原薯蓣皂苷对照品(批号:S07M6L1,纯度≥97%)、重楼皂苷Ⅱ 对照品(批号:P11A11F73858,纯度≥ 98%)、薯蓣皂苷对照品(批号:Y20A10Z95575,纯度≥98%)(上海源叶生物科技有限公司);乙腈(色谱纯,美国Fisher 公司);无水乙醇(色谱纯,天津风船化学试剂科技有限公司);实验用水为超纯水。菊叶薯蓣药材,采自云南省会泽县,采收时间为2020年4月份,经天津中医药大学中药鉴定教研室张丽娟、宋新波教授鉴定为薯蓣科植物Dioscorea compositaHemsl.的根茎鲜品。
2 方法与结果
2.1 不同干燥方式下菊叶薯蓣样品的制备
新鲜的菊叶薯蓣样品,清水冲洗,洗净外部泥沙,切厚度为2 ~4 mm 厚片,将菊叶薯蓣片随机分成4 组,每组约1000 g,按对应的方式处理,计算干燥样品折干率。
第一组为阴干法干制薯蓣,将菊叶薯蓣厚片均匀摊开于筛网中,置于室内、阴凉、避光、通风处,干燥168 h。
第二组为鲜品薯蓣,切制厚片,不做任何干燥处理。
第三组为晒干法干制薯蓣,将菊叶薯蓣厚片均匀摊开于筛网中,置于室外日光下或光线佳处晾晒,夜间收回,干燥144 h。
第四组为热风干制薯蓣,采用热风干燥的方法制备,60℃,风速0.15 m·s-1,干燥48 h。
2.2 菊叶薯蓣中水分、灰分及浸出物测定
菊叶薯蓣中水分的测定参照2020年版《中国药典》通则0832 项下的烘干法,菊叶薯蓣中灰分的测定参照2020年版《中国药典》通则2302 项下的总灰分测定法,菊叶薯蓣中浸出物的测定参照2020年版《中国药典》通则2201 项下的水溶性浸出物冷浸法,结果见表1。
2.3 溶液的制备

表1 不同干燥方式干燥菊叶薯蓣的水分、总灰分、浸出物、干燥时间、折干率Tab 1 Moisture,ash,extract,drying time and drying rate of Dioscorea composita Hemsl.dried by different drying methods
2.3.1 对照品溶液的制备 精密称取各对照品适量,加70%乙醇定容至10 mL 量瓶中,分别制成含原薯蓣皂苷1.028 mg·mL-1、伪原薯蓣皂苷1.023 mg·mL-1、重楼皂苷Ⅱ1.026 mg·mL-1、薯蓣皂苷1.024 mg·mL-1的对照品溶液。
2.3.2 供试品溶液的制备 取适量菊叶薯蓣干片粉碎,过40 目筛,精密称定菊叶薯蓣粉末0.67 g,置100 mL 具塞三角瓶中,加70%乙醇50 mL,密塞,精密称定,超声提取30 min(功率360 W,频率40 kHz),放冷后用70%乙醇补足重量,过0.22 μm 微孔滤膜,取续滤液作为供试品溶液,备用。
2.4 色谱条件
色谱柱为Symmetry C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-水(B),梯度洗脱(0 ~5 min,25% ~30%A;5 ~6 min,30% ~31%A;6 ~10 min,31%A;10 ~20 min,31% ~60%A;20 ~30 min,60% ~95%A;30 ~32 min,95%A;32 ~35 min,95%~25%A);体积流量为1.0 mL·min-1,进样量为10 μL,柱温为30 ℃,检测器为蒸发光散射检测器(漂移管温度70 ℃,气体流速2.8 L·min-1)。
2.5 方法学考察
2.5.1 线性关系考察 精密吸取适量“2.3.1”项下的各对照品溶液,加70%乙醇按照1、2、4、6、10、15 倍稀释获得系列梯度的混合对照品溶液。按“2.4”项下色谱条件进样测定,记录色谱峰面积,以对照品质量浓度的对数值为横坐标(X),以峰面积的对数值为纵坐标(Y),绘制标准曲线。得各成分校正曲线方程,结果见表2,4 种皂苷在各自线性范围内与峰面积线性关系良好。
2.5.2 检测限(LOD)与定量限(LOQ)考察取“2.3.1”项下各对照品溶液,用70%乙醇逐步稀释,按“2.4”项下色谱条件进样测定,以信噪比3∶1 和10∶1 分别计算4 种皂苷的检测限与定量限,结果见表2。
2.5.3 精密度试验 取混合对照品溶液(临用新配),按“2.4”项下色谱条件重复进样6 次,记录各成分峰面积值,计算原薯蓣皂苷、伪原薯蓣皂苷、重楼皂苷Ⅱ、薯蓣皂苷峰面积的RSD值分别为2.2%、3.2%、3.7%、3.3%,表明仪器精密度良好。
2.5.4 重复性试验 取热风干制的菊叶薯蓣干燥样品,按“2.3.2”项下方法制备6 份供试品溶液,按“2.4”项下色谱条件测定,测得原薯蓣皂苷、伪原薯蓣皂苷、重楼皂苷Ⅱ、薯蓣皂苷含量RSD分别为1.7%、2.0%、2.4%、2.3%,结果表明方法重复性良好。
2.5.5 稳定性试验 取热风干制的菊叶薯蓣干燥样品,按“2.3.2”项下方法制备供试品溶液,按“2.4”项下色谱条件分别于 0、2、4、6、10、12 h进样测定,测得原薯蓣皂苷、伪原薯蓣皂苷、重楼皂苷Ⅱ、薯蓣皂苷的峰面积RSD值分别为4.4%、2.1%、4.1%、2.3%,表明供试品溶液在制备后12 h内稳定。
2.5.6 加样回收试验 精密称取已知含量的热风干制的菊叶薯蓣干燥样品6 份,分别准确加入4种对照品适量,按“2.3.2”项下方法制备供试品溶液,计算原薯蓣皂苷、伪原薯蓣皂苷、重楼皂苷Ⅱ、薯蓣皂苷平均加样回收率分别为98.3%、97.9%、98.7%、98.2%,RSD(n=6)分别为2.0%、2.1%、2.3%、2.8%。
2.6 含量测定
取“2.1”项下菊叶薯蓣样品,每组各3 份,按照“2.3.2”项下方法制备供试品溶液,按照“2.4”项下色谱条件进行测定。各供试品(按干品计算)色谱图见图1,原薯蓣皂苷、伪原薯蓣皂苷、重楼皂苷Ⅱ、薯蓣皂苷的含量见表3。

图1 菊叶薯蓣鲜品及各干制品的HPLC 图Fig 1 HPLC chromatogram of Dioscorea composita Hemsl.fresh and dried by different methods
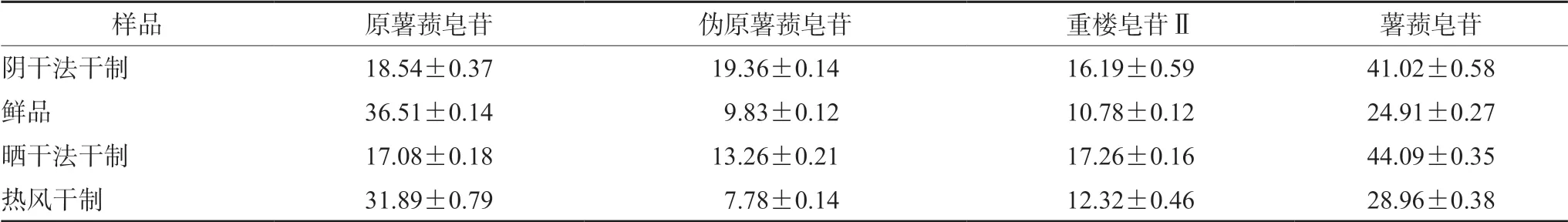
表3 菊叶薯蓣鲜品及各干制品中4 种皂苷的含量(n =3,mg·g-1)Tab 3 Contents of 4 saponins in Dioscorea composita Hemsl.fresh and dried by different methods (n =3,mg·g-1)
与菊叶薯蓣鲜品相比,阴干法、晒干法干制4 种皂苷的含量变化较大,其中原薯蓣皂苷降低、伪原薯蓣皂苷、重楼皂苷Ⅱ、薯蓣皂苷含量升高;60 ℃热风干制的菊叶薯蓣样品与鲜品相比,4 种皂苷的含量差异最小。
3 讨论
3.1 HPLC-ELSD 法定量分析菊叶薯蓣中4 种皂苷的含量
菊叶薯蓣中的皂苷类成分发色基团较少,在紫外低波长200 ~210 nm 处有末端吸收,容易受溶剂等因素影响,基线不稳定且检测困难,影响含量测定的准确性;而在200 ~210 nm 以外波长区域测定皂苷组分时,部分皂苷组分重叠,限制了UV检测器的使用[16]。由于菊叶薯蓣中皂苷类成分组成复杂且结构相差不大,极性仅有细微的不同,采用单一溶剂的流动相实现良好分离效果的可能性很小,因此示差检测器(RI)检测器很少用于皂苷类的分析。虽然理论上柱前衍生可以弥补UV 和RI检测器的不足,但由于皂苷的立体结构及功能性基团羟基取代率的不同使部分皂苷不易衍生化,而且某些皂苷可能生成多个衍生物而进一步增加对皂苷类成分定量分析的复杂性[17-18]。ELSD 是一种非质量选择性检测器,其检测效果不受样品分子中官能团影响,对各种物质均有响应,溶剂在漂移管中的蒸发消除了溶剂峰对基线的干扰,波动小[19]。目前,ELSD 已广泛应用于皂苷类、糖类、内酯类及部分生物碱等成分的检测[20-22]。本文采用HPLCELSD 定量分析菊叶薯蓣4 种皂苷的含量,蒸发光信号响应良好,4 种指标成分分离度高,峰形佳且相互无干扰,从而克服UV 检测器末端吸收性差、基线不平稳等因素的干扰。
3.2 干燥对菊叶薯蓣水分、灰分、浸出物及折干率的影响
不同干燥方式干燥菊叶薯蓣的折干率在28.13%~32.08%,其中,60℃热风干燥仅需要48 h,而阴干法需要168 h,晒干需要144 h。采用不同干燥方式干燥菊叶薯蓣样品(参照薯蓣科植物薯蓣(Dioscorea compositaThunb.),依据2020年版《中国药典》对水分、灰分和浸出物进行规定[23]:其中水分在9.03%~10.98%,均小于16%,符合药典规定;灰分在3.51%~3.68%,均小于4%,符合药典规定;浸出物含量在18.24%~21.70%,高于药典要求的不小于7%。通过上述各干燥样品的外在指标分析,3 种干燥方式在水分、灰分、浸出物及折干率上没有明显的差别,从干燥时间及环境可控的角度,热风干燥更加适合于菊叶薯蓣规模化产地加工。
3.3 干燥对菊叶薯蓣有效成分保留方面的影响
不同干燥方式所获得的干品及鲜品定量分析结果表明,菊叶薯蓣中4 种皂苷的含量因为干燥方式的不同存在差异,该结果与文献[24]阐明的“干燥是中药材加工的关键技术,干燥的过程也是中药材药性形成的过程”的研究结论相吻合。从有效成分保留方面来看,60℃热风干制更适合于菊叶薯蓣的产地加工。阴干法干制和晒干法干制导致菊叶薯蓣皂苷成分显著变化的原因,可能在于这两种干制的方式时间长、条件温和,非常适宜菊叶薯蓣本身的苷酶及外界微生物(曲霉、酵母等)发挥酶解或微生物转化作用,从而导致原薯蓣皂苷等原生皂苷含量降低,而薯蓣皂苷等次生皂苷的含量升高[25]。60℃热风干制4 种皂苷类成分变化不大,可能是采用加热处理能够“杀酶保苷”,避免有效成分水解[26]。
文章采用HPLC-ELSD 法同时定量测定菊叶薯蓣中4 种皂苷,方法简便、快捷、准确、重现性好,可用于菊叶薯蓣及其他含皂苷类药材的质量控制;研究基本阐明了3 种干燥方式对菊叶薯蓣中4 种皂苷含量的影响,可为菊叶薯蓣的产地干燥加工及质量控制提供参考。

