基于串联质谱标签定量蛋白质组学技术的芍甘附子汤治疗类风湿关节炎作用机制研究
董琳琳,石璐,苗丰,丰晨然,靖卫霞,贾占红,赵一颖,孙文燕*(.北京中医药大学中药学院,北京 0488;.北京中医药大学第三附属医院,北京 0009)
类风湿关节炎(rheumatoid arthritis,RA)是一种全身性自身免疫性疾病,患病人群多为中老年人,且女性患病率高于男性。临床表现为关节肿胀、骨质破坏,严重者可致关节畸形,还可累及全身多个器官。该病病因及发病机制尚未完全明确,目前尚无根治药物。
芍甘附子汤出自《伤寒论》,全方由白芍、附子、甘草组成,临床治疗RA 有确切疗效[1]。本课题组前期研究结果表明,芍甘附子汤对牛Ⅱ型胶原(C Ⅱ)诱导的关节炎(CIA)大鼠有明确的治疗作用,可显著改善大鼠关节肿胀,减轻关节病理损伤,但作用机制尚不明确。蛋白质组学技术是近年来新兴的一种实验方法。串联质谱标签(tandem mass tag,TMT)是利用化学标签通过串联质谱对不同样品中的蛋白同时进行鉴定和定量的研究方法,已广泛应用于蛋白质组学研究[2-3]。本研究通过建立CIA 大鼠模型,以足跖肿胀度及关节炎指数评分评价芍甘附子汤的药效,采用TMT 定量蛋白质组学技术检测芍甘附子汤对CIA大鼠滑膜组织蛋白表达的影响,进一步应用生物信息学手段对差异蛋白质进行分析,初步探究芍甘附子汤防治RA 的作用机制。
1 材料
1.1 动物
SPF 级Wistar 大 鼠,雄 性,体 质 量170 ~190 g[北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006]。
1.2 试药
芍甘附子汤(黑顺片3 g、白芍9 g、甘草9 g)配方颗粒(北京中医药大学东方医院,由北京康仁堂药业制成,以确保药品质量),给药时以生理盐水充分溶解,按照人日用量换算大鼠的等效剂量为2.1 g(生药)·kg-1。
牛Ⅱ型胶原(Chondrex 公司,批号:190306),不完全弗氏佐剂(IFA,Sigma 公司,批号:SLBZ0619),A955-4 质谱级乙腈(Fisher 公司),尿素、Tris(AMRESCO 公司),氨水(Sigma-Aldrich公司,批号:318612),二硫苏糖醇(AMRESCO 公司,批号:M109-25G),碘乙酰胺(Bio-Rad 公司,批号:163-2109),甲酸(Sigma-Aldrich 公司,批号:A117-50),考马斯亮蓝R-250(Thermo Fisher Scientific 公司),V5111 质谱级胰蛋白酶(Promega公司),去离子水(Milipore 公司),蛋白Marker(Thermo Fisher Scientific 公司,批号:26616),无水乙醇(北京化工厂),硫脲(Sigma-Aldrich),TMT试剂(Thermo Fisher Scientific 公司,批号:90110),CHAPS(AMRESCO 公司),Protease Inhibitor Cocktail(Roche 公司,批号:11836170001)。
1.3 仪器
YLS-7B 型足跖容积测量仪(济南益延科技发展有限公司),分析天平(赛多利斯仪器系统有限公司),可调量程移液器(德国Eppendorf 公司),pH计(瑞士Mettler Toledo 公司),MultiskanGO1510酶标仪、超低温冰箱、超速离心机(美国Thermo Fisher Scientific 公司),制冰机(日本Sanyo 公司),涡旋振荡器(海门市其林贝尔仪器制造有限公司),金属浴(英国Stuart 公司),电泳槽(美国Bio-Rad公司),Powerpac1000 电泳仪、脱色摇床(北京新技术应用研究所),恒温水浴锅(上海浦东荣丰科学仪器有限公司),RIGOLL-3000 高效液相色谱(北京普源精电科技有限公司),Orbitrap Fusion Lumos 质谱仪、SAVANT 系列真空干燥仪(美国Thermo 公司)。
2 方法与结果
2.1 动物分组、造模与给药[4]
动物适应性饲养一周后,将2.0 g·L-1的CⅡ醋酸溶液与IFA 等体积混匀,在冰浴条件下充分乳化,并于实验第1日(d 1)(初次免疫0.2 mL/只)及第7日(d 7)(加强免疫0.1 mL/只)进行尾根部多点皮内注射,正常组给予同等剂量的生理盐水。实验第21日(d 21),将造模成功即关节炎指数(arthritis index,AI)评分≥2 的大鼠按照分层随机分配法分成模型组与芍甘附子汤组[2.1 g(生药)/(kg·d)],并设置正常组,每组16 只。实验第21日(d 21)开始给药干预,正常组和模型组均给予生理盐水灌胃,治疗组则给予2.1 g(生药)·kg-1芍甘附子汤配方颗粒灌胃,每日1 次,连续4 周。
2.2 足跖肿胀度测定及AI 评分
于实验前(d 0)、d 7、d 14、d 21、d 28、d 35、d 42、d 49 采用足跖容积测量仪测定,足跖肿胀度计算公式为:肿胀度=致炎后足跖体积-致炎前足跖体积。于实验d 14、d 21、d 28、d 35、d 42、d 49 对模型组和芍甘附子汤组大鼠进行AI 评分[5]。评分标准为无关节红肿,0 分;足小趾关节红肿,1分;趾关节及足跖关节肿胀,2 分;踝关节以下足爪肿胀,3 分;包括踝关节在内的全部足爪肿胀,4分。
2.3 TMT 定量蛋白质组学分析
2.3.1 蛋白提取 于d 49 取各组大鼠膝关节滑膜组织,每组随机选取3 只。将研磨使用的物品用液氮预冷,样本研磨成粉,按照1∶10(W/V)加入裂解液(7 mol·L-1尿素,1%蛋白酶抑制剂),涡旋混匀。样本管中加入钢珠,置于组织研磨仪中匀浆,冰上静置30 min。13 000 r·min-1,4℃离心15 min,吸取上清液,分装后冻存于-80℃冰箱。Bradford 法测定蛋白浓度。
2.3.2 蛋白酶解 每个样品分别取等量蛋白加入终浓度为25 mmol·L-1的二硫苏糖醇,涡旋混匀,37 ℃水浴1 h,取出放至室温。加入终浓度为50 mmol·L-1的碘乙酰胺,涡旋混匀,避光室温放置30 min。加入0.2 mol·L-1的三乙基碳酸氢铵300 μL,12 000 r·min-1离心10 min,弃掉收集管底部溶液,重复3 次,再加入0.5 mol·L-1的三乙基碳酸氢铵300 μL,12 000 r·min-1离心10 min。按照胰蛋白酶与蛋白1∶50 的比例,加入胰蛋白酶50 μL,37℃反应过夜。次日,加入0.2 mol·L-1的三乙基碳酸氢铵100 μL,12 000 r·min-1离心10 min,重复3 次,酶解消化后的肽段溶液离心于收集管底部。
2.3.3 TMT 标记及除盐 从冰箱中取出TMT 试剂,平衡到室温,将TMT 试剂离心至管底。每管加入41 μL 无水乙腈,涡旋振荡至完全溶解,离心至管底。加入100 μL 的100 mmol·L-1三乙基碳酸氢铵复溶样本(25 ~100 μg 蛋白),涡旋振荡,离心至管底。将41 μL TMT 试剂按顺序加入样品中,涡旋振荡,离心至管底,室温反应1 h。标记样品加入8 μL 5%羟胺,室温孵育15 min 终止标记反应。HLB固相萃取柱除盐,置于-80℃冰箱保存备用。
2.3.4 离线高pH 反相高效液相色谱分离 将TMT 的多肽样品重溶于A 液(98% ddH2O,2%乙腈,氨水调pH 至10.0)中。经离线XBridge®peptide BEH C18高效液相色谱柱(130Å,3.5 μm,4.6 mm×150 mm)分离,洗脱缓冲液B 液为98.0%乙腈,2.0%去离子水(pH 10.0)。每隔1 min 收集一管组分,共收集40 管,按顺序将样品合并为10 管组分。将收集的组分置于旋转真空干燥仪中真空干燥,-20℃冻存备用。
2.3.5 LC-MS/MS 分析 使用Orbitrap Fusion Lumos质谱仪分析鉴定多肽混合物。使用高灵敏度模式,参数设置:每个全扫描为高速信号依赖扫描,扫描75 min。一级全扫描分辨度12 000,扫描范围为350 ~1550m/z,AGC5e5,最大注射时间为50 ms,碰撞能量为35%,二级扫描分辨度15 000,电荷状态筛选(包含+2 至+6 电荷的前体),动态消除30 s,AGC5e4,最大注射时间为22 ms。
2.3.6 数据分析 所得质谱数据经过Mascot(version 2.5.1)检索,Scaffold Q +(version 4.6.2)软件进行蛋白定量定性分析,运用UNIPROT_Rat_29954_20181130.fasta(序列总数:29954)(https://www.uniprot.org/)数据库对蛋白进行初步分类。对蛋白定量数据进行成对t检验,筛选P≤0.05 的蛋白质,为显著差异蛋白质。利用Omics Box 软件(版本:1.2.4)对差异蛋白质进行GO(http://geneontology.org/)功能注释分析,并利用KEGG(https://www.kegg.jp/)富集分析可能的通路。
2.4 统计方法
足跖肿胀度及AI 评分均采用SAS 9.2 统计软件进行分析。实验数据为连续变量以±s表示,使用方差分析或非参数检验,P<0.05 为差异有统计学意义。
2.5 结果
2.5.1 芍甘附子汤对CIA 大鼠足跖肿胀度的影响 自初次免疫后d 14 ~d 49,模型组大鼠相对于正常组左后足明显肿胀(P<0.01)。芍甘附子汤组与模型组比较,左后足跖肿胀度自初次免疫后d 35 ~d 49 明显下降(P<0.05,P<0.01),见表1。初次免疫后d 14 ~d 49,模型组大鼠相对于正常组右后足跖肿胀度升高(P<0.01)。芍甘附子汤组与模型组比较,自初次免疫后d 35 ~d 49,右后足跖肿胀度明显减轻(P<0.01)(见图1 及表2)。
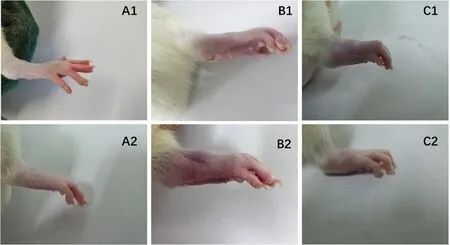
图1 各组大鼠后足肿胀情况Fig 1 Swelling of the hind foot of rats in each group A.正常组(normal group);B.模型组(model group);C.芍甘附子汤组(Shaogan Fuzi decoction group);1.给药前(before the administration);2.给药后(after the administration)
表1 芍甘附子汤对CIA 大鼠左后足跖肿胀度的影响(±s,n =16)Tab 1 Effect of Shaogan Fuzi decoction on the swelling of the left hind foot of CIA rats (±s,n =16)

表1 芍甘附子汤对CIA 大鼠左后足跖肿胀度的影响(±s,n =16)Tab 1 Effect of Shaogan Fuzi decoction on the swelling of the left hind foot of CIA rats (±s,n =16)
注:与正常组比较,**P <0.01;与模型组比较,△P <0.05,△△P <0.01。Note:Compared with the normal group,**P <0.01;compared with the model group,△P <0.05,△△P <0.01.
组别 左后足跖肿胀度/mL d 7 d 14 d 21 d 28 d 35 d 42 d 49正常组 0.11±0.07 0.21±0.12 0.24±0.13 0.30±0.14 0.36±0.11 0.43±0.13 0.42±0.12模型组 0.10±0.09 0.66±0.35** 1.16±0.55** 1.44±0.61** 1.30±0.48** 1.31±0.49** 1.25±0.59**芍甘附子汤组 0.09±0.10 0.65±0.50 1.11±0.43 1.34±0.44 0.93±0.48△ 0.88±0.55△△ 0.82±0.42△
表2 芍甘附子汤对CIA 大鼠右后足跖肿胀度的影响(±s,n =16)Tab 2 Effect of Shaogan Fuzi decoction on the swelling of the right hind foot of CIA rats (±s,n =16)
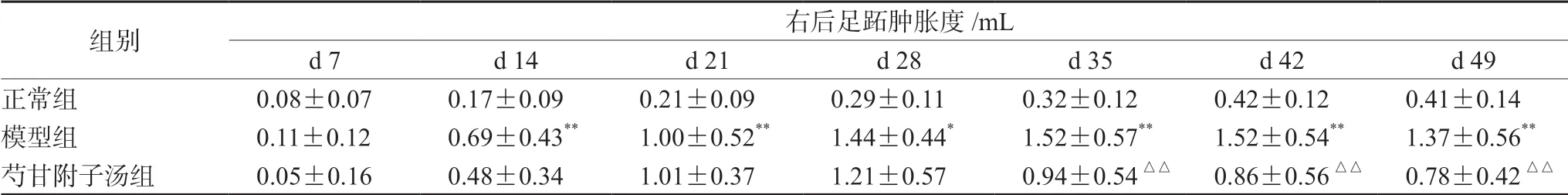
表2 芍甘附子汤对CIA 大鼠右后足跖肿胀度的影响(±s,n =16)Tab 2 Effect of Shaogan Fuzi decoction on the swelling of the right hind foot of CIA rats (±s,n =16)
注:与正常组比较,*P <0.05,**P <0.01;与模型组比较,△△P <0.01。Note:Compared with the normal group,*P <0.05,**P <0.01;compared with the model group,△△P <0.01.
组别 右后足跖肿胀度/mL d 7 d 14 d 21 d 28 d 35 d 42 d 49正常组 0.08±0.07 0.17±0.09 0.21±0.09 0.29±0.11 0.32±0.12 0.42±0.12 0.41±0.14模型组 0.11±0.12 0.69±0.43** 1.00±0.52** 1.44±0.44* 1.52±0.57** 1.52±0.54** 1.37±0.56**芍甘附子汤组 0.05±0.16 0.48±0.34 1.01±0.37 1.21±0.57 0.94±0.54△△ 0.86±0.56△△ 0.78±0.42△△
2.5.2 芍甘附子汤对CIA 大鼠AI 评分的影响 正常组AI 评分为0 分,芍甘附子汤组自初次免疫d 28 ~d 49,AI 评分较模型组明显下降(P<0.05),见表3。
表3 芍甘附子汤对CIA 大鼠AI 评分的影响(±s,n =16)Tab 3 Effect of Shaogan Fuzi decoction on the AI score of CIA rats (±s,n =16)

表3 芍甘附子汤对CIA 大鼠AI 评分的影响(±s,n =16)Tab 3 Effect of Shaogan Fuzi decoction on the AI score of CIA rats (±s,n =16)
注:与模型组比较,△P <0.05。Note:Compared with the model group,△P <0.05.
组别 AI 评分/分d 14 d 21 d 28 d 35 d 42 d 49模型组 4.38±1.89 5.53±1.78 7.72±1.37 6.00±2.71 5.56±2.45 5.81±2.45芍甘附子汤组 5.38±1.59 6.00±3.01△ 3.81±1.91△ 3.47±2.05△ 3.94±2.05△ 3.94±2.05△
2.5.3 蛋白质组学差异蛋白质鉴定结果 以Ratio >1.2 或Ratio <0.833 且P<0.05 为筛选条件,模型组与正常组相比较,共鉴定出85 个差异蛋白质;芍甘附子汤组与模型组相比较,共鉴定出49 个差异蛋白质(见表4 及5)。
2.5.4 GO 富集分析结果 GO 富集分析包括对芍甘附子汤组与模型组差异蛋白质的分子功能(molecular function,MF)、生物学过程(biological Process,BP)和细胞组分(cellular component,CC)的分析。图2 为MF、BP、CC 三类富集分析差异显著性前10 的条目。其中,MF 共涉及45 个功能,主要包括O-酰基转移酶活性、碳水化合物结合、β淀粉样蛋白结合、L-抗坏血酸结合、AU 碱基富集结合、3'-UTR 和AU 碱基富集结合、泛素结合酶活性、2-氧代戊二酸依赖性双加氧酶活性、泛素样蛋白结合酶活性、脱氧核糖核苷酸结合等(见表6);BP 涉及到104 个生物过程,主要有RNA 剪接的负调控、通过剪接体对mRNA 剪接的负调控、肽赖氨酸羟化、mRNA 加工的负调控、干细胞分裂、有丝分裂细胞周期相变的负调控、通过剪接体调控mRNA 剪接、细胞周期相变的负调控、RNA 剪接的调控等(见表7);CC 涉及到富含四跨素的微结构域、纺锤体基质、NatC 复合体、Rb-E2F 复合物、突触前膜的锚固成分、突触后膜的锚固成分、突触膜的锚固成分、AMPA 谷氨酸受体复合物、补体成分C1 复合物、BRCA1-A 复合物等(见表8)。

表4 模型组与正常组的差异蛋白质(n =3)Tab 4 Differential protein between model group and normal group (n =3)
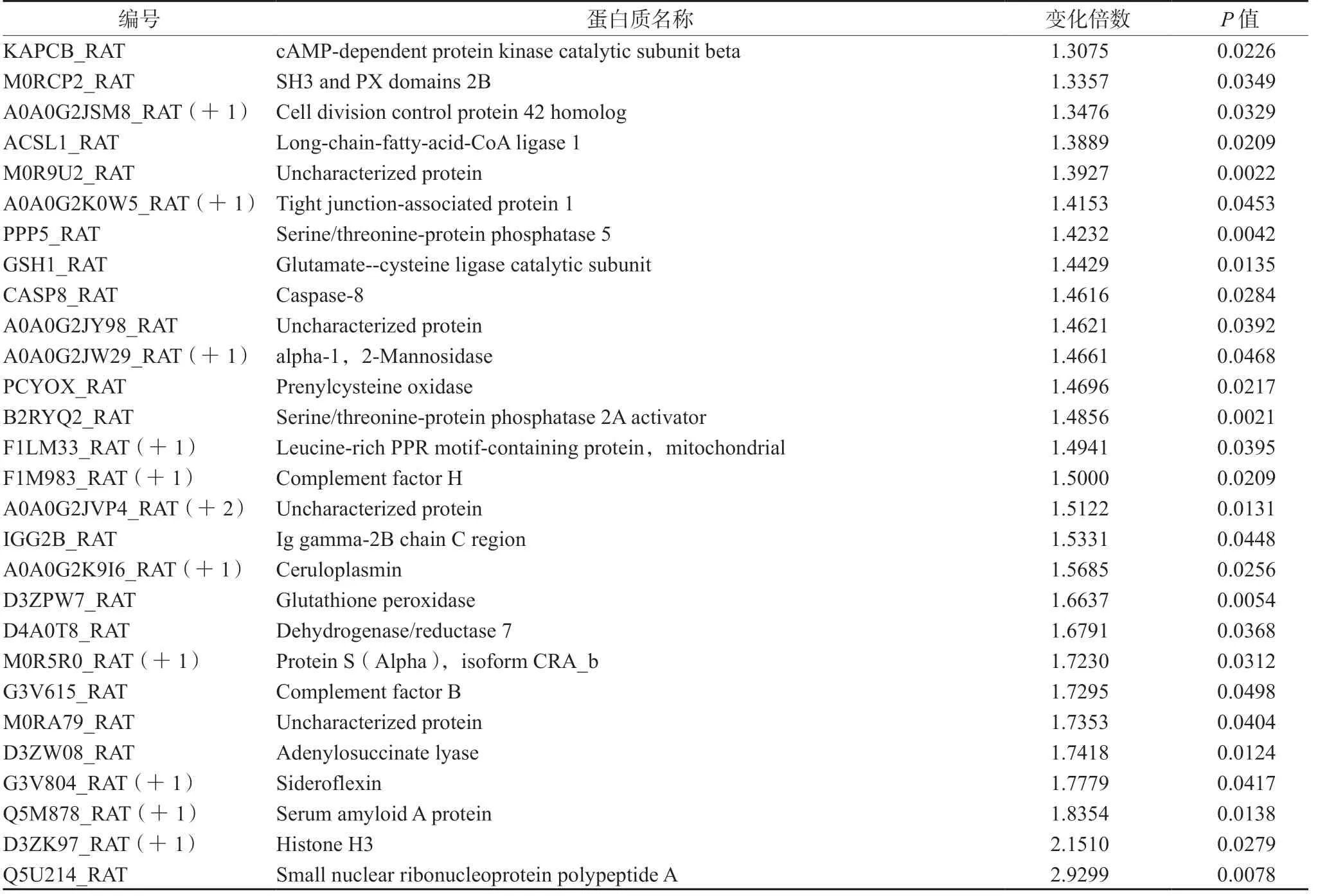
续表4
2.5.5 KEGG 通路富集结果 芍甘附子汤组与模型组差异蛋白质的KEGG 通路富集分析涉及到剪接体、细胞衰老、人类免疫缺陷病毒1 感染、赖氨酸降解、RNA 降解、百日咳、FcγR 介导的吞噬作用、病毒性心肌炎、TGF-β信号通路、细胞周期、Apelin 信号通路等18 条相关通路,其中与RA 相关的有TGF-β信号通路、Apelin 信号通路等(见图3 及表9)。
3 讨论
RA 具有慢性、进行性、侵蚀性和破坏性的特点,致残率高,对工作及生活影响极大。CIA模型是公认的RA 模型,其关节肿胀、炎性细胞浸润、关节滑膜增生、血管翳形成、关节软骨组织病变等临床特征与RA 患者相似。并且CIA 模型的发生依赖于T、B 细胞的激活增殖,其发病机制也与RA 患者相似[6]。本研究选用Wistar 大鼠,采用CⅡ与IFA 尾根部皮内注射法复制CIA模型,注射后动物出现关节红肿、活动受限等关节炎表现,表明模型复制成功。
芍甘附子汤中白芍具有养血敛阴、柔肝止痛功效。甘草作为补益药,具有调和诸药、缓急止痛功效;附子性味辛、甘,大热,具有散寒止痛功效;诸药共用可散寒祛湿、通络止痛[7]。药理研究表明,白芍有效成分白芍总苷具有明显的抗炎作用,对于RA 疗效确切,而芍药苷占白芍总苷的90%以上,多项动物实验证实其可显著降低RA 模型大鼠的关节肿胀[8]。甘草具有抗炎、调节免疫的作用[9-10]。附子具有增强免疫、镇痛、抗炎等作用[11]。本研究表明芍甘附子汤能显著降低CIA 大鼠的关节肿胀度及AI 评分,即对RA具有治疗作用,结果与文献报道一致[7]。
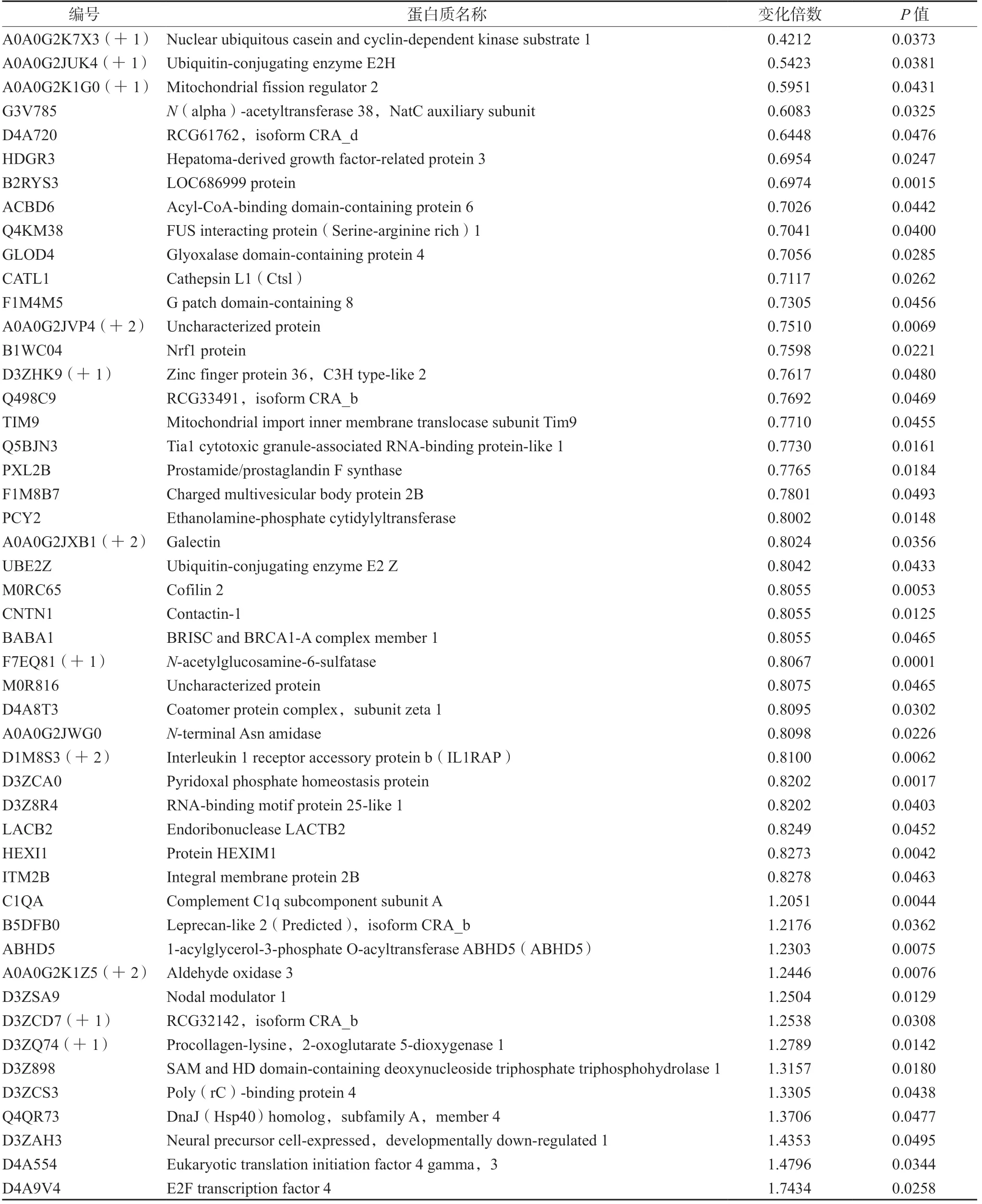
表5 芍甘附子汤组与模型组的差异蛋白质(n =3)Tab 5 Differential protein between Shaogan Fuzi decoction group and model group (n =3)

图2 生物信息学分析结果Fig 2 Bioinformatics analysis results

图3 KEGG 通路富集结果Fig 3 KEGG pathway enrichment results

表6 差异蛋白质的主要分子功能分析Tab 6 Analysis of the main molecular functions of differential proteins
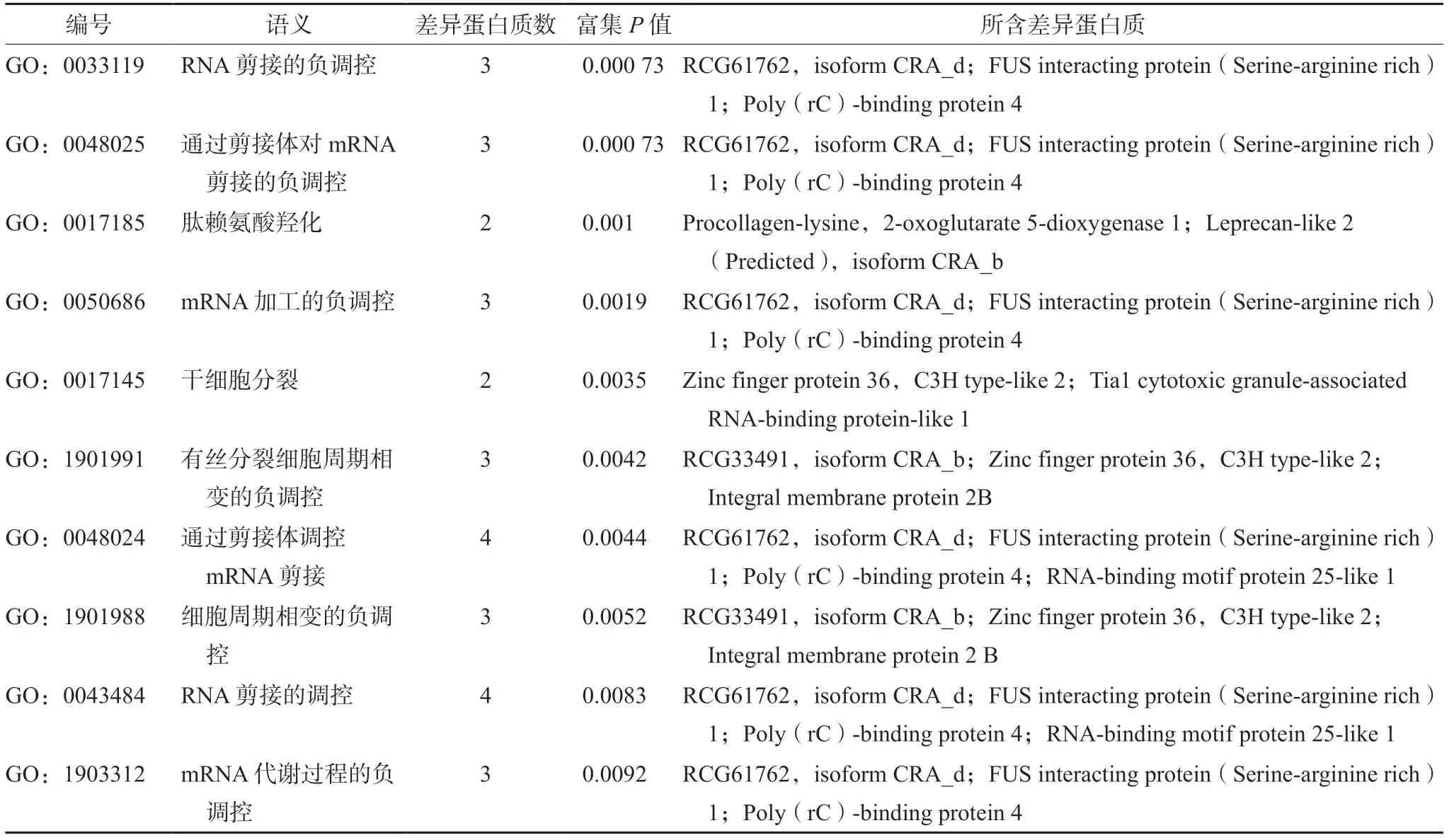
表7 差异蛋白质的主要生物过程分析Tab 7 Analysis of the main biological processes of differential proteins

表8 差异蛋白质的主要细胞组分分析Tab 8 Analysis of main cell components of differential proteins
中药复方通过多靶点、多成分治疗疾病,在整体层面上起效。蛋白质组学是对生物体内所有蛋白质的结构、功能、相互作用以及在体内的变化进行研究,进而对变化的蛋白质进行追踪,寻找潜在的生物标志物,提示疾病可能的发病机制,从而更好地为临床诊断及预后提供依据。蛋白质组学的研究手段与中药复方的作用特点不谋而合。因此,本研究采用蛋白质组学方法初步探究芍甘附子汤治疗RA 的作用机制。
蛋白质组学分析结果表明,与正常组相比,模型组IL1RAP、Cntn1、Copz1 等85 个蛋白表达出现显著性差异。与模型组相比,芍甘附子汤组有49 个蛋白质表达出现显著性差异。GO 富集分析表明这49 个差异蛋白质主要参与免疫及炎症调控等过程,大多分布于细胞质中,多具有结合及催化活性。KEGG 分析表明差异蛋白质主要涉及18 条信号通路,其中与RA 显著相关的为Apelin 信号通路以及TGF-β信号通路,提示芍甘附子汤可通过多种途径发挥治疗RA 的作用。

表9 差异蛋白质的主要KEGG 信号通路分析Tab 9 Analysis of the main KEGG signaling pathways of differential proteins
RA 作为一种免疫性疾病,多种免疫细胞及细胞因子的参与促进了其发生发展。而IL1RAP在RA 的发病过程中也发挥了重要作用。IL1RAP具有白细胞介素-1(IL-1)受体活性及白细胞介素-13(IL-13)受体活性,能够加速IL-1、IL-13等促炎因子的产生,增强炎症反应,还可激活IL-1β、NF-κB 和MAPK 信号通路[12-13],促进疾病的发展。本研究发现,模型组与正常组相比,IL1RAP 表达上调,而芍甘附子汤组IL1RAP 表达下调,提示芍甘附子汤可能通过下调IL1RAP表达,调节相应炎性细胞因子水平,缓解CIA 大鼠的关节肿胀情况。但是,芍甘附子汤是直接还是间接降低IL1RAP 的水平从而调控IL-1β信号通路,仍需进一步研究。
Ctsl 在多种疾病中都有重要作用,可通过调节T 细胞的转化改善炎症情况,还可促进关节软骨中基质的下调,从而促进疾病的发展[14-15]。多项研究表明Ctsl 与RA 相关,通过靶向抑制Ctsl的产生可有效降低RA 关节软骨侵蚀[16],Ctsl 缺失的AIA(antigen-induced arthritis)小鼠较野生型AIA 小鼠关节肿胀显著好转[17]。本研究中,芍甘附子汤干预组Ctsl 表达下调,提示芍甘附子汤可能通过抑制Ctsl 的产生而改善RA 的病变。
ABHD5 具有溶血磷脂酸酰基转移酶活性,可催化溶血磷脂酸(LPA)转化为磷脂酸(PA)[18]。LPA 不仅参与脂质代谢,还是一种重要的脂质信号分子,参与细胞分化、凋亡等过程。在RA 患者中,LPA 还可促进成纤维细胞的增殖,加重炎症反应,促进RA 的发展。研究表明,RA 患者滑液中LPA 含量明显升高。多项实验显示,LPA 可通过与G 蛋白偶联受体结合,介导p38/ERK-MAPK信号通路,参与RA 的发生发展[19-20]。本研究表明,芍甘附子汤可能通过上调ABHD5,增加LPA向PA 的转化过程,进而下调LPA 的含量,缓解CIA 大鼠炎症反应。
Apelin 信号通路与RA 相关,该通路中核呼吸因子(nuclear respiratory factor 1,Nrfl)的上游因子过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor-γcoactivator-1α,PGC-1α)为线粒体生物发生的关键因子。尚未有研究表明线粒体生物发生与RA的关系,但线粒体生物发生受到抑制会增加骨关节炎的代谢紊乱和炎症,而促进线粒体生物发生可以治疗关节疾病[21-22]。也有研究表明,白藜芦醇可通过转录调控减少炎症相关基因的表达,并推测Nrf1 和GA 结合蛋白α亚基(GABPA)作为下调基因与白藜芦醇减轻炎症有关。因此,需要进一步研究芍甘附子汤干预RA 作用与抑制Apelin 信号通路及下调Nrf1 表达的关系。
研究表明,RA 发作期间TGF-β信号通路被激活,TGF-β1、Smad2 和Smad3 的表达增加,抑制TGF-β信号通路可降低白细胞介素-6(IL-6)及肿瘤坏死因子α(TNF-α)的水平达到治疗RA 的目的[23]。E2F 转录因子4(E2f4)为Smad2 和Smad3的下游因子。本研究显示,经芍甘附子汤干预后,E2f4 的表达出现上调,其具体原因有待进一步分析。
综上,芍甘附子汤干预后,CIA 大鼠共有49个蛋白表达出现显著变化,其治疗RA 作用可能主要与下调IL1RAP、Ctsl,上调Abhd5 的表达有关,但尚需进行实验证实。

