血小板源性 miR-126 的功能基因多态性与急性冠状动脉综合征患者氯吡格雷抗血小板反应性及疗效的相关性
邹宇婷,王观筠,刘军,,3,王子乾,吴阳勋,孙志军,秦留安,尹彤*
(1解放军医学院,北京 100853;2解放军总医院第一医学中心心血管内科,北京 100853;3解放军总医院第二医学中心老年医学研究所, 北京 100853)
急性冠状动脉综合征(acute coronary syndrome,ACS)是严重危害人类健康的常见心血管疾病之一,尽管过去10年ACS的死亡率已大大降低,且冠心病的年死亡率下降了34.4%,但经历复发事件的患者死亡风险仍较高[1]。血小板P2Y12受体拮抗剂联合阿司匹林双联抗血小板治疗(dual antiplatelet therapy,DAPT)仍是目前公认的ACS标准治疗和预防经皮冠状动脉介入术(percutaneous coronary intervention,PCI)术后支架内血栓形成的金标准[2]。氯吡格雷作为一种P2Y12受体拮抗剂,可以单独使用或与阿司匹林联合使用以预防缺血性事件并改善ACS患者预后,并已在全球范围内广泛使用了10多年[3]。尽管氯吡格雷抗血小板治疗在许多患者中是安全有效的,但个体间的治疗反应存在很大差异[4]。研究证实,造成P2Y12受体拮抗剂抗血小板反应性的个体差异因素包括疾病状态,合并用药和药物剂量[5,6],以及药物基因组学因素(CYP2C19基因多态性)[7]。然而,已知的这些因素尚不足以解释血小板反应性的个体差异。
研究显示,血小板的活性受到许多微小核糖核酸(microribonucleic acid,miRNA)的影响,这些miRNA调控血小板内信使RNA(messenger ribonucleic acid, mRNA)的表达[8]。Kaudewitz等[9]研究发现,血浆中微小核糖核酸-126(microribonucleic acid-126,miR-126)与ACS患者的血小板功能及正常人群中血小板活化标记物具有相关性。我们前期研究发现,血小板源性miR-126能够预测氯吡格雷的抗血小板反应性[10]。功能分析证实,miR-126的功能单核苷酸多态性(single nucleotide polymorphism,SNP;dbSNP:rs4636297),能够阻断miR-126的加工成熟,从而抑制miR-126的表达[11]。因此,我们推测miR-126的功能SNPrs4636297可能影响氯吡格雷抗血小板反应性和疗效。鉴于此,本研究旨在分析miR-126的功能基因多态性rs4636297与ACS患者中氯吡格雷抗血小板反应性及疗效的相关性。
1 对象与方法
1.1 研究对象
连续募集2015年11月至2017年2月在解放军总医院心血管内科住院期间接受DAPT,同时在氯吡格雷治疗第3天进行血小板功能检测的ACS患者,对所有患者均进行血小板功能检测。入选标准:(1)年龄≥18岁;(2)按照美国心脏联合会/美国心脏病学会诊断标准[12]诊断为ACS的患者;(3)服用氯吡格雷及阿司匹林治疗;(4)自愿参加本次临床试验并签署知情同意书。排除标准:(1)应用影响血小板活性或功能的药物(如非甾体类抗炎药、阿片类药物等)的患者;(2)患有影响血小板功能或活性的疾病(如急、慢性炎症,肝、肾功能障碍,近期有出血倾向,潜在出血危险或血液系统疾病)的患者;(3)禁用抗血小板药物的患者。
ACS患者中氯吡格雷的治疗原则为:对于PCI或者急性心肌梗死(acute myocardial infarction,AMI)的患者,接受氯吡格雷联合阿司匹林双联抗血小板负荷剂量治疗(氯吡格雷600 mg/d和阿司匹林300 mg/d)后,进行稳定治疗剂量(氯吡格雷75 mg/d和阿司匹林100 mg/d)的治疗;对于非PCI或非AMI的患者,接受氯吡格雷联合阿司匹林的稳定剂量双联抗血小板治疗。本研究符合赫尔辛基宣言,并通过了解放军总医院医学伦理委员会的论证和批准。
1.2 血小板功能检测及分组方法
采集ACS患者3 ml外周全血, 通过血栓弹力图(thromboelastography,TEG)检测血小板反应性。TEG检测采用乐普科技有限公司的西芬斯TEG分析仪及配套试剂。根据二磷酸腺苷(adenosine diphosphate,ADP)诱导的血小板纤维蛋白凝块强度指标(ADP-induced platelet-fibrin clot strength,MAADP)和ADP诱导的血小板抑制率(ADP抑制率),进行抗血小板反应性呈极端值的病例筛选。
极端值的病例筛查分组标准:TEG MAADP>47 mm, ADP 抑制率<30%的患者入血小板反应性呈极端高反应性(high on-treatment platelet reactivity,HTPR)为HTPR组;TEG MAADP<31 mm, ADP 抑制率>90%的患者入血小板反应性呈极端低反应性(low on-treatment platelet reactivity,LTPR)为LTPR组。
1.3 全血DNA的SNP分型
采用全血基因组 DNA 提取系统(Solarbio, D1850)提取DNA,置于-20 ℃冰箱保存备用。采用SnapShot法[13]检测候选SNP位点,通过多重聚合酶链式反应(polymerase chain reaction, PCR)扩增,检测miR-126(rs4636297)、CYP2C19*2 (rs4244285)、CYP2C19*3(rs4986893)3个SNPs位点。检测位点的引物序列分别为:rs4636297上游5’ACACTTCAAACTCGTACCGTGAG3’,下游 5’CACGCTGAGGGAGGTCAA3’;rs4244285上游5’ GAGCTTGGCATATTGTATCTATACCTT3’,下游5’ CGATTCTTGGTGTTCTTTTACTTTCTC 3’; rs4986893上游5’ TCAGCAATTTCTTAACTTGATGGA 3’,下游5’ TTC-AGGGCTTGGTCAATATAGA 3’。测序采用美国ABI公司的3730XL基因测序仪、SnapShot试剂盒及配套试剂,PCR采用北京东胜创新生物科技有限公司的东胜龙黑金刚EDC-810 PCR仪及配套试剂。
1.4 缺血终点事件及随访
缺血终点事件包括心源性死亡、非致死性心肌梗死、非致死性脑卒中、紧急血运重建及支架内血栓形成。随访时间1年,由专人负责,详细记录患者主要缺血事件发生的症状,统一填写随访表格。上述随访均由专门经过培训的医师在门诊或经电话随访完成,缺血终点事件的判断由临床药物试验中心终点事件判断专家组确定。
1.5 统计学处理
2 结 果
2.1 患者临床基线资料及SNP分布
连续募集了1 134例符合入选标准的ACS患者。根据TEG检测筛查获得的HTPR组患者193例和LTPR组患者171例。入选患者中,男女比例为2.5∶1(男性 260例,女性104例),平均年龄(64.87±10.73)岁。2组患者总胆固醇和ACS分型的水平比较,差异有统计学意义(P<0.05);2组患者年龄、性别、体质量指数、血压、病史、合并用药及实验室检验等基线资料均无明显差异(表1)。
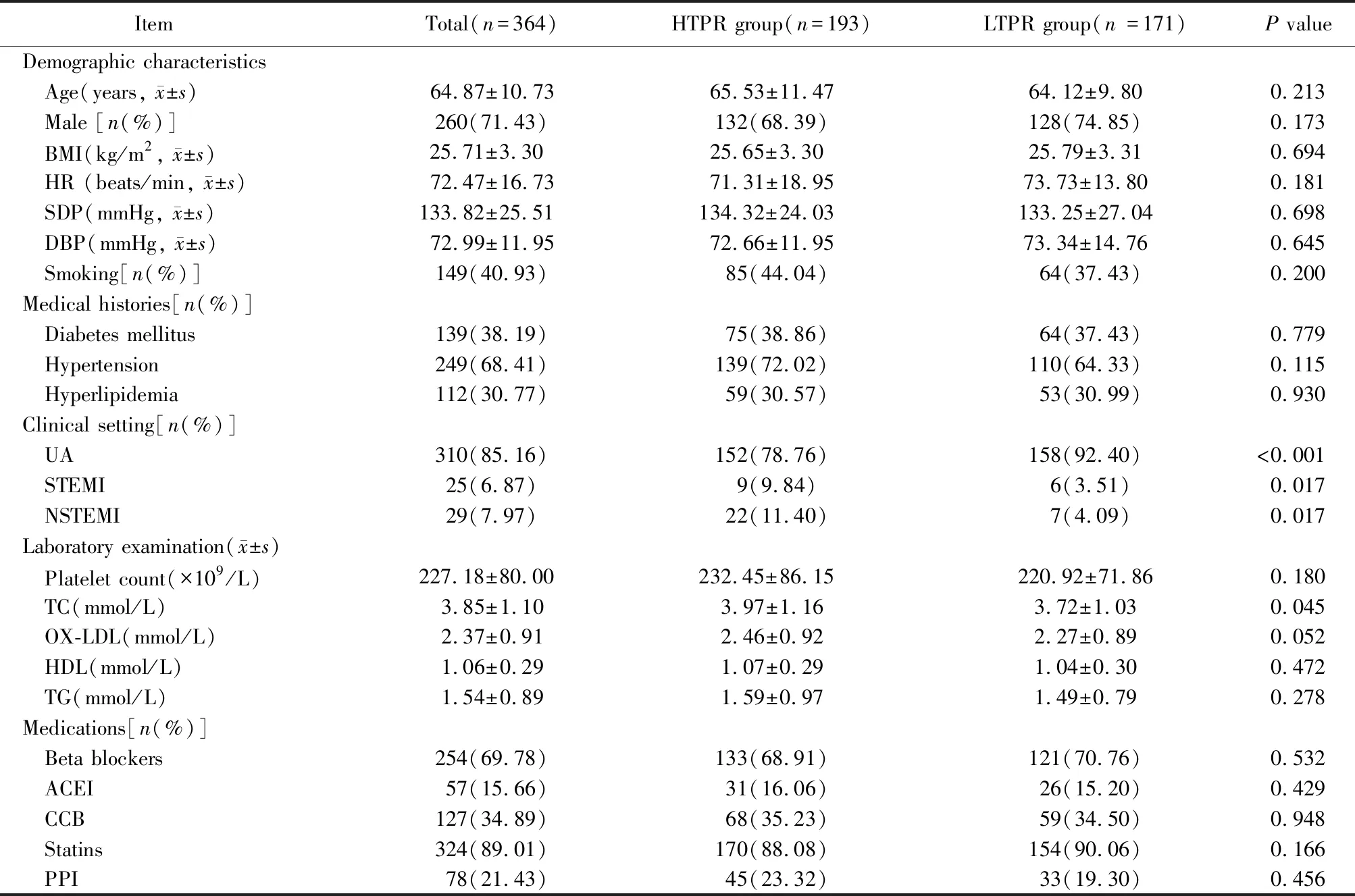
表1 2组患者的基线资料比较
本研究共选择3个基因位点进行SNP检测,分别为miR-126 rs4636297,CYP2C19*2(rs4244285), CYP2C19*3(rs4986893)。在364例患者中,miR-126 rs4636297 AG等位基因携带者104例(28.57%),AA等位基因携带者8例(2.20%),miR-126 rs4636297最小A等位基因频率为16.48%;CYP2C19*2(rs4244285) AG等位基因携带者139例(38.19%),AA等位基因携带者45例(12.36%),CYP2C19*2(rs4244285)最小A等位基因频率为31.46%;CYP2C19*3(rs4986893) AG等位基因携带者36例(9.89%),未发现AA等位基因携带者,CYP2C19*3(rs4986893)最小A等位基因频率为4.95%。
2.2 与氯吡格雷抗血小板反应性的相关性分析
通过校正性别、年龄、高脂血症、高血压、糖尿病多种因素后证实,CYP2C19功能缺失性等位基因是氯吡格雷抗血小板反应性的独立影响因素(P<0.05);miR-126 rs4636297 A等位基因也是氯吡格雷抗血小板反应性降低的独立影响因素(P<0.05;表2)。
2.3 与临床终点事件的相关性分析
通过校正年龄、性别、CYP2C19功能缺失性等位基因、高血压、糖尿病及高脂血症等因素后,CYP2C19功能缺失性等位基因主要缺血事件的发生风险2组患者无明显差异;而rs4636297 A等位基因是1年内口服氯吡格雷患者发生主要缺血终点事件的独立危险因素 (P<0.05;表3)。

表3 logistic 回归分析各基因分型与缺血终点事件关系
3 讨 论
血小板表面的P2Y12受体在血小板活化以及血栓的生长和稳定中起着核心作用[14],P2Y12受体拮抗剂是ACS抗栓治疗的一线用药。P2Y12受体拮抗剂氯吡格雷抗血小板反应性具有个体差异,已知的临床环境和药物基因组学因素并不足以解释P2Y12受体拮抗剂抗血小板反应性差异。已有研究证实,多种miRNA的表达可能与血小板反应性相关[15, 16],其中miR-126-3p在巨核细胞中的过表达被证实与血小板活化水平升高有关[17],且被证实能够通过抑制P2Y12受体的表达参与血小板功能的调节[9]。前期研究发现,miR-126的功能单核苷酸多态性rs4636297能够通过阻断miR-126的加工成熟,抑制miR-126的表达,进而可能影响血小板反应性[11]。本研究在此基础上进一步证实,rs4636297 A等位基因能够独立于已知的药物基因因素(CYP2C19功能缺失性等位基因)和临床环境因素,与高血小板反应性密切相关,并且还是经氯吡格雷抗血小板治疗的ACS患者1年内主要缺血终点事件发生的独立危险因素。鉴于此,我们认为rs4636297可能成为评估ACS患者抗血小板治疗反应性和预后的生物标志物。
既往有研究显示,血小板miR-126能够作为生物标志物预测PCI术后患者心血管不良事件的发生[18],miR-126也有可能参与预测患者发生心肌梗死[19]。本研究进一步证实了miR-126的表达水平还可能通过影响抗血小板药物的反应性影响ACS患者的临床转归。后续通过对miR-126 rs4636297深入的生物功能机制分析可能进一步证实,干预血小板源性 miR-126的表达是否能够影响P2Y12受体拮抗剂的抗血小板反应性,进而成为抗血小板治疗的新靶点。
本研究有一定的局限性。本研究为单中心观察性研究,纳入病例数较少,且难以排除其他与ACS患者临床转归相关的影响因素。此外,本研究仅仅入选了接受氯吡格雷抗血小板治疗的ACS患者,因此尚难以明确miR-126 rs4636297对其他P2Y12受体拮抗剂(如替格瑞洛等)抗血小板反应性的影响。未来可通过开展多中心大样本真实世界的临床研究,以及深入的功能机制分析,进一步证实miR-126 rs4636297对抗血小板药物个体化选择和应用的价值。

