微进化对阿萨希毛孢子菌与小鼠巨噬细胞RAW264.7相互作用的影响
彭卓颖 廖勇 杨鑫 张骞宇 杨蓉娅
(中国人民解放军总医院第七医学中心皮肤科,北京 100700)
阿萨希毛孢子菌(Trichosporonasahii,T.asahii)是一种既可引起浅表感染也可导致播散性感染的机会性致病真菌,具有一定程度的抗吞噬作用[1],然而播散性毛孢子菌病在临床上仍较罕见,主要发生于免疫功能低下的人群,致死率较高[2]。菌株可通过自身的微进化在宿主体内长期共存,形成慢性感染,因此近年来微进化成为了大家关注的热点。本课题组于2000年报道了首例T.asahii感染患者,将分离出的T.asahii命名为原代株(TO),在此期间该患者持续服用抗真菌药物进行治疗,但皮损迁延不愈,于2014年在该患者皮损处再次分离到T.asahii菌株,而且该菌与TO的rRNA大亚基D1/D2区域碱基序列完全相同,故命名其为微进化株(TEVO),由此获得了研究阿萨希毛孢子菌微进化的理想模型[3]。前期研究中发现,单核细胞THP-1与T.asahii共培养后,涉及固有免疫、炎症反应、信号转导和抗凋亡等生物过程的基因均出现了上调,这说明在T.asahii感染的过程中,固有免疫系统发挥了非常重要的作用[4]。本研究旨在通过微进化前后菌株与巨噬细胞共培养的相关实验,进一步探究菌株微进化与固有免疫之间的关系。
1 材料与方法
1.1 材料
实验细胞及菌株 小鼠巨噬细胞株RAW264.7细胞购自中国医学科学院基础所细胞中心。阿萨希毛孢子菌原代株TO(菌藏号:AS2.2174)来源于中国科学院微生物研究所;阿萨希毛孢子菌微进化株TEVO(菌藏号:BM1403)保存于中国人民解放军总医院第七医学中心皮肤科实验室。
实验试剂 DMEM培养基、胎牛血清、胰酶均购自GIBCO公司;异硫氰酸荧光素(FITC)购自北京泛博生物化学有限公司;乳酸脱氢酶细胞毒性检测试剂盒购自Beyotime;细胞因子液相检测试剂盒购自赛泰克;马铃薯葡聚糖琼脂(PDA)购自海博生物;蛋白胨、酵母浸粉、D(+)—葡聚糖购自奥博星生物。
1.2 方法
巨噬细胞RAW264.7吞噬活性检测 将培养于YPD培养基中的TEVO和TO菌株用PBS洗涤1次,然后用pH=9.0的碳酸盐缓冲液(0.1 mol/L)洗涤2次;向每管菌悬液中加入100 mg/mL异硫氰酸荧光素(FITC),置于37℃ 孵育30 min,然后用PBS洗涤2次备用,同时取适量菌悬液涂片,在荧光显微镜下观察菌株染色情况;取适量RAW264.7于24孔板无血清DMEM培养液中,分别按1∶3、1∶6、1∶9的比例加入对应菌悬液,每个实验组的孵育时间均按15 min、45 min、90 min进行孵育,每组设置3个复孔;将每孔中共培养的细胞与菌株用PBS洗涤3次,然后用流式细胞术进行检测分析。所有实验重复3次。
巨噬细胞RAW264.7杀伤活性检测 同前将RAW264.7和菌悬液共培养于96孔板,然后将吹打混匀的菌悬液取适量均匀涂于PDA平皿内,37℃孵箱中培养3 d,然后计数菌落形成单位(CFU),并通过公式计算巨噬细胞对菌株的杀灭率。巨噬细胞对菌悬液孢子的杀灭率(%)=(阳性对照-共培养)/阳性对照×100%。
巨噬细胞RAW264.7损伤检测 取适量RAW264.7于96孔板内,按1∶3、1∶6、1∶9的比例分别加入TO和TEVO菌悬液,同时设正常对照、样品对照和样品最大酶活性对照,各组均设3个复孔;在共孵育24 h和48 h后收取各组上清液,然后用细胞毒性检测试剂盒对上清液中的LDH释放量进行检测,然后通过公式计算菌株对巨噬细胞的毒性。细胞毒性(%)=(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性吸光度-样品对照孔吸光度)×100%。
巨噬细胞RAW264.7细胞因子定量检测 用24孔板进行巨噬细胞菌悬液共培养,LPS组为阳性对照,每组分别孵育24 h时离心取上清液并保存于-80℃备用,各组均设置3个复孔。然后应用ProcartaPlexTMLuminex液相芯片的方法检测上清液中GM-CSF、IL-1β、IL-6、TNF-α、IL-10、IL-12P70和CXCL1等细胞因子。
2 结 果
2.1 巨噬细胞对阿萨希毛孢子菌吞噬活性分析
从图1流式结果中可看出,当共培养15 min时细胞对菌株的吞噬率均较低,RAW264.7细胞与TO分别以1∶3、1∶6和1∶9共培养时,吞噬率分别为(1.26±0.09)%、(1.59±0.04)%和(3.84±0.22)%;而当与TEVO共培养时,吞噬率仅能达到(0.03±0.01)%、(0.62±0.04)% 和(0.75±0.04)%。细胞与菌株共培养45 min时各组吞噬率较前均有小幅度上升。当共培养90 min时,TO组1∶6和1∶9比例共培养的吞噬率明显升高,分别为(10.00±0.56)%和(36.85±1.06)%,1∶3比例共培养组吞噬率增加不明显;TEVO组变化情况与TO组一致。从图1统计图中可以发现,在各种培养条件下,RAW264.7细胞对TO的吞噬率均显著高于TEVO组(P<0.0001)。
2.2 巨噬细胞对阿萨希毛孢子菌的杀伤活性结果分析
将巨噬细胞与TO和TEVO均分别共培养24 h和48 h,然后将培养液中的菌落吹散混匀,取一定量菌悬液培养于PDA培养基中。图2A为共培养24 h后菌落生长情况,通过显微镜对每个PDA平皿上的菌落进行计数,然后利用公式计算巨噬细胞对真菌的杀灭率。与不同浓度TO共培养24 h时,RAW264.7对TO的杀灭率均明显高于对应的TEVO组(见图2B),当共培养48 h时,RAW264.7对TO的杀灭率有小幅度升高,而对TEVO的杀灭率却有所降低,因此TO和TEVO两组的差异更加显著(P<0.001,见图2C)。
2.3 阿萨希毛孢子菌对巨噬细胞的损伤检测
巨噬细胞与TO和TEVO分别共培养24 h和48 h,然后取各组上清液检测LDH的量。从图3A中可看出,当共培养24 h时,只有巨噬细胞与TO按1∶9的比例共培养时TO对巨噬细胞才会产生一定的细胞毒性,其余组均未发现这种情况。当共培养48 h时各组均可检测到LDH的存在,而且通过图3B可以发现,共培养时菌液量越多则对细胞产生的毒性越强,而且无论何种共培养浓度,TO组对巨噬细胞产生的毒性均明显高于TEVO组。
2.4 阿萨希毛孢子菌对巨噬细胞分泌细胞因子的影响
对共培养上清中GM-CSF、IL-1β、IL-6、TNF-α、IL-10、IL-12P70和CXCL1等细胞因子进行检测。其中仅有TNF-α和IL-6两种细胞因子的检测结果差异具有统计学意义,GM-CSF的值在各组间均无差异,其余细胞因子的量均低于检测范围。从图4统计图中可以发现,当细胞与真菌按1∶3和1∶6的比例共培养时,TO分泌TNF-α和IL-6的量均高于TEVO组,而当按1∶9的比例共培养时,TO分泌两种细胞因子的量却低于TEVO组。
3 讨 论
阿萨希毛孢子菌感染初期的免疫识别主要由固有免疫细胞完成,其中单核-巨噬细胞被认为是机体抗T.asahii感染过程中非常重要的防线[5]。单核细胞寿命较短,仅可在血液中存留数小时至数日,但其可在器官内发育为成熟的寿命较长的巨噬细胞,巨噬细胞的吞噬功能要比单核细胞更强,是固有免疫晚期应答的主要效应细胞[6]。当巨噬细胞在TOLL样受体激动剂或IFN-γ和TNF-α等细胞因子的作用下还可转变为经典活化的巨噬细胞,产生多种效应分子杀伤病原体,从而具备更强的吞噬杀菌功能,可以更好的发挥抗感染作用[7]。但是真菌也可以通过抑制吞噬体的成熟、阻断吞噬体酸化或者从吞噬体内逃逸等方式避免被巨噬细胞所吞噬[8,9],而且T.asahii所分泌的一些酶还可使其在吞噬体内存活,如过氧化氢酶或超氧化物歧化酶等[10],这样巨噬细胞未能将病原体消灭,则形成慢性感染。
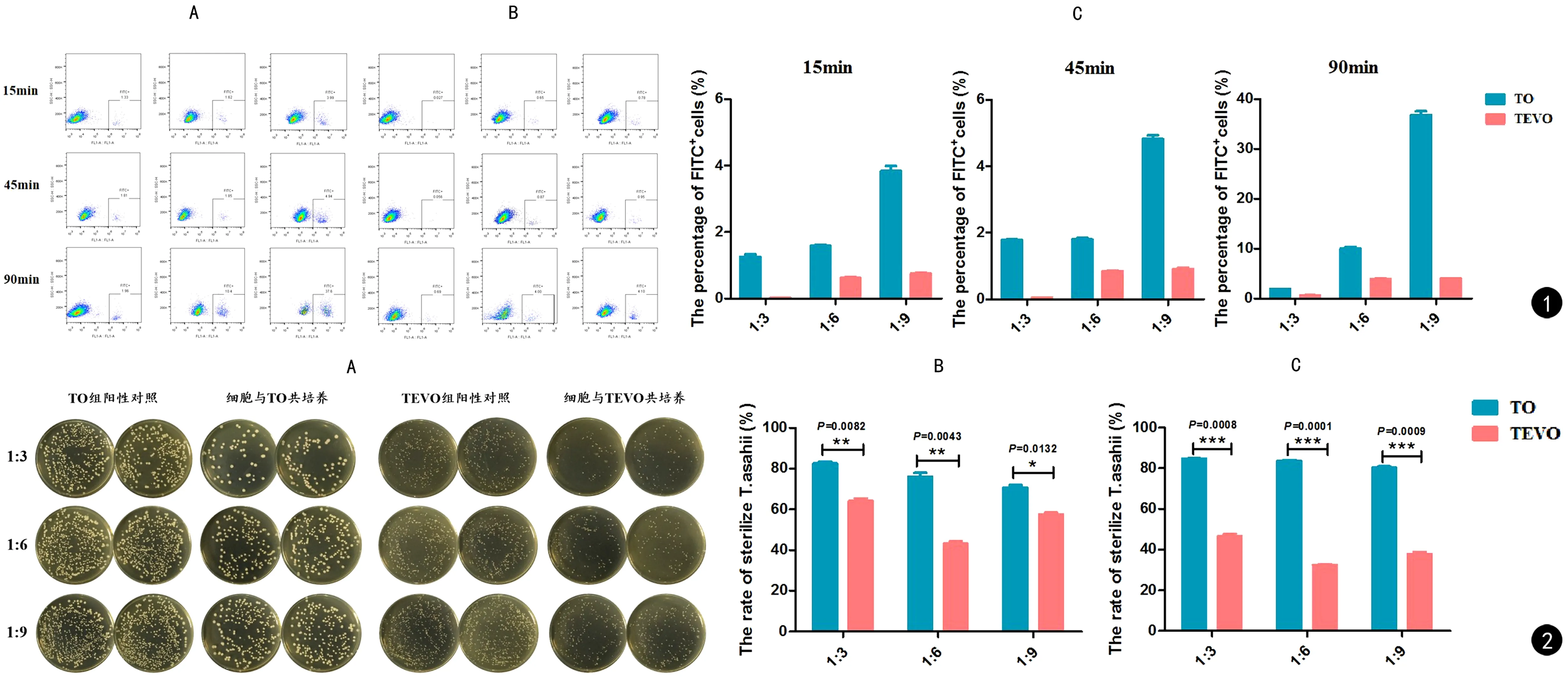
图1 巨噬细胞RAW264.7对TO和TEVO吞噬情况对比。A、B. 分别代表TO组和TEVO组流式检测分析结果,横坐标均为FITC,门内细胞代表吞噬了菌株的巨噬细胞;图C为对各实验组中巨噬细胞吞噬T. asahii情况的统计结果 图2 巨噬细胞RAW264.7对不同组T. asahii杀伤情况对比。A. RAW264.7与TO和TEVO共培养24 h时获取的菌悬液涂板情况,其中阳性对照组的培养液中只有对应的菌,未加入巨噬细胞;B、C. 分别为共培养24 h和48 h时巨噬细胞对各组T. asahii的杀灭率的统计分析

图3 TO和TEVO对巨噬细胞RAW264.7细胞毒性统计分析。A、B.分别为共培养24 h和48 h时T. asahii对巨噬细胞的损伤情况 图4 T. asahii对巨噬细胞RAW264.7分泌细胞因子的影响。A、B.分别是对TNF-α和IL-6两种细胞因子分泌情况的统计,单纯的巨噬细胞培养为阴性对照,巨噬细胞内加入终浓度1 μg/mL的LPS为阳性对照
本课题组前期实验结果证明,RAW264.7小鼠巨噬细胞面临T.asahii感染时,会分泌一些炎性细胞因子和补体参与抗T.asahii感染[11,12,13],而且国外也有多项研究结果表明,T.asahii对巨噬细胞有明显的抗吞噬特性[14]。本研究主要利用微进化前后的阿萨希毛孢子菌TO和TEVO与巨噬细胞株RAW264.7共培养,旨在明确微进化对阿萨希毛孢子菌与巨噬细胞相互作用的影响。
首先,我们研究了RAW264.7对微进化前后菌株的吞噬和杀伤能力的差异。从结果中可以看出,无论何种共培养条件,RAW264.7对TO的吞噬率和杀伤能力均明显高于TEVO。这种差异的出现一方面可能与T.asahii在微进化过程中表面葡萄糖醛酸木糖甘露聚糖(glucuronoxylomannan,GXM)的表达发生变化有关,有研究表明巨噬细胞对T.asahii的吞噬能力明显弱于白念珠菌,却与新生隐球菌的情况类似[5,15],这与菌株GXM的表达有一定关系,虽然T.asahii和新生隐球菌的GXM在结构上并非完全相同,但是却都具备抗吞噬的特性[14]。另一方面,T.asahii微进化后发生的形态学变化以及分泌酶情况的变化都可能会使巨噬细胞对杀伤性物质的分泌有所降低,比如阳离子肽、活性氧(ROS)、氮类以及水解酶等[16,17];同样也可能会影响巨噬细胞上的受体发挥作用,比如TLR2受体和dectin-1,其中前者在识别GXM和限制真菌生长方面均发挥了非常关键的作用,后者也曾被报道是T.asahii的关键受体[18,19]。
随后,我们又研究了微进化前后菌株对RAW264.7的细胞毒性及细胞因子分泌情况的影响差异。TO菌株是以菌丝相为主,而TEVO则以孢子相为主,这种情况与念珠菌较相似[17],有研究表明当念珠菌呈菌丝状态时毒力较强,可诱导宿主分泌大量的TNF-α和IL-6等细胞因子,促使机体产生严重的炎症反应;而呈孢子相时菌株毒力较弱,对细胞因子的诱导能力较差,不易激发宿主的抗真菌免疫反应,更容易与宿主形成长期共存的状态[20,21]。
乳酸脱氢酶(lactic dehydrogenase,LDH)的释放是细胞膜结构被破坏的重要指标,本实验通过检测共培养上清液中的LDH发现,同样的共培养条件下,TO菌株刺激巨噬细胞分泌的LDH的量均明显高于微进化菌株TEVO组,通过公式计算可以发现TO对巨噬细胞的毒性要强于TEVO菌株。
细胞因子在参与机体免疫以及抗感染过程中发挥着非常重要的作用,因此本实验对TO和TEVO与巨噬细胞共培养期间的多种细胞因子的分泌情况进行了检测,可能因为共培养时间较短,最终只检测到TNF-α和IL-6两种细胞因子的分泌情况。TNF-α是最早被分泌的促炎症细胞因子之一,也是启动固有免疫并发挥抗真菌作用的关键分子,但也有研究表明在真菌感染过程中TNF-α和IL-6的分泌量越高疾病却越严重[22,23]。在本实验结果中发现当TO和TEVO与巨噬细胞分别按1∶3和1∶6比例共培养时,TO组分泌的TNF-α和IL-6均明显高于TEVO组,此实验结果与念珠菌相符;而按1∶9的比例共培养时,TO组分泌的两种细胞因子的量却低于TEVO组,考虑培养过程中TO菌株增殖较快使细胞的活力有所下降,从而出现了细胞因子分泌量降低的情况[11]。已发现菌丝相念珠菌的菌壁中含有的大量甘露聚糖对Dectin-2受体的亲和力较强,可以诱导TNF-α的分泌,而孢子相的菌壁中甘露聚糖的含量较少,因此对TNF-α的分泌量也会减少[21,24];另外菌丝相的菌壁中β-葡聚糖充分暴露,容易被Dectin-1受体识别而分泌IL-6,孢子相的菌壁中β-葡聚糖则多被隐藏[24]。由于微进化前后的阿萨希毛孢子菌的形态学变化与双向型真菌念珠菌较一致,因此考虑TO与TEVO菌株促进巨噬细胞分泌细胞因子存在差异的原因很可能与念珠菌类似。
综上所述,巨噬细胞对微进化后T.asahii的吞噬和杀伤能力降低,而且微进化菌株TEVO对巨噬细胞的毒性减弱,同时刺激细胞因子分泌的能力也有所下降。以上结果说明T.asahii可以通过微进化改变自身的表型,从而避免引发宿主的免疫攻击而保全自身,但目前微进化对巨噬细胞与T.asahii之间相互作用的具体分子机制尚不清楚,因此有必要进一步探索真菌微进化与固有免疫反应之间的关系,这将有助于在免疫学方面为抗真菌治疗提供一个新的靶点,寻找新的治疗思路。

