Fonsecaea monophora色素毒力性研究
王丽 王薇
(中南大学湘雅医学院附属海口医院皮肤科,海口 570208)
着色芽生菌病(chromoblastomycosis,CBM)是一种慢性皮肤和皮下组织肉芽肿性真菌病[1,2]。
该病顽固难治、复发率高,通常局限于皮肤和皮下组织,表现为慢性疣状、结节状或菜花状肉芽肿性皮肤病变。晚期可经淋巴管血管播散,致畸致残,甚至在慢性溃疡的基础上发生鳞状细胞癌,严重威胁人类身心健康[3]。
黑色素是多数病原真菌的重要毒力因子,例如白念珠菌、隐球菌、孢子丝菌、组织胞浆菌和曲霉等。其具有极强的抵御外来离子辐射、氧化条件变化、极度温度更替和pH 值改变的作用[4]。此外黑色素还担负着增强致病真菌侵袭毒力和诱生真菌耐药性的作用,导致人体免疫防御反应性降低和抗真菌药物耐药性升高[5]。目前关于F.monophora致病性研究相对缺乏。本研究通过建立不同菌株、细胞壁色素颗粒与小鼠巨噬细胞共培养体系,测定一氧化氮合酶基因、亚硝酸盐浓度、Th1、Th2细胞因子的表达,探讨黑色素是否为F.monophora重要毒力因素,是否在巨噬细胞与F.monophora免疫反应中起到相关作用。
1 材料和方法
1.1 菌种来源
实验菌株由中山大学孙逸仙纪念医院真菌室提供,分离自81岁男性患者的皮损。该菌株经形态学及ITS序列检测为F.monophora,是1株分生孢子变异株,编号为CBS122845,在SDA培养基上,转种10余次产生其白色突变株(CBS125149)。
1.2 透视电镜观察两株菌
使用无菌接种针从马铃薯斜面培养基(PDA)表面,将CBS122845,CBS125149剥离下来,放置存有PBS的试管中,用无菌玻璃吸管反复轻轻吹打菌落,制备菌悬液。以10000 r/min,离心10 min去上清液,加入3%戊二醛固定,储存于4℃至广州市陆军总医院电镜室制样、观察。
1.3 酸碱法提取F.monophora细胞壁色素颗粒
使用无菌接种针从马铃薯斜面培养基(PDA)表面,将CBS122845,CBS125149剥离下来,放入存有0.5 mol/L NaOH的50 mL离心管中,涡旋混匀10 min, 在低温摇床上震荡过夜。以10000 g,离心10 min,取上清液。用1 mol/L HCL将上清液的pH值调至1.5。以5000 g,离心10 min,去沉淀,用双蒸水反复冲洗,离心后沉淀3~5遍后。将沉淀重悬于0.1 mol/L HCL溶液中,用0.1 mol/L HCL反复冲洗,离心后沉淀3~5遍后,直至上清液清亮无色。取沉淀,溶于0.1 mol/L HCL中,用双蒸水透析,将装有透析液的离心管放置-80℃冰箱过夜,隔日用冷冻干燥机将透析液冻干,将冻干粉储存于-20℃冰箱
将从CBS122845提取的细胞壁颗粒命名为“F1”,将从CBS125149提取的细胞壁颗粒命名为“F0”,将上述冻干粉置于0.5 mol/L NaOH溶液中,用1 mol/L HCL中和溶液pH值,至pH值调至6~7之间,冻干粉完全溶解。再加入PBS缓冲液,将F1/F0浓度调至5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL。
1.4 共培养的建立
小鼠单核-巨噬细胞系RAW264.7细胞购自武汉大学中国典藏物保存中心(CCTCC)。
RAW264.7细胞经培养传代2~3次状态稳定后,用含EDTA的0.25%胰酶消化,以6×105/mL密度转至六孔板,每孔板1.8 mL,加用50 U/mL IFN-γ、100 ng/mLLPS预刺激细胞,将六孔板置于含5%CO237℃培养箱24 h后。根据实验分组在每培养孔加入分生孢子悬液或F1/F0溶液共200 μL (其中分生孢子与巨噬细胞的数目比例均为5∶1)轻轻摇匀,置于培养箱培养24 h。
实验分组 (Ⅰ) RAW264.7与F1共培养;(Ⅱ) RAW264.7与F0共培养;(Ⅲ) RAW264.7与CBS122845共培养;(Ⅳ) RAW264.7与CBS125149共培养;(Ⅴ) RAW264.7与CBS125149及F1共培养。
对照组 培养液中只含有RAW264.7,未添加任何分生孢子及色素颗粒。
1.5 实时荧光相对定量PCR检测i-NOS基因的表达
主要试剂、仪器 RNA提取试剂、逆转录试剂盒、SYBR Premix EX TaqTMII 荧光 Real-Time PCR 试剂 盒 都 购 自TaKaRa公司 。 Real time-PCR 仪 (Light Cy-cler480)。引物合成由TaKaRa公司完成:i-NOS的引物:扩增产物长度为185bp,上游引物:5’- CAAGCTGAACTTGAGCGAGGA-3’,下游引物: 5’-TTTACTCAGTGCC AGAAGCTGGA -3’;内参照β-actin的引物:扩增产物长度为171bp,上游引物:5’- CATCCGTAAAGACCTCTATGCCAAC-3’,下游引物:5’- ATGGAGCCACC GATCCACA -3’
SYBR Green Real-time PCR法检测i-NOS基因的表达 ①组织总 RNA 的提取和 c DNA 的合成:各组培养的细胞弃上清,并以PBS冲洗2遍,每孔加Trizol 1 mL,严格按照说明书操作提取组织总 RNA,用紫外分光光度仪测定其纯度,D(260)/D(280)值在 1.8~2.1 之间,之后进行逆转录,按照逆转录试剂盒说明操作,每10 μL反应体系中加入500 ng总RNA,反应体系为20 μL,反转录条件:37℃,15 min;85℃,5 s;4℃。反应后 c DNA 置于-20℃冰箱保存备用。②SYBR 实时荧光定量 PCR 及数据处理:应用Light Cy-cler480实时荧光定量PCR仪检测i-NOS基因相对表达量,按照TAKARA荧光定量PCR试剂盒操作说明进行,20 μL PCR反应体系:其中c DNA含量为2μL,反应条件为95℃预变性30 s;PCR反应40个循环,95℃ 5 s,60℃ 20 s。循环结束后,绘制溶解曲线95℃ 1 min,65℃ 15 s;降温37℃ 30 s。由Light Cycle Real-Time PCR软件自动记录荧光曲线并分析计算出 Ct 值。采用相对定量2-△△ct法计算目的基因的相对表达量,根据以下公式计算:△△Ct=(Ct目的基因-Ct内参基因)未知样本组-(Ct目的基因-Ct内参基因)对照组,以β-actin作为内参,以2-△△CT法分析进行组间相对定量分析。
1.6 格里斯法检测一氧化氮(nitric oxide,NO)的表达
采用格里斯法测定不同培养体系亚硝酸盐和硝酸盐(NO2-/NO3-)的总量来计算一氧化氮的表达。实验方法参照一氧化氮测试盒(Bioassay Systems,D2NO-100,美国)。整个实验严格按说明书进行操作。MK3全自动酶标仪(德国生产)在492 nm波长处测定吸光度值,根据标准曲线和每个样本的吸光度值计算其含量,样品浓度计算如下:[Nitriteand nitrate]=(ODSAMPLE-ODBLANK)/Slope (μmol/L ),ODSAMPLE和ODBLANK分别是样品和水的吸光值。
1.7 ELISA检测IL-12、TNF-α、IL-10的表达
ELISA检测不同培养体系RAW264.7细胞IL-12、TNF-α、IL-10的表达 采用双抗体夹心法酶联免疫吸附试验,参照ELISA检测试剂盒(RayBiotech,美国), 整个实验严格按说明书进行操作。MK3全自动酶标仪德国生产在450 nm波长处测定吸光度值,根据标准曲线和每个样本的吸光度值计算其含量。
统计学方法 以上实验均做3个复孔,数据用均数±标准差表示,使用SPSS16.0统计学软件进行数据分析。采用方差分析(ANOVA),多个样本均数两两比较的t检验,P< 0.05为差异有统计学意义。
2 结 果
2.1 CBS122845、CBS125149大培养、显微电镜、透视电镜下形态,提取的色素颗粒形态
将CBS122845、CBS125149接种于PDA培养基,26℃培养箱培养13~15 d后,CBS122845生长成黑色菌落,CBS125149生长成白色菌落。两株菌菌落均表现为干燥、堆积、质脆。CBS122845菌落表面较为粗糙,CBS125149较为光滑(见图1a、b)。CBS122845生长较CBS125149较慢。倒置显微镜下观察,CBS122845分生孢子相对于CBS125149分生孢子个体较大,排列较紧密(见图1c、d)。透视电镜下观察,CBS122845细胞壁表面存在致密颗粒,但CBS125149缺乏这类颗粒,表面光滑(见图1e、f)。通过酸碱法,我们提取了CBS122845分生孢子细胞壁成分“F1”,提取CBS125149分生孢子细胞壁成分“F0”。“F1”呈黑色,“F0”呈白色(见图1g、h)。
2.2 实时荧光相对定量PCR检测i-NOS基因的表达结果
实时荧光定量PCR溶解曲线分析见图2a,RAW264.7细胞中目的基因i-NOS的表达结果见图2b、c。
以RAW264.7细胞(50 U/mL IFN-γ、100 ng/mL LPS预刺激24 h后)i-NOS mRNA表达为基点,设为1。不同浓度细胞壁色素颗粒F1/F0与激活状态的RAW264.7细胞共培养,F1组(10 μg/mL、20 μg/mL)与F0组(10 μg/mL、20 μg/mL)相比,“F1”能显著降低RAW264.7细胞一氧化氮合酶基因的表达。同一浓度下,两组之间进行比较,差异具有统计学意义。且当“F1”浓度调整为10 μg/mL时,RAW264.7细胞一氧化氮合酶基因的表达量受抑制程度达到最低。白色突变株CBS125149与RAW264.7细胞共培养,i-NOS基因相对值为9.64±0.99,在该共培养体系中,添加不同浓度色素颗粒F1,随着F1浓度从5 μg/mL逐渐升至50μg/mL,RAW264.7细胞i-NOS基因的表达量逐步下降。
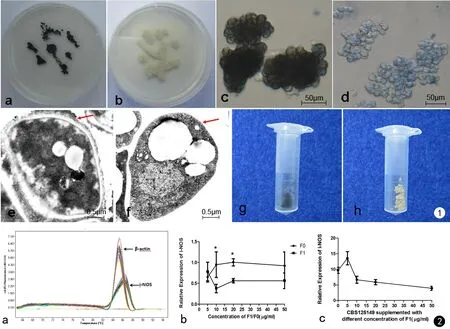
图1 a. CBS122845大培养形态; b. CBS125149大培养形态; c. CBS122845倒置显微镜下形态; d. CBS125149倒置显微镜下形态; e. CBS122845透视电镜下形态; f. CBS125149透视电镜下形态; g. “F1”冻干粉; h. “F0”冻干粉 图2 a.目的基因i-NOS、内参基因β-actin real-time PCR产物的溶解曲线图; b. 不同浓度细胞壁色素颗粒F0/F1与激活状态的RAW264.7细胞共培养,RAW264.7细胞中目的基因i-NOS的表达; c. CBS125149及不同浓度 F1与激活状态的RAW264.7细胞三者共培养。RAW264.7细胞中目的基因i-NOS的表达
2.3 格里斯法检测一氧化氮的表达结果
由于NO化学性质不稳定,本次实验通过测量NO2-/NO3-总浓度以评估NO释放量。实验结果显示,对比于白色突变株CBS125149,色素株CBS122845与RAW264.7细胞反应,能显著抑制RAW264.7细胞产生NO(P<0.05)。对比于“10 μg/mL F0”,10 μg/mL色素颗粒“F1”能显著抑制RAW264.7细胞产生NO(P<0.05)。在白色突变株与RAW264.7细胞反应体系中,加入10 μg/mL色素颗粒“F1”后,RAW264.7细胞NO的释放量出现明显下调(P<0.05)(见表1)。
2.4 ELISA检测IL-12、TNF-α、IL-10的表达结果
实验结果见图3,对比白色突变株CBS125149、色素株CBS122845与RAW264.7细胞反应,能显著抑制RAW264.7细胞产生IL-12、TNF-α,上调其产生IL-10(P<0.05)。对比10 μg/mL细胞壁颗粒“F0”,10 μg/mL细胞壁色素颗粒“F1” 能抑制RAW264.7细胞产生IL-12,上调其产生IL-10(P<0.05)。在白色突变株与RAW264.7细胞反应体系中,加入10 μg/mL色素颗粒“F1”后,RAW264.7细胞的IL-12、TNF-α释放量出现明显下调,IL-10释放量出现明显上调(P<0.05)。
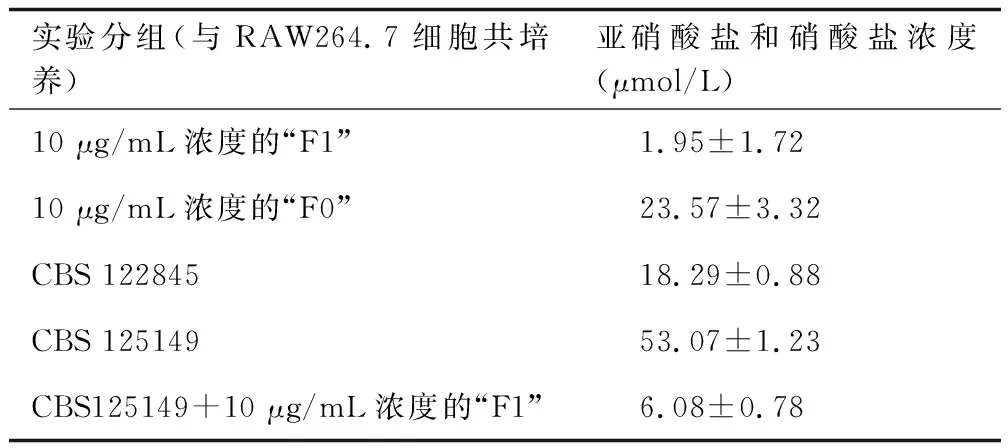
表1 各组RAW264.7细胞共培养体系上清液中,亚硝酸盐和硝酸盐浓度的总表达量
3 讨 论
F.monophora属于着色霉属的真菌,是近年从裴氏着色霉中分出的新种,是中国南方着色真菌病的主要病原体。其临床表现多样,如化脓、结节、斑块、疣状及肿瘤样损害。慢性病程可持续数年或数十年。可因疤痕形成而致残,甚至丧失劳动能力,久治不愈可发展为鳞癌[6],甚至可引起其他类型感染(如颅内感染[7,8]。F.monophora的发病机制目前仍不清楚。
细胞壁成分是着色芽生菌病中真菌持续和增殖的关键因素,也是肉芽肿病变发展的重要刺激因素[9,10]。Fonsecaea的细胞壁成分主要由β-1-3-葡聚糖、几丁质、α-1-3-葡聚糖、半乳甘露聚糖、大部分蛋白质和黑色素[11]组成。
黑色素是一类常见于微生物和动植物体内的高分子量、非均质、结构复杂的聚合体,通常分为细胞壁和细胞外黑色素两种[12,13]。依据合成途径不同,黑色素又分为DHN-黑色素和DOPA-黑色素两种。DHN-黑色素由前体物质1, 8-二羟基萘(DHN)经过氧化聚合而成,多见于子囊菌纲和半知菌纲真菌,如构巢曲霉、黑曲霉、烟曲霉、卡氏枝孢霉、甄氏外瓶霉、紧密着色霉、裴氏着色霉、圆酵母样亨德逊霉、孢子丝菌等。DOPA-黑色素以酪氨酸为底物,经漆酶(酚氧化酶)的氧化作用,最后聚合形成DOPA-黑色素,见于白念珠菌、组织胞浆菌、新生隐球菌等[14,15]。Romero-Martinez等[16]对DHN-黑色素合成途径中PKS缺陷的孢子丝菌mel14的研究认为,黑色素在抵抗紫外线、亚硝酸盐和过氧化氢等应激方面发挥重要作用。此外许多研究表明,黑色素可以阻碍机体免疫系统反应性氧族(ROS)的生成并抵抗巨噬细胞的吞噬作用,与病原真菌的致病力关系密切[17-19]。瓜类炭疽病菌、稻瘟病病菌的黑色素能促使附着胞膨胀压的产生,有利于真菌渗透进入植物的叶从而感染[17,18]。对巴西副球孢子菌的研究也表明黑色素有利于菌体抗巨噬细胞的吞噬并增强其对药物的抵抗性[22]。Garcia-Rivera等[23]对新生隐球菌的研究表明,黑色素能改变隐球菌细胞表面电荷而抵制宿主细胞对隐球菌的吞噬。这些研究均提示黑色素是多数病原真菌的毒力因子。但对于着色霉,黑色素的致病性研究较缺乏。
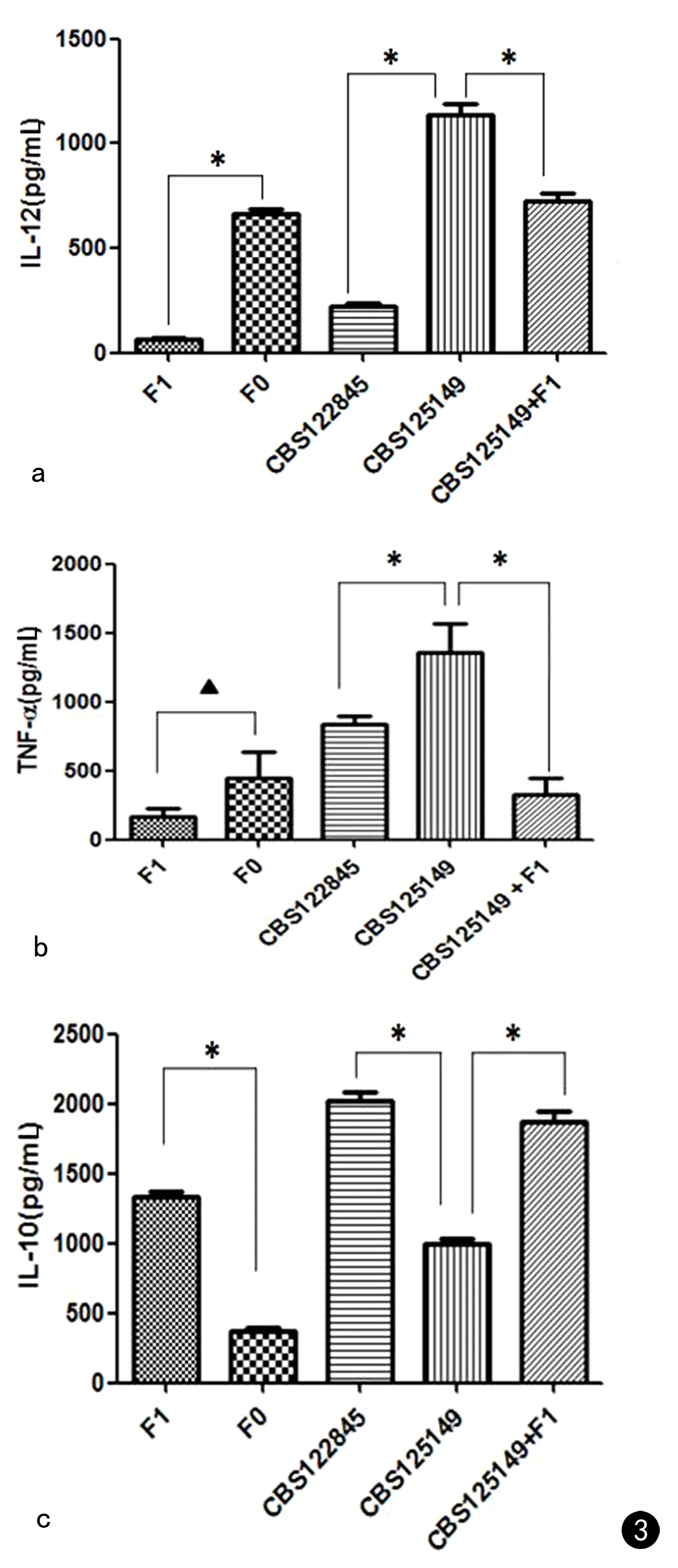
图3 a. 不同菌株、细胞壁色素颗粒与激活状态的RAW264.7细胞共培养,上清液中IL-12的表达量; b. 不同菌株、细胞壁色素颗粒与激活状态的RAW264.7细胞共培养,上清液中TNF-α的表达量; c. 不同菌株、细胞壁色素颗粒与激活状态的RAW264.7细胞共培养,上清液中IL-10的表达量
巨噬细胞作为一种极其重要的固有免疫细胞,在抵抗着色霉属真菌感染中发挥着重要作用。以往研究认为巨噬细胞不能直接杀灭着色真菌菌体,但可通过氧化应激氧化应激对菌体生长起抑制作用,抑制出芽管及菌丝的形成[24]。NO及活性氮媒介与金属离子结合、与芳香残基的亲核中心结合,硝基化反应及亚硝基化反应,从而对一系列蛋白进行修饰来完成复杂的调节功能[25]。使cGMP增加,从而影响细胞的信号传导系统[26,27];调节氧耗量和ATP的产量,影响线粒体功能,控制细胞的凋亡[28,29];调节通道蛋白、结构蛋白、转录因子、激酶及许多代谢相关的酶的表达[30,31]。目前,在真菌学方面,RNI研究相对缺乏。相关研究认为NO可延迟真菌分生孢子的出芽过程[32]。
本研究通过Real-time PCR方法对不同实验组RAW264.7细胞中i-NOS基因表达进行相对定量分析。结果显示,10 μg/mL、20 μg/mL “F1”能显著降低RAW264.7细胞i-NOS基因的表达,当“F1”浓度调整为10 μg/mL时,RAW264.7细胞i-NOS基因的表达量最低。在白色突变株CBS125149与RAW264.7细胞共培养体系中添加不同浓度色素颗粒F1,随着F1浓度从5 μg/mL逐渐升至50 μg/mL,RAW264.7细胞i-NOS基因的表达逐步下降。上述结果均表明色素颗粒可抑制RAW264.7细胞i-NOS基因的表达。此外,本研究通过格里斯法检测NO表达,发现色素株及细胞壁色素颗粒能抑制RAW264.7细胞NO的生成。在白色突变株CBS125149与RAW264.7细胞共培养体系中添加10 μg/mL色素颗粒F1,RAW264.7细胞NO的释放量出现明显下调。我们的数据表明,当F.monophora入侵机体时,细胞壁色素颗粒可对菌体产生保护作用,在与巨噬细胞相互作用过程中,能下调i-NOS基因、抑制巨噬细胞产生NO,从而抵御巨噬细胞对F.monophora氧化应激作用,使F.monophora逃逸巨噬细胞氧化杀伤作用。黑色素能够抵抗NO的免疫破坏。这一过程有利于真菌在组织中的持续存在,并负向调节宿主的免疫反应。
此外,着色芽生菌病的皮损内常见的免疫细胞是CD4+T细胞、CD8+T细胞,B淋巴细胞和许多巨噬细胞[33]。研究显示,在CBM病情严重的患者中可观察到IL-10水平升高而IFN-γ水平降低,同时体外刺激并不出现T细胞增殖,反之,在病情轻的患者产生高水平IFN-γ和低水平IL-10,同时体外刺激可见T细胞增殖反应[34,35]。着色芽生菌病的严重程度与机体内Th1、Th2免疫反应的平衡程度有密切关系,机体对菌体的杀伤作用依赖于加强Th1、抑制Th2免疫反应,反之,菌体的生长与增殖依赖于抑制Th1、加强Th2免疫反应。
LSP、IFN-γ就可刺激巨噬细胞合成细胞因子如IL-10、TNF-α、IL-12等,调节巨噬细胞对微生物的杀伤作用。研究认为宿主细胞对真菌的杀伤抑制效应,依赖于Th1细胞免疫。在抵御多数真菌,如组织胞浆菌[36]、新生隐球菌[37]、白念珠菌[38]的免疫反应中,Th1细胞因子被认为是抑制菌体生长、协同氧化杀伤菌体的调节因子。本实验测定了Th1细胞因子TNF-α、IL-12以及Th2细胞因子IL-10。结果发现色素株及色素颗粒能下调RAW264.7细胞表达TNF-α、IL-12,上调RAW264.7细胞表达IL-10细胞因子。这些实验结果可能揭示了F.monophora色素能下调机体Th1细胞免疫,上调Th2细胞免疫。这些数据表明,黑色素在体外抑制Th1反应,加重Th2反应。这一过程表明,CBM的严重程度可能与黑色素密切相关。
综上所述,黑色素是F.monophora的重要致病因子。黑色素是F.monophora逃脱巨噬细胞氧化爆发的重要成分。黑色素抑制Th1反应和加剧Th2反应,有利于真菌的持续感染。

