脊髓损伤康复患者骨密度及骨代谢标记物特点的分析
郑欣,戚艳艳,周红俊,康海琼,佟艳铭
1.中国康复研究中心北京博爱医院,a.内分泌科;b.脊髓损伤康复科,北京市 100068;2.首都医科大学康复医学院,北京市 100068
脊髓损伤是一种严重的致残性疾病,脊髓损伤后骨质持续流失,易导致废用性骨质疏松,低能量骨折风险升高[1-2]。8.7%~50%的脊髓损伤患者发生骨折[3-5],脊髓损伤患者发生骨折的风险是普通人群的2 倍,且骨折风险随损伤时间延长而逐渐增加[5-7]。患者骨折后可导致髋部和膝部挛缩、骨髓炎、压疮等并发症,进一步导致活动能力下降,为后续康复增加困难和花费[8-9]。目前关于脊髓损伤患者废用性骨质疏松的评估、监测等临床管理方面尚存在较多空白,与之相关的研究甚少。
双能X 线吸收法(dual energy X-ray absorptiometry,DXA)是临床评估骨密度的主要方法,是骨质疏松症诊断的金标准,并可对骨密度进行准确定量[10-12]。骨代谢标记物可反映全身骨骼代谢的动态状况,对于预测骨丢失速率、评估骨折风险、选择干预措施、监测药物疗效等具有重要作用[13]。目前我国少有同时对脊髓损伤患者的骨密度和骨代谢标记物进行分析的研究。
本研究分析脊髓损伤康复患者的骨密度和骨代谢标记物特点及其相关因素,为早期防治脊髓损伤后的废用性骨质疏松及其规范化管理提供参考。
1 资料与方法
1.1 一般资料
回顾分析2018 年4 月至2020 年5 月于本院住院康复的脊髓损伤2 年内患者共78 例(脊髓损伤组)。所有患者在住院期间根据病情进行综合康复训练。
诊断标准:2019 年美国脊柱损伤协会(American Spinal Injury Association,ASIA)发布的脊髓损伤神经学分类国际标准[14]。
纳入标准:①年龄18~60 岁,男女不限;②脊髓损伤病程在2年内。
排除标准:①代谢性骨病;②糖尿病;③甲状腺及甲状旁腺疾病;④自身免疫性疾病;⑤严重肝肾疾病;⑥恶性肿瘤;⑦应用影响骨代谢药物;⑧绝经后女性。
以年龄、性别、体质量指数(body mass index,BMI)作为匹配条件,选取同期健康体检人员52 例作为对照组。两组年龄、性别、BMI比较无显著性差异(P>0.05)。见表1。
本研究经中国康复研究中心医学伦理委员会批准(No.2018-099-1),所有受试者均知情同意。
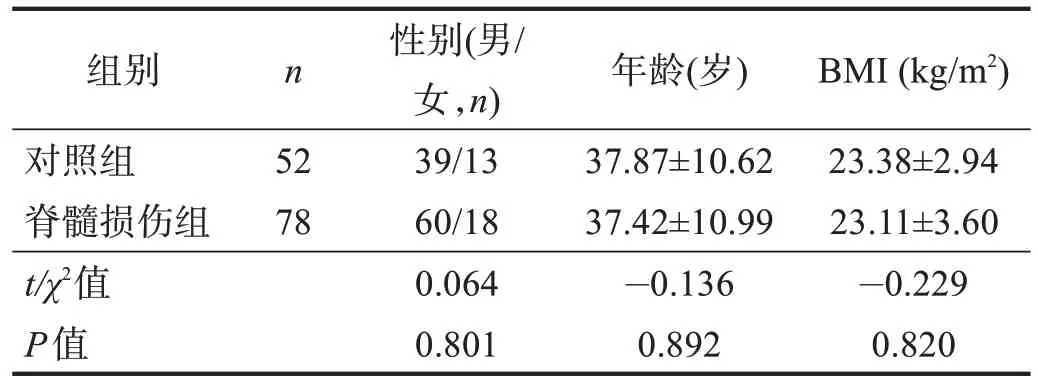
表1 两组一般资料比较
1.2 方法
1.2.1 病史资料收集
收集脊髓损伤患者的病史资料信息,包括性别、年龄、损伤病程、病因、损伤程度、瘫痪类型、并发疾病,身高、体质量,计算BMI。
1.2.2 实验室检查
应用BS-2000M 全自动生化分析仪(中国MINDRAY 公司)检测脊髓损伤患者的血清钙(calcium,Ca)、磷(phosphorus,P)、碱性磷酸酶(alkaline phosphatase,ALP)。应用Cobas E411 电化学发光免疫分析仪(瑞士ROCHE 公司),检测25 羟基维生素D (25-OHD)、骨钙素(osteocalcin,OC)、I 型前胶原N 端前肽(N-terminal propeptide of type l precollagen,PINP)、羧基端肽(collagen type I C-terminal telopeptide,CTX)、甲状旁腺素(parathyroid hormone,PTH)。78 例患者中有56 例进行骨代谢生化标记物的检测。
1.2.3 骨密度检测
应用Discovery-Wi双能X 线吸收仪(美国HOLOGIC 公司)测量脊髓损伤患者和对照组股骨近端骨密度。股骨近端感兴趣区为股骨颈、大转子、转子间、Ward's 区、全髋,应用髋部标准模块检测股骨近端各部位的感兴趣区。每天检测骨密度前进行体膜扫描分析。所有扫描和分析均由同一操作员执行以确保一致性,并遵循标准质量控制程序。
1.3 统计学分析
采用SPSS 25.0 统计软件进行数据处理及统计分析。计量资料行Shapiro-Wilk 正态检验,正态分布变量以()表示,非正态分布变量以M(Ql,Qu)表示。两组间年龄、BMI、骨密度的比较采用独立样本t检验,两组间损伤病程的比较采用Mann-WhitneyU检验,两组间性别构成比的比较采用χ2检验。变量之间的相关性采用Pearson 或Spearman 相关性检验。显著性水平α=0.05。
2 结果
2.1 脊髓损伤患者临床特征
78例脊髓损伤患者中,截瘫60例,四肢瘫18例;根据ASIA 残损分级[14],A 级43 例,B/C/D 级35 例;损伤病程为10 d~2 年;脊髓损伤患者总体临床特征、骨密度及骨代谢生化指标见表2。
2.2 不同损伤病程脊髓损伤患者和对照组股骨近端骨密度的比较
根据损伤病程将脊髓损伤患者分为4 组:损伤3个月内、损伤3~6 个月、损伤6~12 个月和损伤12~24个月,按年龄、性别、BMI 为各组患者1∶1 匹配对照,各亚组患者与匹配的对照组进行股骨近端骨密度的比较。
结果显示,损伤3 个月内患者股骨近端各部位骨密度均与对照组无显著性差异(P>0.05),损伤3~6 个月患者大转子、转子间、全髋骨密度低于对照组(P<0.05),损伤6~12 个月患者的股骨颈、大转子、转子间、全髋骨密度低于对照组(P<0.05),损伤12~24 个月患者的股骨近端各部位的骨密度均低于对照组(P<0.05)。骨密度降幅随损伤病程延长而逐渐升高。见表3~表6。
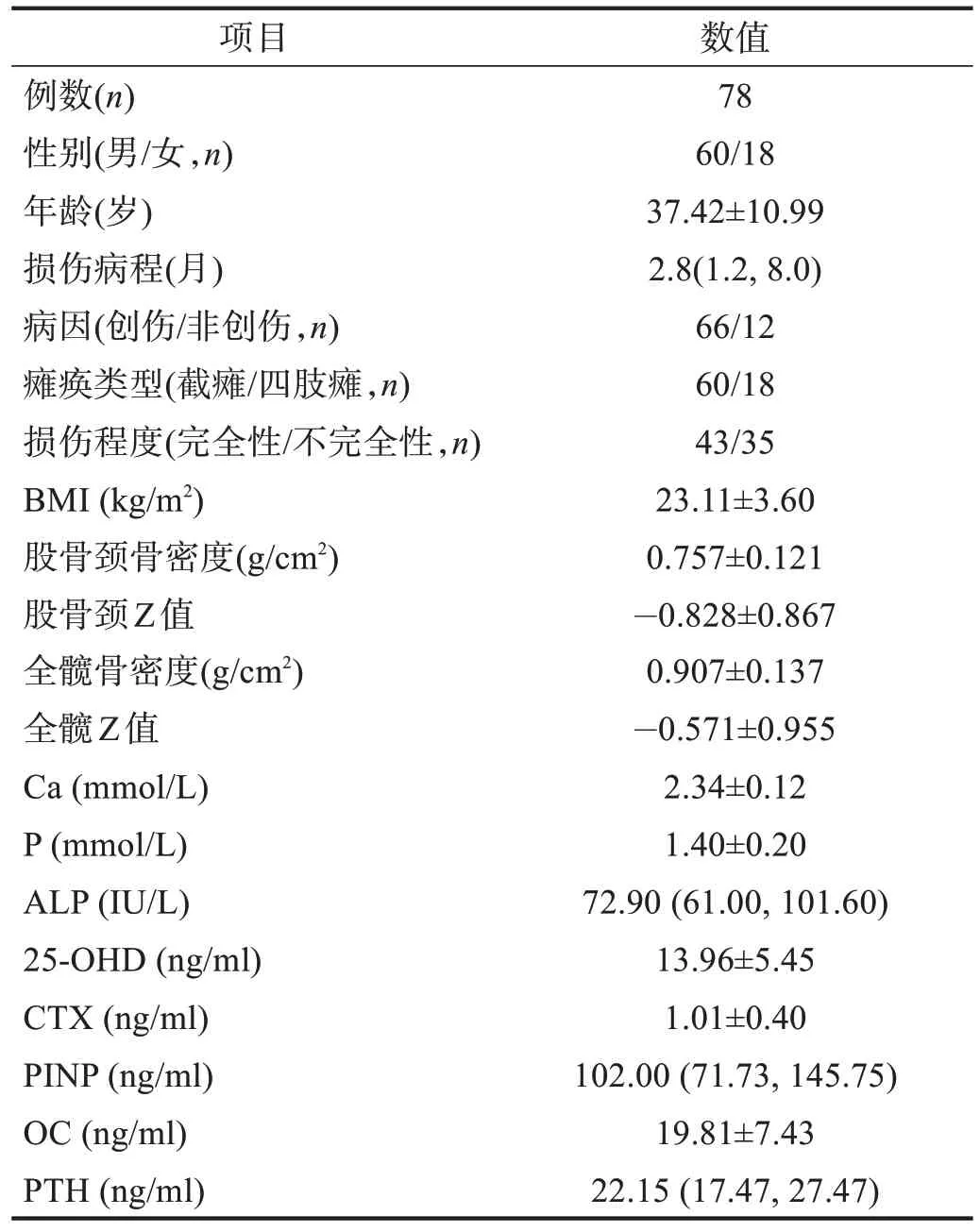
表2 脊髓损伤患者临床特征及骨代谢生化指标
股骨颈Z 值在损伤3 个月内、损伤3~6 个月、损伤6~12 个月、损伤12~24 个月分别为(-0.655±0.819)、(-0.908±0.885)、(-1.030±0.894)和(-1.156±1.019);全髋Z 值分别为(-0.297±0.838)、(-0.642±0.870)、(-0.720±0.902)和(-1.311±1.245)。股骨颈Z 值与全髋Z值随着损伤病程延长呈逐步下降趋势。
2.3 不同瘫痪类型、不同损伤程度骨密度的比较
选取截瘫46例、四肢瘫18例,完全性损伤39例、不完全性损伤35 例,使其年龄、BMI、性别构成比、损伤病程具有可比性(P>0.05),截瘫与四肢瘫、完全性损伤与不完全性损伤骨密度比较均无显著性差异(P>0.05)。见表7~表8。
2.4 不同损伤病程脊髓损伤患者的骨代谢指标
根据损伤病程将脊髓损伤患者分为3 组:损伤3个月内、损伤3~6个月、损伤7~24个月。各组骨代谢指标CTX、PINP 于各损伤病程均高于参考范围上限,CTX 在损伤3 个月内升高53.13%,损伤3~6 个月升高76.14%,损伤7~24 个月升高7.53%。PINP 在损伤3 个月内升高1.13 倍,损伤3~6 个月升高3.04 倍,损伤7~24 个月升高50.57%。56 例脊髓损伤患者中,25-OHD充足(>30 ng/ml) 1 例(1.79%),25-OHD 不足(<30 ng/ml) 6 例(10.71%),25-OHD 缺乏(<20 ng/ml) 49 例(87.50%)。见表9。
2.5 股骨颈、全髋骨密度与各项临床指标的相关性
股骨颈骨密度与损伤病程呈负相关,与BMI、PINP 呈正相关(P<0.05)。全髋骨密度与损伤病程呈负相关,与BMI、ALP呈正相关(P<0.05)。见表10。
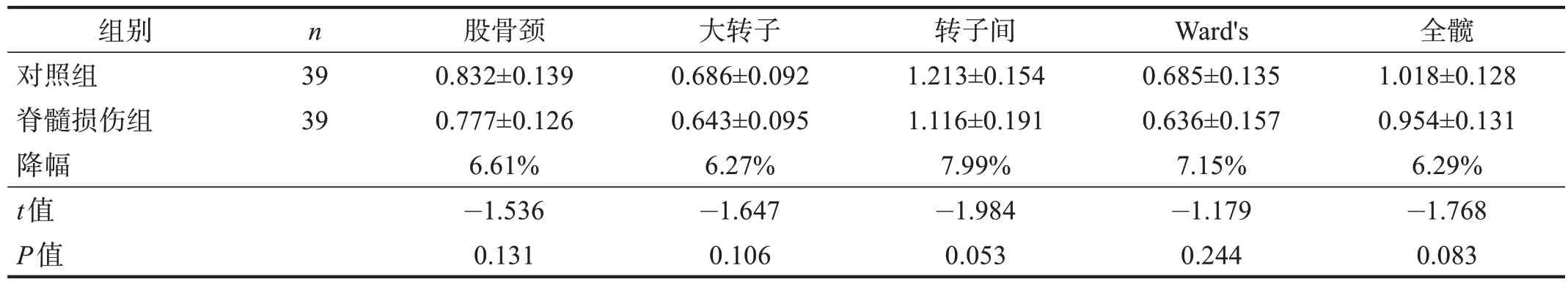
表3 损伤3个月内两组股骨近端骨密度的比较(g/cm2)
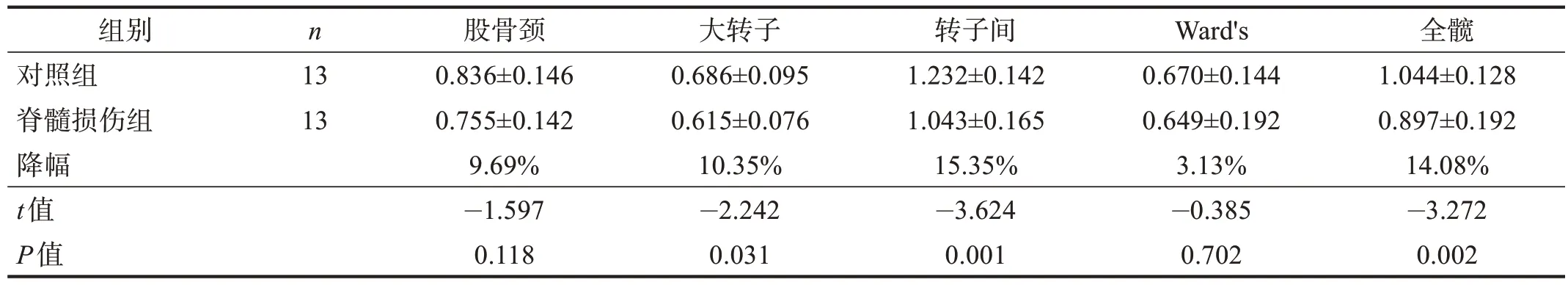
表4 损伤3~6个月两组股骨近端骨密度的比较(g/cm2)
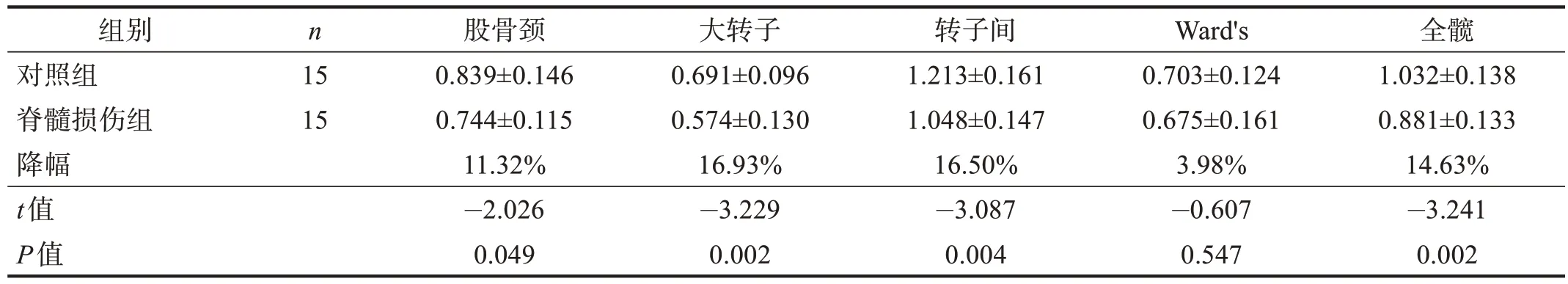
表5 损伤6~12个月内两组股骨近端骨密度的比较(g/cm2)
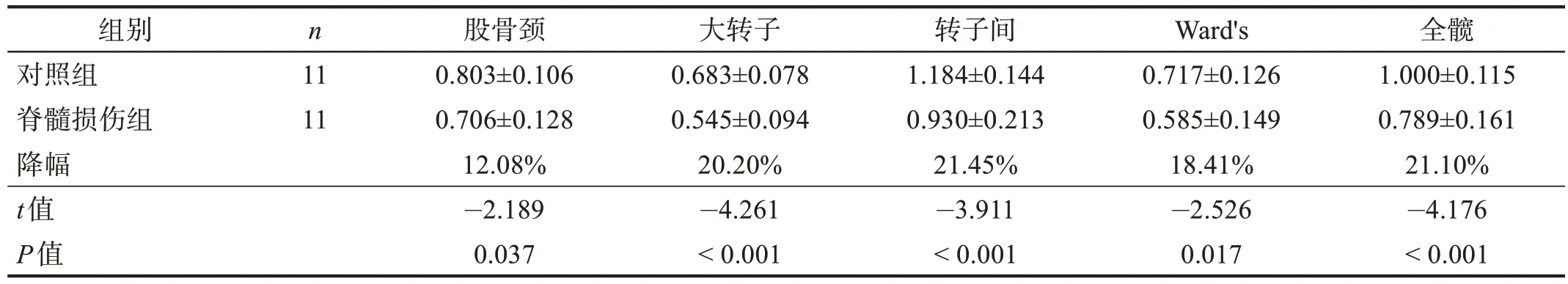
表6 损伤12~24个月两组股骨近端骨密度的比较(g/cm2)
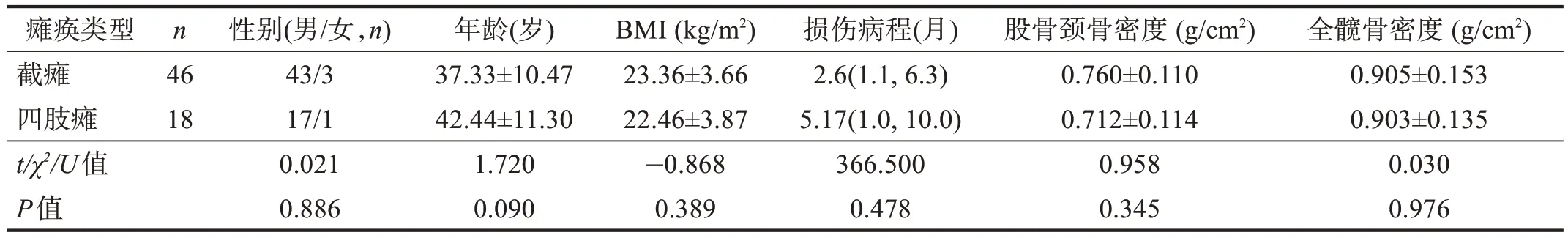
表7 不同瘫痪类型骨密度的比较
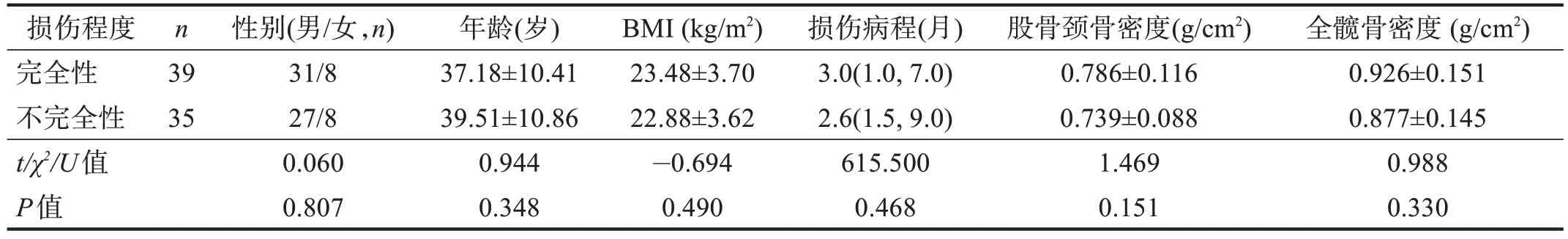
表8 不同损伤程度骨密度的比较
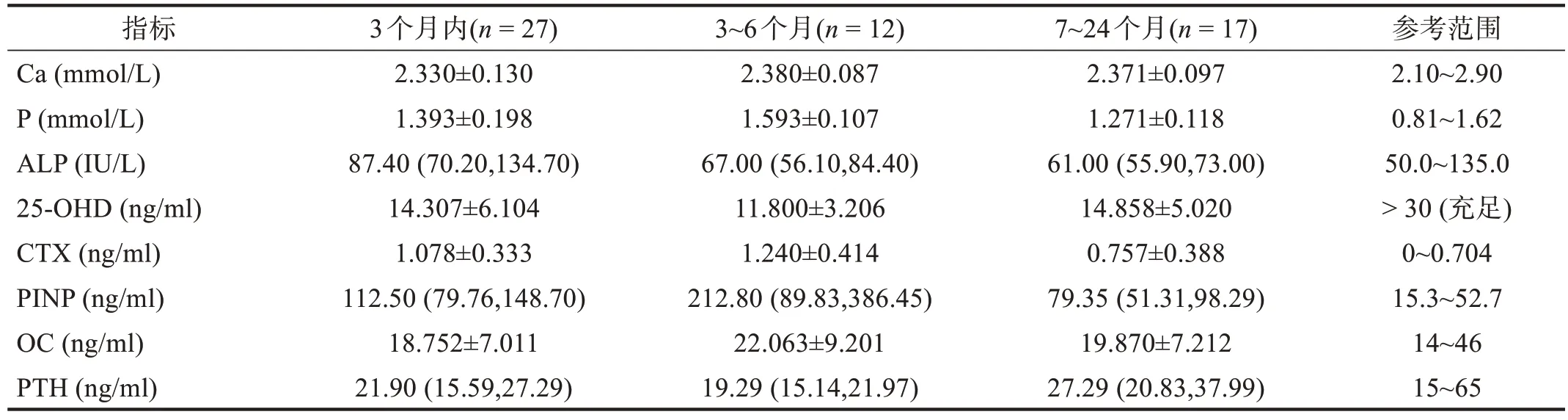
表9 不同损伤病程脊髓损伤患者的骨代谢指标比较
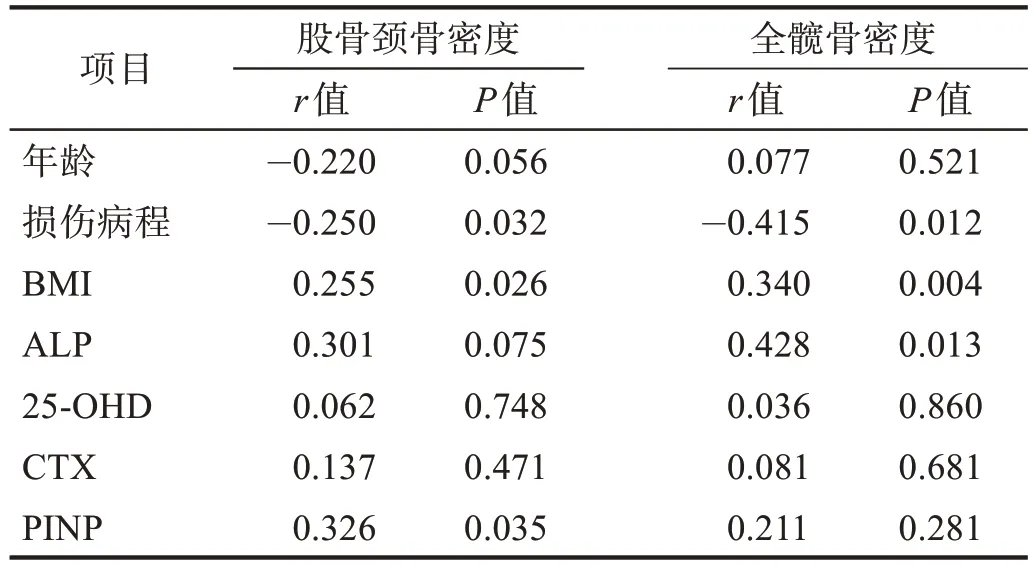
表10 股骨颈、全髋骨密度与各项临床指标的相关性
3 讨论
与其他常见的快速骨质流失情况相比,急性脊髓损伤后极其快速的骨流失率显著高于绝经后骨质疏松症、长期卧床休息和太空飞行[15-17]。既往研究证实[18],脊髓损伤患者的骨量流失主要发生在下肢,而腰椎不受影响。脊髓损伤1 年内骨丢失迅速,2~3 年达到新的稳态水平,而此时与正常人群相比,骨流失已达50%,随后的骨量丢失则趋于缓慢[19-20]。因此了解脊髓损伤1~2 年内的骨丢失特点,在最初的快速骨质流失期及时干预和监测,对于维持脊髓损伤患者的长期骨健康尤为重要。
Maïmoun等[18]研究发现,7例伤后3个月的脊髓损伤患者股骨近端骨密度与对照组无明显差异。Roberts等[6]研究发现,11 例脊髓损伤患者伤后8 周、24 周股骨颈骨密度无明显变化。Dauty 等[21]对31 例损伤1 年以上脊髓损伤患者的研究发现,在股骨颈、转子间分别出现30%、39%的骨密度下降。以上国外研究病例数较少,而国内尚未发现对脊髓损伤1~2 年内不同损伤时期骨密度变化的研究。
本研究显示,脊髓损伤3 个月内股骨近端骨密度与对照组均无差异,与国外研究一致。伤后3~6 个月始出现全髋骨密度的下降,伤后6~12个月股骨颈、全髋骨密度明显下降,伤后12~24 个月股骨近端各部位骨密度均显著低于对照组,且骨密度降幅随损伤时间的延长而升高,损伤1 年以上患者的骨密度降幅明显高于损伤1年内的患者。
本研究还显示,股骨颈、全髋骨密度与损伤病程呈负相关,提示脊髓损伤持续时间越长,骨密度下降越明显。脊髓损伤1 年以上的患者已经历相当大程度的骨丢失,此时再进行干预和监测必定为时已晚。虽然在伤后3个月内单纯通过DXA可能无法检测到骨密度的变化,但早期测定对于确定基础骨密度仍有必要,且相对偏低的骨密度值可能提示废用性骨质疏松症的易感性。大多数脊髓损伤患者骨折通常在伤后2年或更长时间发生,因此在损伤1 年内的早期干预可能会降低患者未来的骨折风险[4]。
国外多项研究显示[18,21-23],急慢性脊髓损伤,截瘫和四肢瘫,完全性损伤和不完全性损伤,患者骨密度均无明显差异,并证实刺激骨转换的最重要因素是对骨骼机械应力的变化,而与病变神经节段和损伤严重程度无关。国内尚未见相关研究报道。
本研究显示,瘫痪类型和损伤严重程度对脊髓损伤患者的股骨近端骨密度值没有明显影响,与国外研究结果一致。由于不同研究人群的异质性,目前可能无法准确判定病变水平及不同程度损伤患者骨密度演化的差异。未来需更大样本量、更细化的分层研究来进一步明确。
本研究对脊髓损伤患者骨代谢标记物的分析显示,CTX、PINP 在各损伤病程均高于参考范围上限,伤后3个月内即升高,3~6个月达高峰,7个月后开始下降,7~24 个月基本达到稳态。国外有研究发现[6],从伤后的第1周开始,骨吸收标志物即开始上升,10~16 周左右达到峰值,6 个月尚未恢复至基线水平。一项纵向观察显示[13],脊髓损伤患者的骨转换指标显著升高,在伤后3 个月达到最高水平,6 个月后开始下降。本研究表明在骨密度出现变化之前,骨转换指标均升高,与既往研究一致。持续和显著升高的骨转换指标证实脊髓损伤急性期的高骨转换率,有助于早期发现和评估骨丢失。本研究显示,在患者伤后3 个月内骨流失的早期阶段,DXA 无法检测到骨密度的变化,而骨代谢标志物在脊髓损伤早期的敏感和快速反应提示它们可作为骨质疏松风险评估的指标,故应尽早进行骨代谢指标的评估和监测,以早期识别骨质疏松高风险的患者。
本研究显示,股骨颈和全髋骨密度与BMI呈正相关,提示低体质量患者更容易出现骨量流失。全髋骨密度、股骨颈骨密度分别与ALP、PINP 呈正相关,ALP、PINP反映骨形成,提示骨形成相对较好的患者可能具有更高的骨密度。脊髓损伤后的骨质疏松为高转换性,骨形成试图弥补急性期的骨丢失[24]。通过物理治疗或药物治疗来促进骨形成,提高成骨细胞活性,与抑制骨吸收等方案联合治疗可能会带来更好的效果。
维生素D 对机体骨代谢起着重要的调节作用,维生素D 缺乏可破坏机体的钙磷平衡,引起骨骼的矿化障碍,导致跌倒和骨折风险升高。既往多项国外研究在急性和慢性脊髓损伤患者中都观察到25-OHD缺乏,发生率33%~93%[25-27]。本研究脊髓损伤患者25-OHD缺乏者占87.5%,明显高于中国北京地区健康体检人群25-OHD 缺乏的占比(48.1%)[28]。有研究显示[29],对脊髓损伤患者进行维生素D 补充可有效提高血清25-OHD水平。结合本研究结果,建议对脊髓损伤患者早期补充维生素D制剂,从而预防进一步的骨丢失。
本研究的优势是纳入了脊髓损伤2 年内的患者,并按不同损伤病程分组,更能体现脊髓损伤早期不同阶段相关的骨丢失模式和特点。并且我们的样本人群代表了绝大多数脊髓损伤患者的特征,即超过70%为男性,约50%~70%的病例发生在15~35 岁的人群中[30]。本研究的局限是缺少纵向观察的样本,作为这项工作的扩展,未来需要涵盖更多样本量的前瞻性纵向研究来观察脊髓损伤患者骨密度和骨代谢指标变化的趋势和特点。
综上所述,脊髓损伤2 年内患者股骨近端骨密度在伤后3 个月内无变化,伤后6 个月之后出现明显下降,伤后1~2 年下降幅度最明显。股骨颈和全髋骨密度与损伤病程呈负相关,与BMI呈正相关。骨转换指标于各损伤病程均高于参考范围上限,伤后3 个月内即升高,3~6 个月达高峰,7~24 个月下降至稳态。脊髓损伤患者维生素D 缺乏率相当高。无论病变水平和严重程度如何,均应尽早对脊髓损伤患者进行骨代谢标记物和骨密度的检测,二者结合是早期评估骨质疏松风险,以及后续监测干预疗效的重要手段。建议在伤后早期、骨流失变得更严重之前的时间窗内进行必要的干预,以延缓脊髓损伤患者废用性骨质疏松的发生发展。
利益冲突声明:所有作者声明不存在利益冲突。

