柱前衍生高效液相色谱法测定灵芝孢子粉中氨基酸的含量
殷娇阳,阎 姝,田书霞
灵芝为多孔菌科真菌赤芝或紫芝的干燥子实体,灵芝药用在我国已有几千年的历史,被历代医药家视为滋补强壮、扶正固本的神奇珍品[1]。中医四大经典著作之一的《神农本草经》将灵芝归属为上品药,称其“主养命以应天,无毒,多服久服不伤人”[2-3]。亦在《本草纲目》中记载:“灵芝性平,味苦,无毒,主胸中结,益心气,补中,增智慧,不忘,久服轻身不老,延年神仙”。灵芝对心、肝、脾、肺、肾等具有补益作用,其子实体、孢子粉均可入药[4]。灵芝孢子粉是灵芝在生长期释放出来的咖啡色的种子去壁后制得,经研究证实,灵芝孢子粉具有灵芝的全部遗传物质,药用价值远高于灵芝的子实体[5-6]。近年来,随着现代孢子体破壁技术的不断发展,灵芝孢子粉的研究与应用取得了长足的进步。现代研究发现灵芝孢子粉具有增强机体免疫力[7],调节血糖[8],控制血压[9],清除自由基,抗衰老[10],抗肿瘤[11]等功效。灵芝孢子粉的有效成分包括灵芝多糖、三萜类、核苷类和多种氨基酸等,研究者对灵芝生物活性成分的研究已经持续了数十年,其中大部分集中在三萜酸和多糖上[12-14],而中药发挥作用具有多成分多靶点的特点,仅通过一两个指标的检测并不能全面反映其整体质量。灵芝孢子粉这类滋补型中药氨基酸含量十分丰富,并且氨基酸作为组成蛋白质的基本单元,是治疗疾病和滋补营养的主要成分,在提高人体免疫力,促进消化吸收,补充大脑营养,延缓衰老等方面发挥着重要作用[15-16]。因此,测定灵芝孢子粉中氨基酸的种类和含量对灵芝孢子粉的开发和利用具有十分重要的意义,同时氨基酸的含量测定可以使药品有效性控制进一步完善,质量评价时应多考察该指标成分。
目前,灵芝孢子粉中氨基酸含量的研究分析仍处于初级阶段,仅有几篇通过氨基酸分析仪测定灵芝孢子粉中氨基酸含量的报道,而氨基酸分析仪价格昂贵,结构复杂,分析时间长,仪器的专属化致其应用较为局限[17]。近年来,随着氨基酸衍生化技术和检测器的不断发展,高效液相色谱(HPLC)检测结果的准确度和精确度都有了很大的提高和改善,成为目前使用最为广泛的检测方法。本研究采用邻苯二甲醛(OPA)和9-氯甲酸芴甲酯(FMOC)联用柱前衍生高效液相色谱法,可同时检测一级氨基酸和二级氨基酸,且衍生试剂OPA与FMOC和氨基酸在30 s内即可反应生成具有强烈紫外吸收的衍生物,可实现高效液相色谱仪自动化在线衍生检测,该方法不仅反应速度快,操作简单,灵敏度、准确度也较高,且未见此法在灵芝孢子粉氨基酸测定中的应用。一些研究表明,OPA-FMOC在线衍生方法只适合低浓度的氨基酸样品含量的测定,可能存在衍生试剂反应量不足等现象[18],而在灵芝孢子粉的含量测定中,精密度、重复性、稳定性、加样回收率实验,二级衍生化氨基酸结果均较好,可以为灵芝孢子粉中氨基酸的质量评价提供新方法。
1 材料与方法
1.1 仪器与试剂药材 Agilent 1100高效液相色谱仪(配备G1379A在线脱气机,G1311A四元梯度泵,G1313A自动进样器,G1316A柱温箱,G13158B DAD检测器,Agilent色谱工作站);BP211D十万分之一天平(德国赛多利斯公司);KQ-700GDV超声波清洗器(昆山市超声仪有限公司);DHG101-4A电热恒温鼓风干燥箱(上海予华仪器设备有限公司)。氨基酸对照品:天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr)、精氨酸(Arg)、丙氨酸(Ala)、酪氨酸(Tyr)、胱氨酸(Cys-Cys)、缬氨酸(Val)、甲硫氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、赖氨酸(Lys)、脯氨酸(Pro)、OPA、FMOC及3-巯基丙酸均购自美国Sigma公司,纯度≥98%。乙腈、甲醇(北京Dikma公司),其他均为国产分析纯。去壁灵芝孢子粉(浙江寿仙谷医药股份有限公司),水为超纯水。
1.2 溶液的制备
1.2.1 试剂的制备 1)40% NaOH溶液配制:取NaOH 10 g,加水溶解并稀释至25 mL。2)0.4 mol/L pH值10.4的硼酸盐缓冲液:取硼酸约2.473 g,溶于100 mL水中,加NaOH溶液调至pH值为10.4±0.1。3)OPA衍生化试剂:约8 mg OPA,加入0.4 mol/L硼酸盐缓冲液0.7 mL,加乙腈0.1 mL,3-巯基丙酸12.5 μL,混匀,过滤,4 ℃保 存 备 用。4)FMOC衍 生 试 剂:取FMOC 10 mg,加2 mL乙腈溶解即得,4 ℃保存备用。5)空白溶液:0.1 mol/L盐酸溶液。
1.2.2 混合对照品溶液 精密称取17种氨基酸对照品各100 mg(必要时需折算),分别置于10 mL量瓶中,用配置好的0.1 mol/L盐酸溶液溶解并定容至刻度,摇匀,制得各单一成分对照品储备液。准确移取各对照品储备液适量,用0.1 mol/L盐酸溶液稀释并定容至50 mL量瓶中,作为混合对照品储备液,天冬氨酸、谷氨酸质量浓度为0.42 mg/mL,精氨酸、丙氨酸和缬氨酸质量浓度为0.24 mg/mL,组氨酸、酪氨酸和苯丙氨酸为0.08 mg/mL,胱氨酸为0.02 mg/mL,其余8种氨基酸的质量浓度为0.16 mg/mL。精密量取混合对照品储备液2 mL置10 mL量瓶中,加0.1 mol/L盐酸至刻度,摇匀,即得混合对照品溶液。
1.2.3 供试品溶液 取样品粉末约100 mg,精密称定,置于耐压试管中,加6 mol/L HCI溶液10 mL,超声15 min,封口,置150 ℃的烘箱中水解1 h,取出冷却至室温,用去离子水无损转移到25 mL容量瓶中,过滤,弃去初滤液。精密量取续滤液2 mL置蒸发皿中,水浴蒸干,用去离子水洗涤3次,蒸干,准确加入1 mL的0.1 mol/L HCL溶液,充分溶解,用0.22 μm针头滤器滤过,取续滤液上机分析。
1.3 色谱条件 色谱柱:Advance Bio AAA(100 mm×4.6 mm,2.7 μm),流动相A为0.01 mol/L磷酸氢二钠和0.01 mol/L硼酸钠溶液,用盐酸调pH值为8.2±0.1,流动相B为甲醇∶乙腈∶水(45∶45∶10)。流速0.8 ml/min,柱温45 ℃,进样量10 μL,检测波长为338 nm和262 nm。自动进样程序:1)从瓶1吸取样品1 μL;2)从瓶2(水)吸取0 μL;3)从瓶3吸取1 μLOPA;4)从瓶2(水)吸取0 μL;5)将2 μL混合到针座中,10次;6)等待0.2 min;7)从瓶4吸取1μL FMOC;8)从瓶2(水)吸取0 μL;9)将3 μL混合到针座中,10次,等待0.2 min;10)从瓶5吸取稀释液(流动相A)7 μL;11)将10 μL混合到针座中,10次;12)等待0.2 min;13)进样。梯度洗脱程序:0~3 min,0%~1%B;3~40 min,1%~40% B ;40~50 min,40%~100% B ;50~55 min;100% B,55~60 min;100%~0%B。
2 结果
2.1 专属性试验 按自动进样程序精密吸取混合对照品溶液、供试品溶液及空白溶液,在“1.3”项色谱条件下分别注入色谱仪,得相应色谱图,见图1。在上述色谱条件下,天冬氨酸、谷氨酸、丝氨酸、组氨酸、甘氨酸、苏氨酸、精氨酸、丙氨酸、酪氨酸、胱氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、异亮氨酸、亮氨酸、赖氨酸、脯氨酸均达到基线分离,各成分之间无干扰。
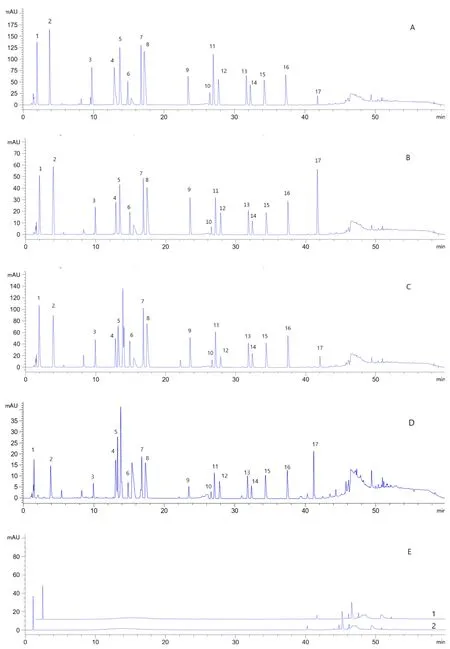
图1 混合对照品(A.338nm,B.262nm)、样品(C.338nm,D.262nm)、阴性对照(E1:338nm,E2:262nm)色谱图
2.2 线性关系考察 精密量取混合对照品储备液0.5、1.0、2.0、3.0、4.0、6.0 mL,分别用0.1 mol/L盐酸定容于10 mL量瓶中,摇匀,即得系列混合对照品溶液。按“1.3”项的色谱条件对上述系列混合对照品溶液进行测定,并绘制出横、纵坐标分别为对照品进样浓度X(μg/mL)和峰面积Y的标准曲线,得回归方程、相关系数(r)及线性范围见表1。

表1 17种氨基酸的线性关系
2.3 精密度考察 精密吸取混合对照品溶液,按“1.3”项下色谱条件连续进样6次进行测定,记录6次的峰面积并计算相对标准偏差(RSD)值,测得17种氨基酸峰面积的RSD值在1.14%~2.85%之间,均小于3.0%,说明该仪器精密度良好。
2.4 稳定性考察 取灵芝孢子粉的供试品溶液,分别于配制后0、2、4、8、12、24 h 按 “1.3”项下色谱条件进行液相分析,测得17种氨基酸峰面积的RSD值在1.87%~2.89%之间,均小于3.0%,说明供试品溶液在24 h内保持稳定。
2.5 重复性试验 取同一批次的灵芝孢子粉样品100 mg,6份,精密称定,按“1.2.3”项下方法分别制备供试品溶液,按“1.3”项下色谱条件进行测定,17种氨基酸的RSD值在1.43%~2.67%之间,重复性较好。
2.6 加样回收率考察 精密称取已知含量的6份灵芝孢子粉样品100 mg,分别置于15 mL的耐压试管中,再对应加入2 mL混合对照品储备溶液,按“1.2.3”项下方法制备所需溶液,按“1.3”项下色谱条件进行测定,记录得到的色谱图和17种氨基酸的峰面积,计算回收率以及含量的RSD,结果见表2,表明该方法加样回收实验结果良好。
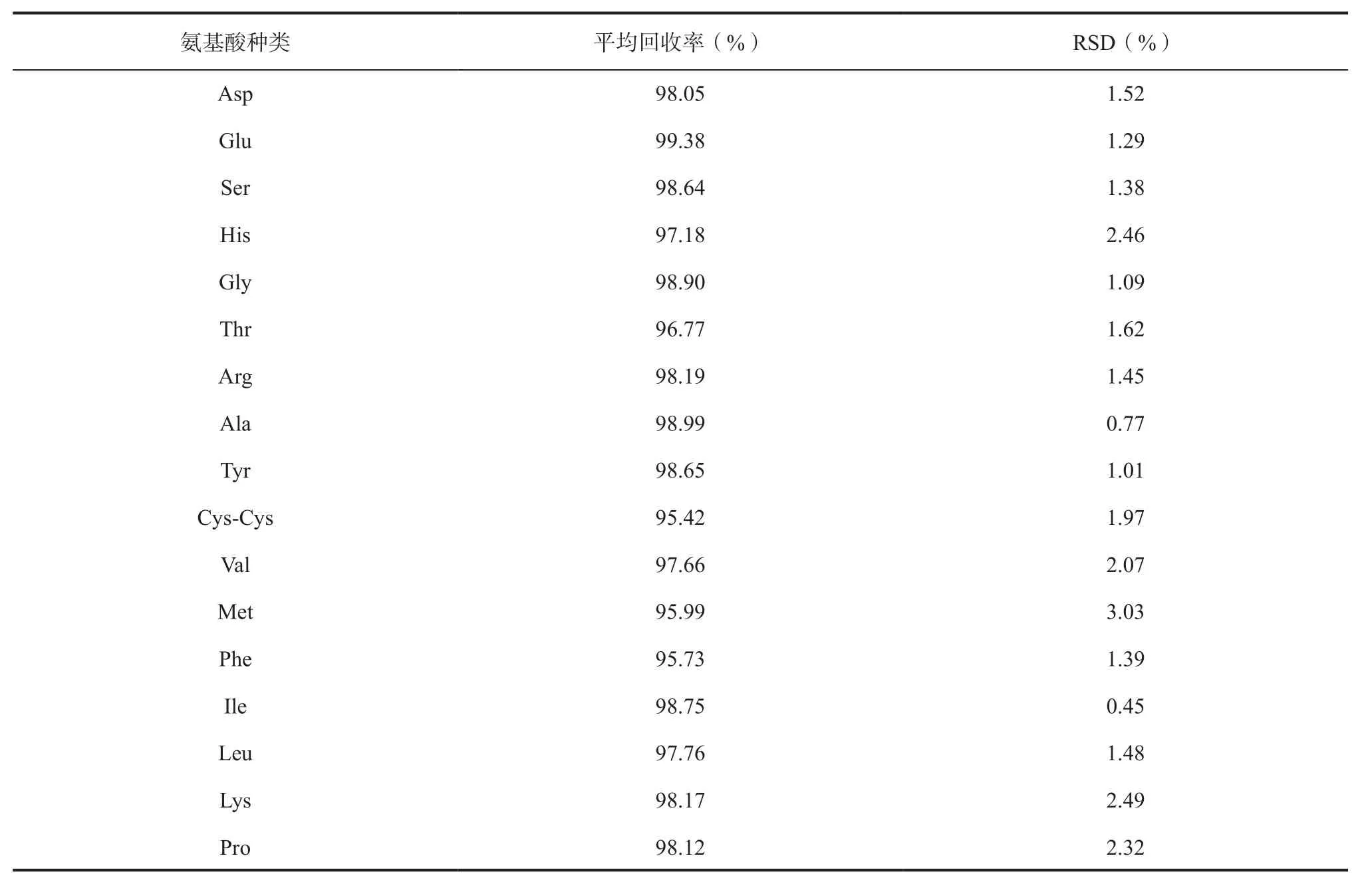
表2 17种氨基酸加样回收实验结果(n=6)
2.7 样品含量测定 取3个批号的灵芝孢子粉样品100 mg,按“1.2.3”项下方法分别制备供试品溶液,按“1.3”项下色谱条件进行测定,以外标法计算样品含量,结果见表3。

表3 17种样本含量测定结果
3 讨论
3.1 样品水解条件的考察 蛋白质在高温酸性的条件下水解为氨基酸,反应较为激烈,水解前进行超声,可有效帮助样品被盐酸溶液润湿,使水解充分,某些不稳定氨基酸,色氨酸会被完全破坏,苏氨酸、丝氨酸和甲硫氨酸会因功能基团被破坏而显著减少[19-20]。在处理样品时抽真空充氮气的目的是赶走氧气,防止氨基酸被氧化,有相关研究表明,氧气会使含硫氨基酸(甲硫氨酸和胱氨酸)生成多级氧化产物,有一定的损失率,其他氨基酸无明显影响,不过因为酸水解方法有剧烈的反应条件,对甲硫氨酸和胱氨酸含量的测定本身也是不准确的[21],故本实验选择了不充氮气,简化了操作步骤。参考文献[22]和氨基酸水解的国标法GB7649-87,在本实验条件下,分别比较了在150 ℃烘箱中水解1 h和在110 ℃烘箱中水解22 h的测定结果,前者测定出来的氨基酸含量比后者要高,所以选定150 ℃水解1 h的水解条件,不仅测定结果准确,还节约了测定时间。
3.2 衍生化方法的选择 大多数的氨基酸无紫外吸收和荧光发射特性,为提高分析检测的灵敏度,需采用衍生化技术,目前应用较广泛的衍生化试剂有异硫氰酸苯酯(PITC)、OPA、2,4-二硝基氟苯(FDNB)和 FMOC等[23]。其中OPA适用于衍生一级氨基酸,FMOC衍生二级氨基酸,联用OPA-FMOC可同时检测一级和二级氨基酸,反应速度快,产物单一、稳定,适用于自动化在线衍生,比离线衍生法操作简单,与紫外检测器结合有较高的灵敏度,故本文采用OPA-FMOC联用法进行柱前衍生。
3.3 波长的选择 OPA试剂衍生一级氨基酸所得的衍生产物在338 nm处具有最大吸收度值,FMOC衍生二级氨基酸(脯氨酸)在262 nm处具有最大吸收度值,故本实验分别在338 nm和262 nm波长下检测氨基酸衍生产物,在一定范围内其吸光度值与氨基酸浓度成正比,可准确测定各氨基酸含量。
3.4 流动相、梯度、柱温的优化 由于氨基酸同时带有氨基和羧基,所以氨基酸是两性物质,流动相的pH值会影响氨基酸的解离分离过程,在流动相pH值为6.8和7.5时,氨基酸整体分离效果不佳,而在过碱性的条件下会使色谱峰拖尾,且对氨基酸柱有较大的损伤,为了使流动相的pH值在合适的范围内,本实验选用了磷酸氢二钠-硼酸钠缓冲溶液,在用盐酸调节pH值为8.2±0.1时,氨基酸分离效果较好。
等度洗脱流动相的极性是不变的,分离全部氨基酸需要较长的时间,分离效果也不好。梯度洗脱流动相的极性是变化的,有利于复杂物质的分离,梯度洗脱还能缩短分离时间,提高分离度,改善峰形等。当流动相B的浓度增加过快时,会使各氨基酸保留时间缩短,但会造成组氨酸和甘氨酸,苯丙氨酸和亮氨酸的色谱峰分不开,经多次实验优化,当浓度梯度为0~3 min,0%~1% B;3~40 min,1%~40% B ;40~50 min,40%~100% B ;50~55 min,100% B;55~60 min,100%~0% B 条件时,17种氨基酸能有效分离,满足实验要求。
本研究考察了35 ℃,40 ℃ 和 45 ℃的柱温对17种氨基酸分离结果的影响,结果显示,35 ℃和40 ℃对组氨酸和甘氨酸,精氨酸和丙氨酸的分离情况不稳定,色谱峰有较大重叠,并且难以通过调整流动相比例实现分离,说明柱温对氨基酸的分离效果有较大影响,而45 ℃时可稳定分离,且分离度符合要求,所以最终选择45 ℃进行分离。
本实验建立了柱前衍生高效液相色谱法测定灵芝孢子粉中17种氨基酸含量的方法,该方法操作简便,测定全面、准确,重复性好,成本价格低廉。结果显示该方法学验证结果符合《中国药典》2015年版中质量分析方法验证指导原则(四部 9101)的要求,该方法适用于灵芝孢子粉中氨基酸的含量测定及质量控制。

