脂源性细胞因子对人脂肪细胞miR-506 表达的调控影响
秦振英 仲逢钰 陈 瑶 李 婧 杨 梓 文 娟 王玉美 胡幼芳
1.南京医科大学第一附属医院,江苏省妇幼保健院儿童保健科,江苏南京 210036;2.南京医科大学第一临床医学院,江苏南京 210029;3.南京医科大学附属妇产医院医学研究中心,江苏南京 210004;4.扬州大学医学院附属淮安市妇幼保健院新生儿疾病筛查科,江苏淮安 223302
近年来,超重/肥胖发生率逐年上升[1],呈明显低龄化趋势,不仅影响儿童生长发育,且成年后罹患多种代谢性疾病的风险也相应增加[2]。作为机体重要的代谢储能器官,脂肪组织还可分泌诸多炎症因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、抵抗素、脂连素、白细胞介素-6(interleukin-6,IL-6)等[3],加之后天静坐少动、膳食结构改变等环境因素影响[4],造成脂肪组织过多异常积聚,脂源性细胞因子的分泌及作用出现异常,诱发了肥胖相关胰岛素抵抗的发生并加剧其进展[5]。
微小RNA(miRNA),一类新型内分泌因子,通过抑制翻译或降解靶标mRNA 对基因表达进行调控,参与能量代谢调节[6]、胰岛素抵抗[7-8]、肿瘤发生[9]等病理生理过程。本研究小组前期发现,miR-506 在正常与肥胖患者脂肪组织中差异表达,进一步生物信息学及靶基因富集分析发现,miR-506 与胰岛素抵抗、脂肪细胞因子、胰腺癌等多个信号转导通路有关。而目前有关miR-506 主要集中于肿瘤性疾病的研究[10-11]。本研究拟探讨脂源性炎症因子(TNF-α、IL-6)对人脂肪细胞中miR-506 表达的调控作用,为阐明其在肥胖相关胰岛素抵抗和炎症反应中的作用提供理论依据。
1 材料与方法
1.1 细胞系
人前体脂肪细胞系(HPA-v),购自美国Science Cell 公司。
1.2 脂肪细胞培养及诱导分化
人前体脂肪细胞,在37℃、5%CO2孵箱(美国Thermo Fisher Scientific 公司)中培养,以含5%胎牛血清的人脂肪细胞培养基(美国Science Cell 公司,No.7211)培养人脂肪前体细胞,按1×105个/mL 密度接种于6 孔板中,待细胞贴壁生长至完全融合并使细胞接触抑制48 h 后开始诱导分化,培养液换用含3-异丁基-1-甲基黄嘌呤(MIX,美国Sigma 公司,No.I7018)0.5 mmol/L、地塞米松(美国Sigma 公司,No.50-02-2)1 μmol/L、胰岛素(美国Sigma 公司,No.I2643)5 μg/mL 和罗格列酮(美国Sigma 公司,No.R2408)1 μmol/L 的DMEM/F12的无糖培养基(美国Gibco 公司,No.12400-024)。培养4 d 后换用含5 μg/mL 胰岛素的DMEM/F12 无糖培养基继续培养,每3 天换液1 次,直至第15 天,采用油红“O”(美国Sigma 公司,No.O8010)染色法验证分化成熟度。
1.3 实时荧光定量多聚核苷酸链式反应(qRT-PCR)技术检测人成熟脂肪细胞中miR-506 的表达情况
将人脂肪前体细胞接种于6 孔板中,诱导分化为成熟脂肪细胞。细胞于实验前1 d 更换为无血清无糖的DMEM/F12 培养基饥饿刺激过夜,后分别以含浓度为10、30 ng/mL 的TNF-α(美国Sigma 公司,No.T6674)、IL-6(美国Sigma 公司,No.KX-GMP-027)的DMEM/F12 无糖培养基干预0、4、8、24 h。分别收取各时间点不同浓度的脂肪细胞,-70℃冰箱冻存备用。具体如下:Trizol(美国Invitrogen 公司,No.15596026)法提取脂肪细胞中总RNA,按照逆转录试剂盒(日本TAKARA 公司,No.RR037A)说明书进行逆转录,所用引物序列由广州锐博生物技术有限公司提供。采用SYBRGreen PCR 试剂盒(美国KAPA Biosystems 公司,No.KK4601)定量扩增体系进行反应。反应总体积10 μL:cDNA 1 μL,引物0.5 μL,SYBR Primix Ex TaqTM2 μL,加RNase H2O 至10 μL。其中PCR 扩增条件:50℃预变性20 min,95℃变性2 min,95℃15 s,60℃60 s,40 个循环。应用2-△△CT方法计算表达量。分别与0 h比较,计算药物干预4、8、24 h 后miR-506 的相对表达量。所有实验均独立重复操作至少3 次。
1.4 统计学方法
采用GraphPad Prism 8 及SPSS 22.0 统计学软件进行数据分析,计量资料数据用均数±标准差()表示,两组间比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 人脂肪细胞分化过程中形态学的变化
显微镜下见人脂肪细胞中脂滴丰富,约85%以上的细胞分化成熟,提示本实验诱导分化方案切实可行。见图1。
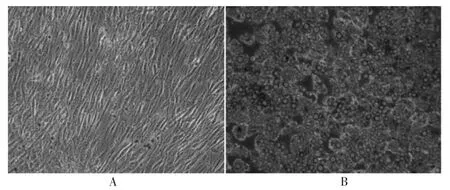
图1 人脂肪细胞分化形态图(200×)
2.2 人脂肪细胞分化过程中miR-506 的表达情况
qRT-PCR 结果显示,分化成熟脂肪细胞中miR-506 表达量高于前体脂肪细胞,差异有高度统计学意义(t=8.07,P <0.01)。见图2。
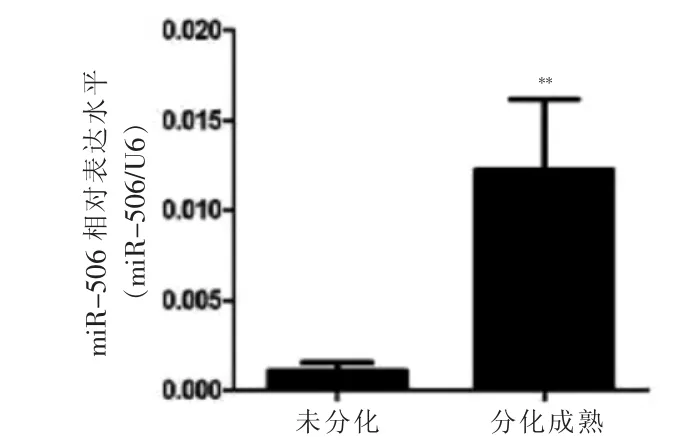
图2 人脂肪细胞分化过程中miR-506 的表达情况
2.3 TNF-α 作用时间及浓度变化对人脂肪细胞miR-506表达水平的影响
10 ng/mL 的TNF-α 干预成熟人脂肪细胞4、8、24 h miR-506 表达量与干预0 h 比较,差异无统计学意义(P >0.05)。30 ng/mL 的TNF-α 干预成熟人脂肪细胞24 h miR-506 表达量高于干预0 h,差异有统计学意义(t=3.42,P <0.05)。见图3。
2.4 IL-6 作用时间及浓度变化对人脂肪细胞miR-506 表达水平的影响
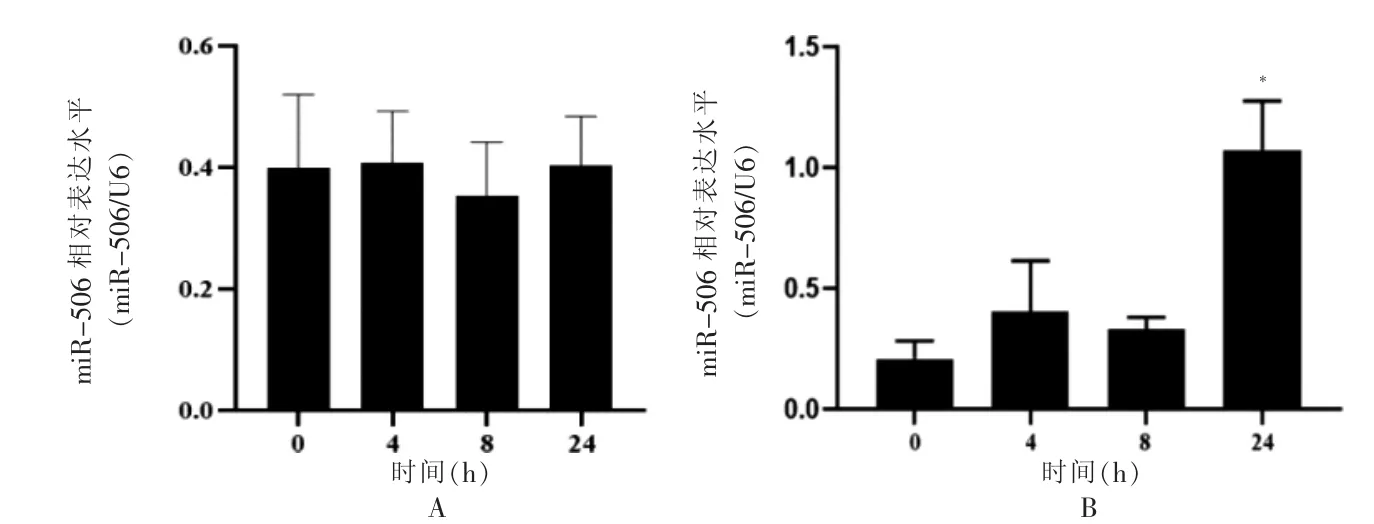
图3 TNF-α 作用时间及浓度变化对人脂肪细胞miR-506 表达水平的影响
10 ng/mL 的IL-6 干预成熟人脂肪细胞4、8、24 h miR-506 表达量与干预0 h 比较,差异无统计学意义(P >0.05)。30 ng/mL 的IL-6 干预成熟人脂肪细胞24 h miR-506 表达量高于干预0 h,差异有统计学意义(t=2.91,P <0.05)。见图4。
3 讨论

图4 IL-6 作用时间及浓度变化对人脂肪细胞miR-506 表达水平的影响
肥胖症是由于长期能量摄入超过机体消耗,导致体内脂肪过度异常积聚的一种常见的营养障碍性疾病。研究显示[5,12-13],肥胖时脂肪组织分泌的TNF-α、IL-6 等细胞因子介导的慢性炎症是引起肥胖相关胰岛素抵抗、代谢综合征等相关疾病的重要因素。肥胖及其相关疾病病因机制复杂,近年来诸多研究显示,肥胖、胰岛素抵抗及miRNA 之间有着密切的联系[6-8,14]。
miRNA 是真核生物体内发现的一类高度保守且具有调控功能的非编码RNA 分子。有文献综述显示[14],与正常对照组比较,肥胖患者循环中有33 个miRNA表达异常,进一步生物信息学分析显示这些miRNA相关靶基因功能涉及脂肪酸的代谢以及胰岛素的信号传导。Cui 等[15]筛选了肥胖儿童及2 型糖尿病成年患者循环中数个差异表达的miRNA 并在肥胖及胰岛素抵抗模型小鼠中进行验证后发现,miR-486、miR-146b、miR-15b 可作为预测肥胖儿童成年后发生2 型糖尿病风险的标志物。本研究小组前期实验发现,miR-506 在肥胖患者脂肪组织中差异表达,进一步细胞学实验发现,成熟人脂肪细胞中miR-506 表达明显高于前体脂肪细胞;且靶基因富集分析显示,miR-506与胰岛素抵抗、脂肪细胞因子等多个信号通路有关,提示其可能与肥胖及肥胖相关胰岛素抵抗有关。本研究拟探讨脂源性细胞因子(TNF-α、IL-6)刺激诱导脂肪细胞胰岛素抵抗状态下miR-506 的表达情况。
人体脂肪组织是促炎细胞因子的主要来源之一,在肥胖及胰岛素抵抗个体中TNF-α、IL-6 水平明显升高,且与肥胖和胰岛素抵抗的程度相关[16-18]。TNF-α可直接抑制胰岛素信号转导通路中关键蛋白胰岛素受体底物-1(IRS-1)的酪氨酸磷酸化水平[19]、降低胰岛素敏感细胞膜上葡萄糖转运蛋白4 的表达水平[12],或间接抑制PI3K-AKT 胰岛素信号转导通路[20],最终导致胰岛素抵抗的发生。如分别以10、20 ng/mL 的TNF-α 干预96 h[12]和24 h[21],可引起3T3-L1 脂肪细胞胰岛素抵抗的发生。以TNF-α 干预成熟人脂肪细胞也可引起胰岛素抵抗相关miRNA 的表达异常[22-23]。综上,本研究以10、30 ng/mL 的TNF-α 干预成熟人脂肪细胞结果显示,10 ng/mL 的TNF-α 干预成熟人脂肪细胞4、8、24 h miR-506 表达量与干预0 h 比较,差异无统计学意义(P >0.05);30 ng/mL 的TNF-α干预成熟人脂肪细胞24 h miR-506 表达量高于干预0 h,差异有统计学意义(P <0.05)。IL-6 也是肥胖相关胰岛素抵抗发生的重要细胞因子,IL-6 慢性失衡可引起胰岛素受体及IRS-1 的磷酸化受损,或激活炎症信号通路交互抑制胰岛素的信号传导[13,24]。如20 ng/mL 的IL-6 处理脂肪细胞24 h 明显降低胰岛素刺激后IRS-1 酪氨酸磷酸化活性[19];亦有研究显示[25],100~200 ng/mL 的IL-6 可直接调控脂肪细胞中胰岛素受体信号转导相关的细胞因子抑制因子3 的表达,通过多种直接或间接途径影响胰岛素靶细胞正常发挥作用,从而引发胰岛素抵抗。30 ng/mL 的IL-6干预人脂肪细胞48 h 可通过调控相关miRNA 的表达来影响脂肪细胞胰岛素的敏感性[23]。本研究进一步以10、30 ng/mL 的IL-6 干预成熟人脂肪细胞,结果显示,10 ng/mL 的IL-6 干预成熟人脂肪细胞4、8、24 h miR-506 表达量与干预0 h 比较,差异无统计学意义(P >0.05);30 ng/mL 的IL-6 干预成熟人脂肪细胞24 h miR-506 表达量高于干预0 h,差异有统计学意义(P <0.05)。本研究结果提示miR-506 表达水平的变化可能与TNF-α、IL-6 诱导的炎症反应和胰岛素抵抗有关,为miR-506 进一步的功能研究提供理论依据。
肥胖与胰岛素抵抗密切相关,脂肪组织的慢性炎症是肥胖和胰岛素抵抗的中间桥梁。本研究结果初步提示,miR-506 的表达受到多种肥胖和胰岛素抵抗相关细胞因子的调控,可能与肥胖相关胰岛素抵抗的发生有关,具体机制有待进一步探讨。

