BMP-7联合TGF-β3在诱导间充质干细胞分化中的作用
左后东
(医学影像四川省重点实验室,川北医学院附属医院放射科,四川 南充 637000)
软骨损伤是一种多病因、多机制导致的慢性关节疾病,以关节疼痛、变形及功能障碍为主要表现,治疗不及时或治疗效果不理想,最终会发展为骨关节炎,严重影响患者的生活质量。研究[1]表明,关节软骨损伤是关节退变及骨性关节炎的始动环节。多种因素可导致关节软骨损伤,如年龄、肥胖、生活环境、不合理或过量运动等。值得注意的是,由于缺乏血管和神经,关节软骨一旦损伤则很难自行修复。目前软骨损伤治疗方法包括关节置换、软骨移植等[2],但这些治疗方法远期效果不甚理想,甚至会加重患者的痛苦。因此实现安全、可持续软骨修复的同时又能保持良好软骨功能特性就显得意义重大,这也是目前临床和患者的迫切需求。骨髓间充质干细胞(mesenchymal stem cells,MSCs)具有向多种细胞分化的潜能,其中包括软骨细胞转化[3]。研究[4-5]表明,骨形态生成蛋白(bone morphogenetic protein,BMP)及转化生长因子-β(transforming growth factor β,TGF-β)在软骨发生、成熟、再生、结构完整性、软骨内平衡等方面发挥关键作用。本研究拟通过BMP和TGF-β家族成员中的BMP-7和TGF-β3联合作用,探索其在体外诱导干细胞分化为软骨细胞和组织的作用。
1 材料与方法
1.1 材料
比格犬干细胞(Cat.No.CAXMX-01001,苏州赛业生物科技公司),完全培养基(Cat.No.CAXMX-90011,苏州赛业生物科技公司),BMP-7(Cat.No.HEOPP-02102,苏州赛业生物),TGF-β3(ab217402,abcam,UK),兔抗II型胶原蛋白抗体(15943-1-AP,Proteintech),CL594标记的山羊抗兔IgG抗体(SA00006-4,Proteintech)和比格犬软骨细胞(Cat No:DOG-iCell-s003,上海赛柏康)。
1.2 方法
1.2.1 干细胞的分化培养 在37 ℃、5%CO2和饱和湿度的条件下用购买比格犬干细胞提供的完全培养基培养比格犬干细胞。每2~3 d更换培养基,当细胞融合度达到80%左右进行传代。收集第四代干细胞,计数干细胞(约4×104个)并移到15 mL离心管。250 g(1 200 rpm)离心4 min,之后弃上清液,用0.5 mL完全培养基清洗沉淀细胞团2次。提前准备分化培养基,在完全培养基中按照比例分别加入10 ng/mL∶10 ng/mL、25 ng/mL∶25 ng/mL、50 ng/mL∶50 ng/mL、100 ng/mL∶100 ng/mL的BMP-7和TGF-β3制成低、中、高浓度的分化培养基,分别记为低浓度组、中低浓度组、中浓度组和高浓度组;未加入BMP-7和TGF-β3的培养基作为对照组。用0.5 mL新配置的分化培养基悬浮起沉淀细胞团,随后150 g(800 rpm)离心5 min,松开一圈离心管盖,放入37 ℃,5%CO2和饱和湿度的培养箱中培养。48 h后,轻轻弹动离心管底部,使细胞团重悬到培养基中,每2~3 d更换分化培养基。分别于7、14、21、28、35、42 d观察细胞团分化及成团情况。随后拍照、4%多聚甲醛固定、石蜡包埋、切片后检测。
1.2.2 HE染色 将组织切片置于63 ℃烤箱中烤片2 h,二甲苯脱蜡10 min×2次,梯度酒精(100%、95%、80%、70%)依次浸泡2 min,蒸馏水洗1 min,苏木精染色1 min,自来水洗1 min,1%盐酸酒精分化10 s,自来水洗1 min,1%氨水返蓝30 s,自来水洗1 min,伊红染色50 s,自来水洗1 min,梯度酒精(70%、80%、95%、100%)依次浸泡1 min,吹干,中性树胶封片。
1.2.3 阿利辛蓝色染色 诱导后的细胞切片经二甲苯脱蜡10 min×2次后,再经梯度酒精(100%、95%、80%、70%)依次浸泡2 min,蒸馏水洗1 min,吸去蒸馏水,滴加阿利辛蓝染液室温染色30 min。之后用蒸馏水清洗3次,镜下观察,内酸性粘多糖会被染成蓝色。
1.2.4 免疫荧光反应 诱导后的细胞切片脱水和脱蜡后,用PBS清洗3次,每次5 min。随后用10%FBS,0.25%Trition X-100 的PBS封闭2 h,弃封闭液后用1/100一抗(兔抗II型胶原蛋白抗体)孵育,4 ℃,过夜。弃一抗并用PBS清洗5 min。再加入1/500二抗 (CL594标记的山羊抗兔IgG抗体),室温避光孵育2 h。采用购买比格犬软骨细胞提供的培养基和方法培养比格犬软骨细胞,在24孔板底部放置盖玻片,每孔种植2×104个细胞,随后在37 ℃,5%CO2和饱和湿度的培养箱中培养6 h,制作成细胞爬片。细胞爬片按上述方法进行免疫荧光染色。
1.3 统计学分析
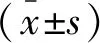
2 结果
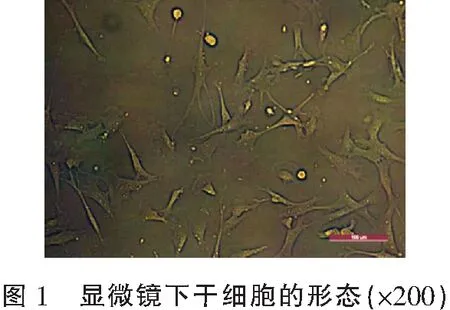
2.1 细胞生长及聚集情况
显微镜下所有干细胞生长情况良好,形态正常(图1)。对照组及不同浓度分化培养基培养的干细胞在第7天均未见细胞明显变化,在第14天,中浓度和高浓度组干细胞聚集成团,而对照组、低浓度组和中低浓度组干细胞分散在培养基中,未见聚集成团,在第21、28、35、42天,中浓度和高浓度组聚集成团的结构大小未见明显变化,呈乳白色胶状,结构更为紧密,且富有弹性,三组重复实验的结果显示高浓度组聚集成团结构的平均直径为(1.2±0.1)mm,大于中浓度组的(0.6±0.2)mm,而对照组、低浓度组和中低浓度组干细胞仍呈分散状态,未见成团(图2)。

2.2 HE染色结果
比较3种细胞的HE染色结果,可以发现诱导细胞的细胞尺寸更小,并且细胞的间隙变得更加紧密,说明细胞朝着形成致密组织的方向发生分化。而干细胞和软骨细胞,表现出离体培养细胞的特征,即单个细胞呈长条状,细胞之间联系松散。见图3。

2.3 阿利辛蓝染色结果
阿利辛蓝染色证明了诱导细胞的团状结构表达丰富的酸性粘多糖(图4)。阿利辛蓝染料能将细胞表达的酸性粘多糖染成蓝色。酸性粘多糖一般黏附在细胞膜上或者分泌于细胞间质,参与组织内微环境的构建。干细胞通常不表达酸性粘多糖,而软骨细胞的表达量较高。干细胞结果为阴性,软骨细胞和诱导细胞为阳性,且诱导细胞的蓝色更深一些。可能是因为软骨细胞分泌到细胞间隙的酸性粘多糖,在染色的过程中可能会被清洗掉。
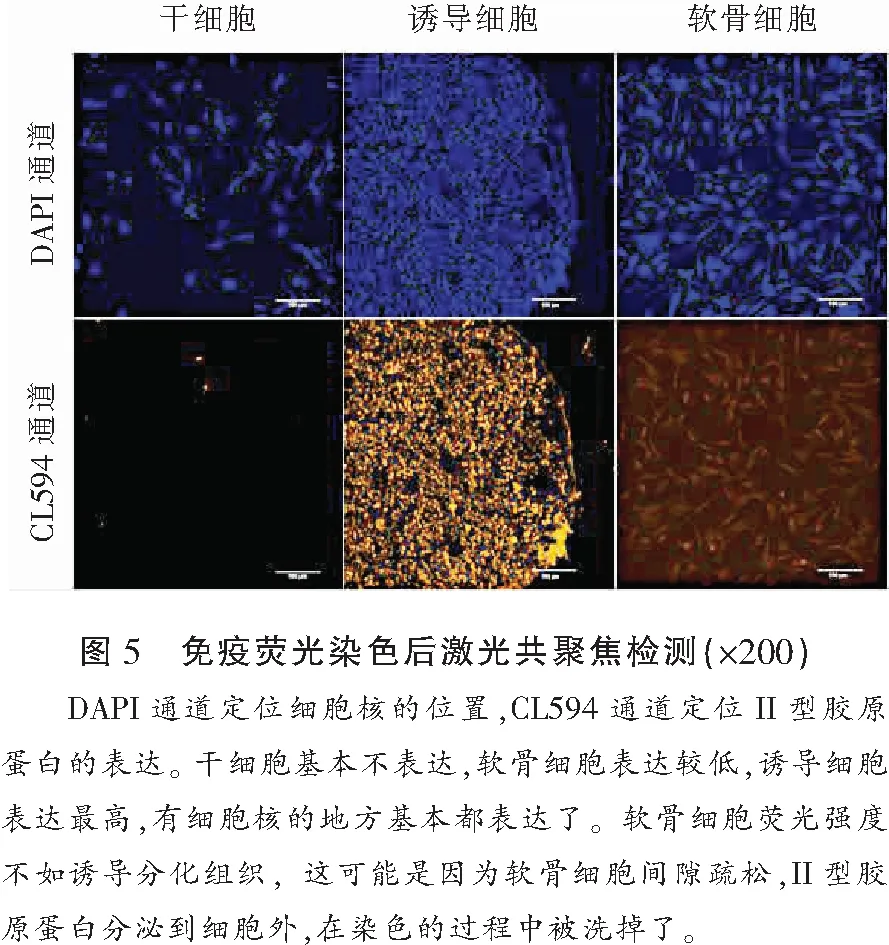
2.4 免疫荧光染色反应
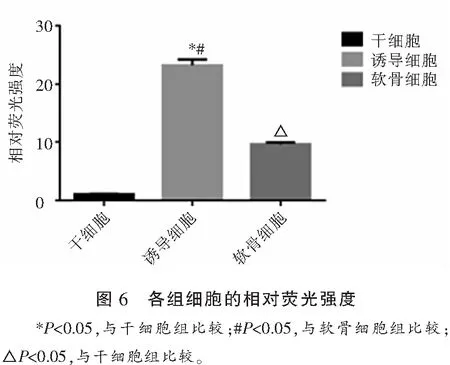
免疫荧光反应证实聚集成团的诱导细胞表达丰富II型胶原蛋白(图5)。II型胶原蛋白的免疫荧光,干细胞亮度很弱,说明II型胶原蛋白表达很低;诱导细胞很亮,说明表达很高;软骨细胞荧光亮度居中。推测干细胞诱导分化成的组织具有软骨细胞表达II型胶原蛋白的特征。imageJ软件对各组细胞的CL594通道进行定量结果显示,诱导细胞的值为(23.211±0.816),干细胞的值为(1.126±0.03),软骨细胞的值为(9.669±0.278),各组间比较差异具有统计学意义(P<0.05)。见图6。

3 讨论
软骨主要是由软骨细胞和大量细胞外基质构成,其中细胞外基质包括水和富含蛋白聚糖和胶原纤维,其中以Ⅱ型胶原蛋白纤维为主。软骨内Ⅱ型胶原蛋白纤维交联排列成网,粘多糖和水镶嵌其中,构成了软骨的基本骨架。软骨损伤在日常生活中较为常见,多种原因可导致关节软骨损伤,如年龄、肥胖及不合理运动等。关节软骨损伤进一步会导致关节退变和关节炎的发生[1]。而软骨自身由于缺乏神经和血管,一旦损伤很难自行修复。
近年来,新兴的软骨组织工程研究为软骨的修复和再生带来了希望。许多研究[6-8]表明,骨髓间充质干细胞具有多分化潜能,可以向软骨细胞分化并可形成软骨组织;并且干细胞在某些因素作用和诱导下能有效的促进软骨的再生和修复,如来自软骨基质的水凝胶[9],卡托原蛋白(Kartogenin)和TGF-β3[10]等。研究表明,TGF-β信号通路可能在干细胞分化[11-12]及软骨发生、形成、结构完整性、软骨内平衡及软骨修复方面发挥关键作用[13],这些都为软骨修复提供了极大理论和技术支持。TGF-β信号通路是高分化、多功能性和高效性的信号网络。TGF-β超大家族包括 TGF-βs、骨形态生成蛋白( BMPs)、生长分化因子(GDFs)、Nodal、活化素(Activin)和抑制素 (Inhibin)等成员,大致可分为TGF-β/Activin/Nodal和BMP/GDF/MIS两个亚家族。目前研究表明,后者信号通路在软骨发生、生成及骨形成方面发挥重要作用[4,11,14],而关于前者通路,目前研究较多的是TGF-βs因子的作用。TGF-βs 因子单独或者与其他配体或多聚体共同作用后,能诱导和促进干细胞向软骨细胞转化,促进软骨细胞的增殖,诱导细胞基质的合成及维持软骨内环境的稳定,对软骨损伤修复起到正调节作用[15-16]。在TGF-β亚家族中,BMP/GDF/MIS信号通路参与诱导软骨与骨的发育形成,其中骨形态生成蛋白可以增加正常和损伤软骨细胞基质的代谢,而细胞基质代谢的增强会替代受损软骨细胞基质分子,从而使得BMP能够在增强受损软骨内在修复能力方面发挥重要作用[14]。BMP还能够促进间充质干细胞向软骨细胞分化及软骨细胞的成熟和再生[17]。这种促进作用的关键在于其能够促进蛋白多糖及Ⅱ型胶原的合成[18-19],而这正是软骨最主要的组成成分和软骨的基本骨架。
干细胞在经过含TGF-β3的培养基培养后能展现出具有更好性能的基质产物和优于正常软骨细胞的的修复能力,这可能与Ⅱ型胶原沉积明显增多有关[20-21]。TGF-β3的量和培养时间也决定了修复软骨的优良软骨功能及生物学特性,浓度越高培养时间越长,则得到的软骨性能更优[16]。重要的是通过TGF-β3作用再生出的软骨内聚糖含量与正常软骨相当,这也预示着TGF-β3可能通过调节软骨内软骨内聚糖 生成参与软骨修复,同时Huang等[22]的研究也支持这一观点,他们发现TGF-β3能极大的促进软骨形成。此外,Chung等[23]发现,TGF-β3能进一步增强II型胶原蛋白、聚集蛋白聚糖基因的上调和表达,使得诱导的软骨具有更优越的生物学性能。而在后者的通路中,研究比较多的是BMP蛋白,其中包括BMP-2、BMP-3、BMP-7 等。研究[24-25]表明,BMP-7参与并促进软骨的修复。Kuo等[25]采用微骨折法与 BMP-7 向联合干预方式得到了基质更丰富、细胞分布更好的修复软骨组织。此种修复组织具有正常比例活力细胞、软骨下骨及软骨矿化层,同时该组织的表面特性又得到了极大的优化,因为微骨折能大大增加修复组织的量,而BMP-7又能极大提高修复软骨组织的质,这也正是BMP-7 和微骨折法相互协同作用的结果,说明BMP-7在软骨修复中具有很大的潜能。同时Kim等[26]还发现,BMP-7还能与软化的骨基质结合可刺激犬临界大小的骨缺损中新的骨骼和血管形成,因为BMP-7不仅促进成骨还能促进产生血管营养因子。因此,干细胞能在BMP-7和TGF-β3作用下分化为软骨组织,并可作为TGF-β信号通路中调节干细胞 转化及软骨细胞生成、软骨修复的潜在靶点。
本研究发现BMP-7和TGF-β3能成功诱导干细胞向软骨细胞分化并形成软骨组织,并通过HE染色、阿利辛蓝染色和免疫荧光证实了由骨髓干细胞分化形成的软骨样结构内具有丰富的聚糖和II型胶原蛋白,这与Rackwitz 等[15]研究结果相一致。同时说明BMP和TGF-βs联合作用可以更有效地诱导软骨形成,因此BMP和TGF-βs组合可能是体外诱导软骨形成的重要关键,与Indrawattana等[27]研究结果相一致。
本研究还存在一些不足:(1) BMP-7和TGF-β3的浓度最大为100 ng/mL,未设置更高的标准;(2)由于诱导分化出的软骨组织太小,未提取出足够的RNA,因此没有qRT-PCR进一步验证;(3)缺少体内实验验证。针对上述不足,课题组将在后续的研究中继续完善。
总之,BMP-7和TGF-β3联合作用能有效的诱导骨髓间充质干细胞分化为软骨细胞并形成软骨组织,且浓度BMP-7和TGF-β3越高,产生的诱导效果和软骨组织越好。

