不同浓度PEBP凝胶对大鼠子宫内膜纤维化的抑制作用
党家凤,谌伦华,张娟,沈成义,王冰
(川北医学院,1.临床医学系;2.附属医院妇产科;3.形态学研究所;4.影像四川省重点实验室;5.基础医学院化学教研室,四川 南充 637000)
宫腔粘连,通常是在子宫刮宫术后子宫内膜基底层受到创伤所致[1],以子宫内膜纤维化为主要特征,可导致经量减少、流产,甚至不孕。目前,宫腔粘连的主要治疗方法包括术后宫腔内放置气囊、Foley导管、宫内节育器、新鲜或冻干羊膜、硅胶片及宫腔内注射透明质酸钠或自体交联透明质酸钠[2-9]。然而,大多数固体装置无法根据不同形状和大小的子宫腔发生适应性改变[7],进而导致防止子宫边缘位置粘连的成功率较低。此外,Foley导管甚至还会增加子宫内膜组织的压力,阻碍子宫内膜的再生,诱发子宫内膜坏死[10]。透明质酸钠或自交联透明质酸钠可适应不同形状和大小的子宫腔,但却无法长期有效。为此,设计并制备既可通过物理阻隔防止组织粘连,又可抑制成纤维细胞增殖的可被机体吸收的聚乙二醇-b-聚L-苯丙氨酸 [poly(ethyleneglycol)-b-poly(L-phenylalanine),PEBP] 聚合物凝胶有一定的应用前景,以用于预防损伤后子宫内膜纤维化。本研究初步探讨不同浓度PEBP凝胶对大鼠子宫内膜损伤所致纤维化的抑制作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性Sprague-Dawley(SD)大鼠24只,鼠龄7~8周,体重220~240 g,由川北医学院动物实验中心提供。实验操作均在川北医学院实验动物中心进行[SYXK(川)2013-076],对动物的处置要求符合相关动物伦理学。饲养条件:室温22~26 ℃,湿度40%~70%,损伤术后单笼饲养,可自由获取食物。
1.1.2 手术材料 无菌干纱布(40 mm×50 mm)、医用脱脂棉、一次性注射器、4-0可吸收缝线、6-0可吸收缝线、血管钳、剪刀、持针器、镊子、手术刀柄、手术刀片、止血钳等(均采用高压蒸汽法灭菌)。
1.1.3 主要试剂 脂多糖(lipopolysaccharide,LPS,Sigma)、苏木素伊红(hematoxylin and eosin,HE)染色试剂盒(碧云天)、MASSON染色试剂盒(碧云天);转化生长因子-β1(transforming growth factor-β1,TGF-β1)单克隆抗体(Abcam)。
1.2 实验方法
1.2.1 实验分组 将24只SD雌性大鼠随机分为4组(B、C、D、E组),每组各6只。A组:模型组(因大鼠为“Y”字型双子宫,造模无凝胶侧随机抽取6只子宫组织作为模型组);B组:PEBP浓度0 mg/mL;C组:PEBP浓度8.125 mg/mL;D组:PEBP浓度16.25 mg/mL;E组:PEBP浓度32.5 mg/mL。
1.2.2 实验造模 如研究[11]所述,采用刮宫加感染双重损伤法建立大鼠宫腔粘连模型。将SD雌性大鼠准确称重后,腹腔注射戊巴比妥钠(0.69 mg/kg)麻醉,腹部备皮、仰卧位固定于手术台上,常规消毒、铺巾,暴露腹部手术区域。于耻骨联合上1.5 cm 沿腹正中线向上做3 cm切口,逐层打开腹腔,暴露子宫,置于无菌巾上,双侧子宫在宫颈上方约5 mm作横行切口,长约4 mm,对大鼠行刮宫术,宫腔四壁出现粗糙感时停止刮宫,6-0可吸收线缝合切口,将制作好的LPS棉线(4号医用无菌手术线浸泡于6 mg/L的LPS生理盐水中,4 ℃放置24 h)置入已行刮宫术的宫腔,生理盐水冲洗腹腔,0.3 mL不同浓度的PEBP凝胶随机注入大鼠的一侧子宫,对侧子宫注入0.3 mL生理盐水,4-0可吸收线逐层关腹,缝合皮肤,碘伏棉球消毒伤口,48 h后取出LPS棉线。
1.2.3 取材及处理 各组均于术后第14天采用颈椎脱臼法处死实验大鼠,立即剖腹取子宫组织,剔除脂肪及结缔组织后,剪取大鼠子宫组织置于10%中性福尔马林中固定24 h,常规石蜡包埋切片。
1.2.4 组织染色及图像分析 高倍显微镜下观察并选取视野。(1)HE染色观察创伤组织愈合情况;(2)Masson染色观察子宫内膜纤维化程度;(3)免疫组化染色检测子宫内膜TGF-β1表达水平。采用Image-Pro plus图像处理软件收集各组数据。
1.3 统计学分析
2 结果
2.1 各组大鼠子宫内膜愈合状况
术后14 d,各组大鼠子宫横切面HE染色后均见丰富的内膜腺体开口,见图1。各组间的单位面积腺体计数无明显差异(A=27.553±19.702,B=31.625±21.714,C=24.335±15.962,D=26.500±22.346,E=31.600±19.586,F=0.467,P=0.760),损伤组织愈合情况良好,大鼠子宫内膜因机械损伤后,诱发炎性反应,巨噬细胞的数量增多,在HE染色后大鼠子宫内膜可见巨噬细胞(图1中箭头所指为巨噬细胞)。
2.2 各组大鼠的单位面积纤维化比较
各组大鼠的单位面积纤维化程度分别为A=54.001±8.171、B=47.699±10.148、C=41.187±10.076、D=36.121±8.560、E=27.173±10.364(F=21.339,P<0.001)。实验组与模型组相比,宫内植入PEBP凝胶可显著降低损伤所致子宫内膜纤维化程度,且纤维化程度随凝胶中PEBP含量增加而降低。见图2。
2.3 各组大鼠TGF-β1表达结果比较
各组大鼠子宫内膜TGF-β1表达情况分别为A=0.051±0.006、B=0.067±0.005、C=0.063±0.011、D=0.057±0.017、E=0.046±0.012(F=3.119,P=0.039)。实验组与模型组相比,PEBP含量为0的B组子宫内膜组织TGF-β1的表达显著升高(P<0.05),PEBP含量最高的E组子宫内膜组织TGF-β1的表达显著下降(P<0.05),C、D两个PEBP凝胶组子宫内膜组织TGF-β1表达与对照组无显著差异(P>0.05)。四个凝胶组间TGF-β1表达对比可见,TGF-β1的表达随凝胶中PEBP含量增加而依次降低,见图3。

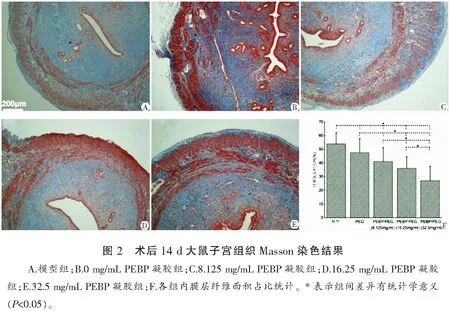
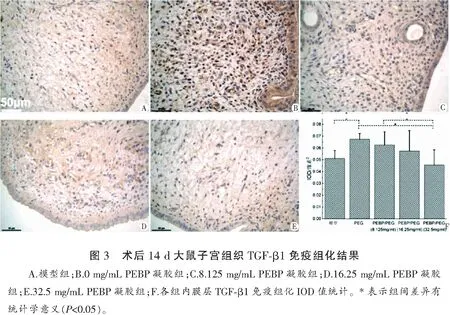
3 讨论
成纤维细胞是机体损伤的主要修复细胞,而成纤维细胞过度生长是纤维化形成的主要原因[12]。前期研究[13]发现,L-苯丙氨酸(L-phenylalanine,L-Phe)可以通过调控细胞膜表面钙离子敏感受体(calcium sensitive receptor,CaSR)实现抑制成纤维细胞过度增殖的作用。为此,本研究设计并制备了可以通过肽键释放L-Phe的PEBP凝胶以用于预防损伤导致的大鼠子宫内膜纤维化,并探讨凝胶中PEBP含量对纤维化抑制作用的影响。
PEBP凝胶应用于损伤子宫中可有效抑制损伤导致的子宫内膜纤维化,且纤维化程度随凝胶中PEBP浓度的增加而降低,说明PEBP/PEG凝胶中可以抑制纤维化发生的有效成分是PEBP,这可能是由于PEBP嵌段聚合物中的聚L-苯丙氨酸链段,植入体内肽键被水解或酶解后,可释放出抑制成纤维细胞增殖的L-Phe,从而抑制纤维化的发展。此外,与模型组相比,纯PEG的B组子宫内膜组织TGF-β1的表达显著升高, PEBP中PEG链段的分子量为2 kDa,B组不含PEBP的凝胶主要成分为PEG 2000及PEG 400,分子量大于2 kDa的PEG在体内的代谢主要依靠巨噬细胞的吞噬作用,而巨噬细胞也可以分泌TGF-β1,即PEG的应用刺激了TGF-β1的过度表达[14]。值得注意的是,随着凝胶中PEBP含量的增加,大鼠子宫内膜组织的TGF-β1表达依次下降,且应用最高PEBP含量凝胶的E组TGF-β1表达则显著低于模型组。这表明PEBP的应用可以降低组织中TGF-β1的表达。除巨噬细胞之外,成纤维细胞也是TGF-β1的主要分泌细胞,应用PEBP后TGF-β1表达的下降表明PEBP抑制了损伤组织中成纤维细胞的过度增殖。而TGF-β1作为促纤维化因子又可促进纤维化组织的形成,应用PEBP降低TGF-β1的表达可有效缓解损伤导致的组织纤维化。
综上,PEBP/PEG凝胶可以有效抑制损伤导致的大鼠子宫内膜纤维化,源于PEBP对损伤组织中成纤维细胞过度增殖的抑制作用,并通过这一作用调控子宫内膜组织中促纤维化因子TGF-β1的表达实现抑制纤维化的作用。

