微小RNA-124调控APLN表达在癫痫神经元损伤中的作用及机制研究
董 晗,王智昊,王 哲,高 飞,王越晖
癫痫(epilepsy)是神经系统的慢性疾病之一,发作具有反复性、不可预测性等特点。癫痫的反复发作可导致患者认知功能障碍与生活质量下降,且增加患者的死亡风险。癫痫的年发病率约为61.4/10万人,预计全球受累患者约5000~8000万[1]。采用抗癫痫药物、手术等治疗手段,仍有相当比例的患者病情得不到有效控制。此外,大部分抗癫痫药物长期服用会出现一定的毒副作用,导致患者依从性降低[2,3]。Apelin(APLN)是一种生物活性肽,为孤儿G蛋白偶联受体(APJ)的内源性配体,在血压调节、摄食行为、垂体激素释放及神经元损伤保护中均发挥重要作用[4]。APLN可通过抑制炎症反应、抑制氧化应激、降低细胞内钙浓度、抗凋亡等途径对神经元发挥保护作用[5~8]。我们的前期研究发现APLN对癫痫神经元损伤具有明显的保护作用,其机制涉及到调节凋亡相关蛋白表达、抑制代谢型谷氨酸受体1(metabotropic glutamate receptor 1,mGluR1)表达等[9]。然而,APLN在癫痫中的表达调控机制目前仍不清楚,现将我们的研究结果报道如下。
1 材料与方法
1.1 实验试剂 神经元培养基及神经生长因子购至美国Sciencell公司,miR-124、U6、APLN等引物购至吉林库美生物有限公司,TRIzol购至美国Invitrogen公司,SYBR Green Mix实时荧光定量PCR试剂盒、ReverTra Ace qPCR购至TOYOBO 公司,双荧光素酶报告基因载体pmiR-RB REPORT购至锐博生物,双荧光素酶报告基因检测试剂盒购至Promega 公司,胎牛血清、Opti MEM无血清培养基、流式凋亡检测试剂盒分别购至GBICO公司、Tuoran公司与凯奇生物,APLN抗体、Bax抗体、caspase 3抗体、Bcl-2抗体及β-actin抗体购至Abcam公司。
1.2 癫痫神经元模型构建 大鼠海马神经元购自上海康朗生物科技有限公司。采用笔者前期研究方案低镁细胞外液培养建立癫痫神经元模型[9]。大鼠海马神经元在维持液培养基中培养14 d后,弃掉原培养基,用低镁细胞外液培养3 h后用PBS溶液洗两次,后继续转入维持液培养基中培养20 h用于后续实验。正常细胞外液组成成分:NaCl 145 mmol/L,KC1 2.5 mmol/L,CaCl22 mmol/L,HEPES 10 mmol/L,Glucose 10 mmol/L,MgC121 mmol/L,甘氨酸0.002 mmol/L;用5 mmol/L NaOH 调节pH 至7.3,调整渗透压在280~320 mmol/L。低镁细胞外液组成成分:NaCl 145 mmol/L,KCl 2.5 mmol/L,CaCl22 mmol/L,HEPES 10 mmol/L,Glucose 10 mmol/L,甘氨酸0.002 mmol/L,用5 mmol/L NaOH调节pH 至7.3,调整渗透压在280 ~ 320 mmol/L。
1.3 细胞转染 大鼠海马神经元培养于6孔板,24 h后细胞融合率达到80%~90%时进行细胞转染。采用FuGene HD转染试剂进行转染,具体操作步骤参照说明书。培养基含有10%的胎牛血清(150 μl)、不同类型载体(4 μg)与FuGene HD转染试剂(7.5 μl),室温孵育15 min。转染24 h后更换培养基,并去除死亡细胞。
1.4 流式细胞仪检测 收集各组细胞于流式管中,每管细胞数2~5×105,用PBS洗2次,Annexin V染色30分,4 ℃避光。后用PBS洗2次。上机前加入5 μl稀释PI液后,充分混匀,进行流式细胞仪检测。
1.5 qRT-PCR检测 收集各组细胞,采用Trizol提取总RNA,采用逆转录试剂盒逆转录为cDNA。采用mRNA检测试剂盒检测mRNA表达,GAPDH设为对照。实验重复3次。
1.6 蛋白印迹(western blotting)检测 收集各组细胞,加入裂解液裂解细胞,提取总蛋白,测定蛋白浓度,上样、电泳,最后经转膜、显色等确定各组蛋白表达水平。检测抗体包括Bax、Bcl-2、Caspase-3、APLN抗体,β-actin设置为对照。实验重复3次。
1.7 双荧光素酶系统检测 将海马神经元培养于24孔板。神经元培养24 h后采用Lipofectamine 2000进行细胞转染,将miR-124 mimics、miR-124 mimics对照与APLN基因野生型、突变型载体共同转染,继续培养48 h,采用双荧光素报告酶检测系统检测荧光素酶活性。
2 结 果
2.1 miR-124与APLN靶标关系的研究 通过多个生物信息学网站预测(Target Scan、NCBI、miRbase等),结果提示APLN基因表达可能受miR-124调控。因此,我们采用双荧光素酶报告基因检测系统验证miR-124与APLN的靶标关系,将miR-124 mimics分别与APLN基因野生型、突变型、空载体3种报告基因载体进行共转染,荧光素酶活性检测结果见图1。miR-124+APLN野生型组的荧光素酶活性低于miR-124+APLN突变型组和miR-124+空载体组,但差异无统计学意义;miR-124+空载体组与miR-124+APLN突变型组荧光素酶活性无明显差异。
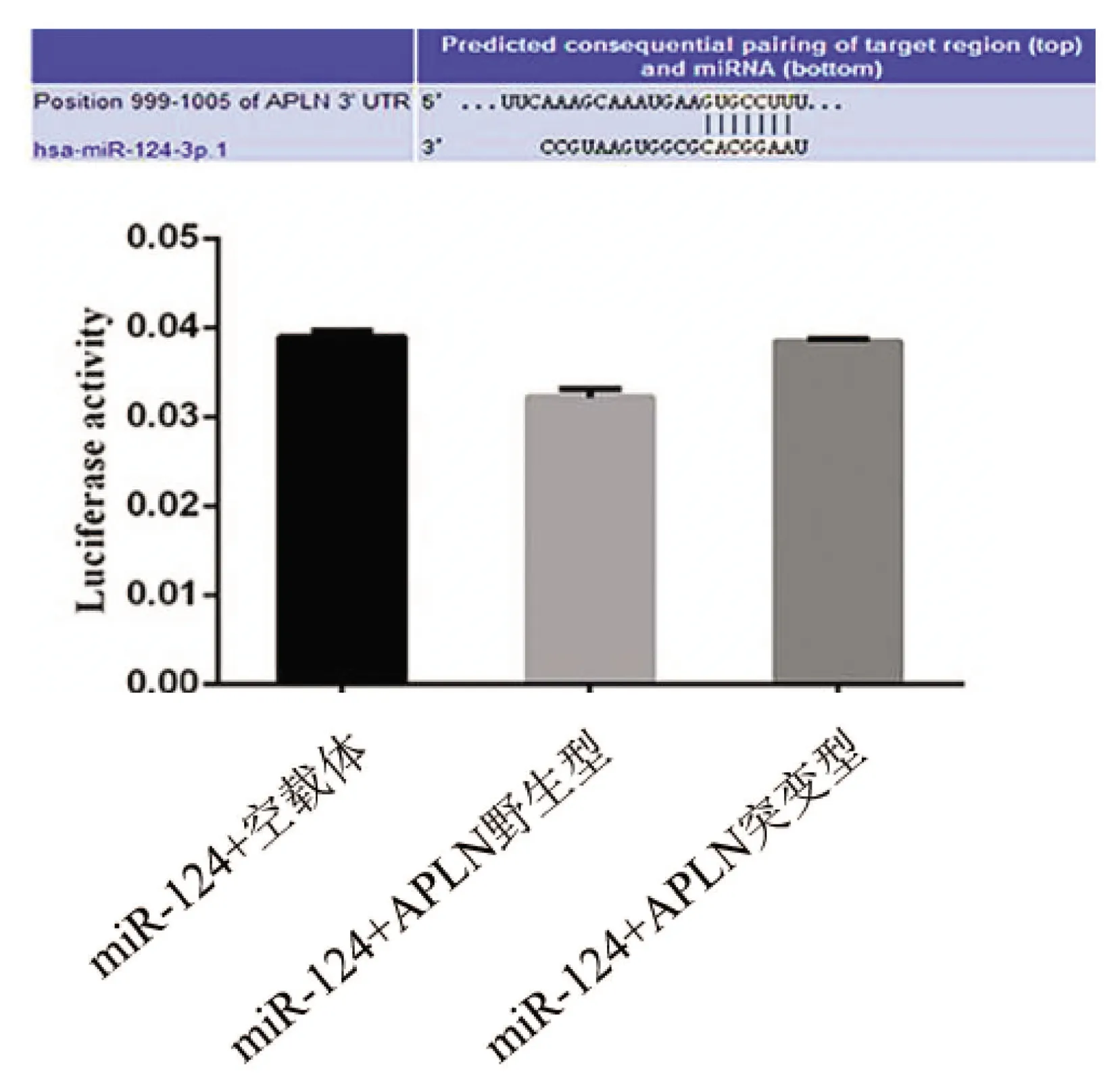
图1 双荧光素酶报告基因系统检测miR-124与APLN的靶标关系
2.2 miR-124对神经元APLN表达的影响 将miR-124 mimics、miR-124 inhibitor与对照miRNA转染神经元,通过qRT-PCR检测miR-124、APLN mRNA的表达水平。结果发现miR-124 mimics组miR-124的表达水平明显高于对照组,而miR-124 inhibitor组miR-124的表达水平显著低于对照组(见图2A),提示成功地实现了对神经元miR-124的表达调控。与对照组相比,miR-124 mimics组APLN mRNA表达水平明显高于对照组,而miR-124 inhibitor组APLN mRNA表达水平明显低于对照组(图2B)。
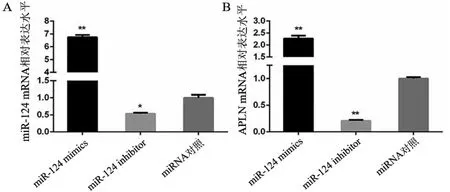
图2 调控miR-124表达对miR-124与APLN基因mRNA表达的影响。A:miR-124 mRNA相对表达水平;B:APLN mRNA相对表达水平
采用western blotting对神经元APLN蛋白表达进行检测,结果发现与对照组相比,miR-124 mimics组与miR-124 inhibitor组APLN表达量明显升高,且miR-124 mimics组高于miR-124 inhibitor组(见图3A、3B)。

图3 调控miR-124表达对APLN蛋白表达的影响。A:不同组western blotting检测代表性结果图;B:不同组western blotting检测结果的统计图
2.3 miR-124对癫痫神经元凋亡的影响 海马神经元癫痫模型转染miR-124 mimics、miR-124 inhibitor与对照miRNA后,经流式细胞仪Annexin V/PI染色检测神经元凋亡情况,结果见图4。与对照组相比,miR-124 mimics组神经元凋亡率明显升高,而miR-124 inhibitor转染对神经元凋亡无明显影响(见图4A、4B)。
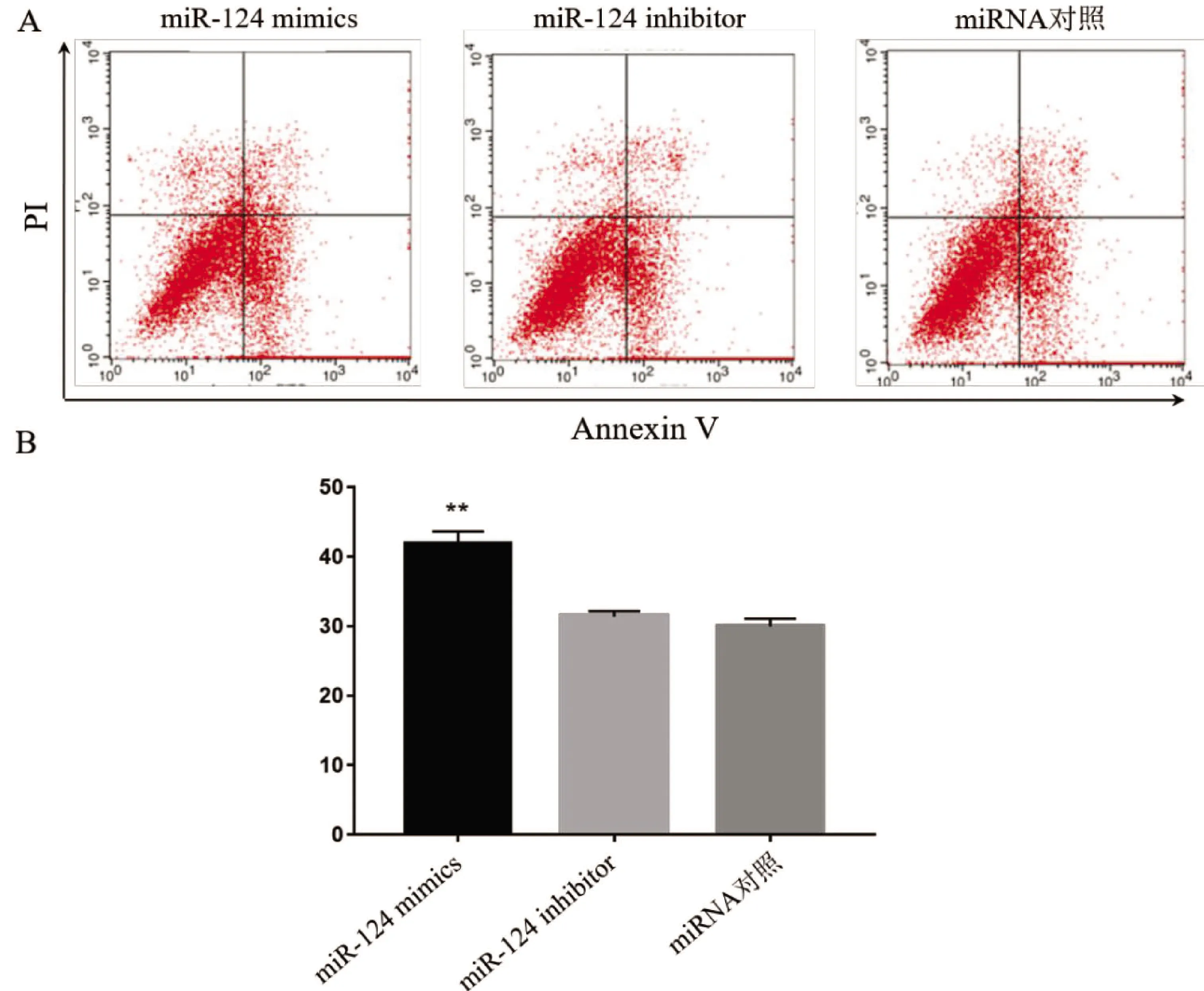
图4 miR-124对癫痫神经元凋亡的影响。A:不同组流式细胞仪检测神经元凋亡代表性结果图;B:不同组神经元凋亡的统计结果
2.4 miR-124对癫痫神经元凋亡蛋白表达的影响 海马神经元癫痫模型转染miR-124 mimics、miR-124 inhibitor、对照miRNA,同时设置空白对照。经western blotting检测凋亡相关蛋白Bax、Caspase 3与Bcl-2的表达情况,结果见图5。与对照组相比,miR-124 mimics组神经元Bax(见图5A、5B)、Caspase 3(见图5A、5C)表达水平明显升高,而Bcl-2(见图5A、5D)的表达水平显著降低。miR-124 inhibitor转染后神经元caspase 3(见图5A、5C)表达水平显著降低,而对Bax与Bcl-2表达无影响(见图5A、5B、5D)。
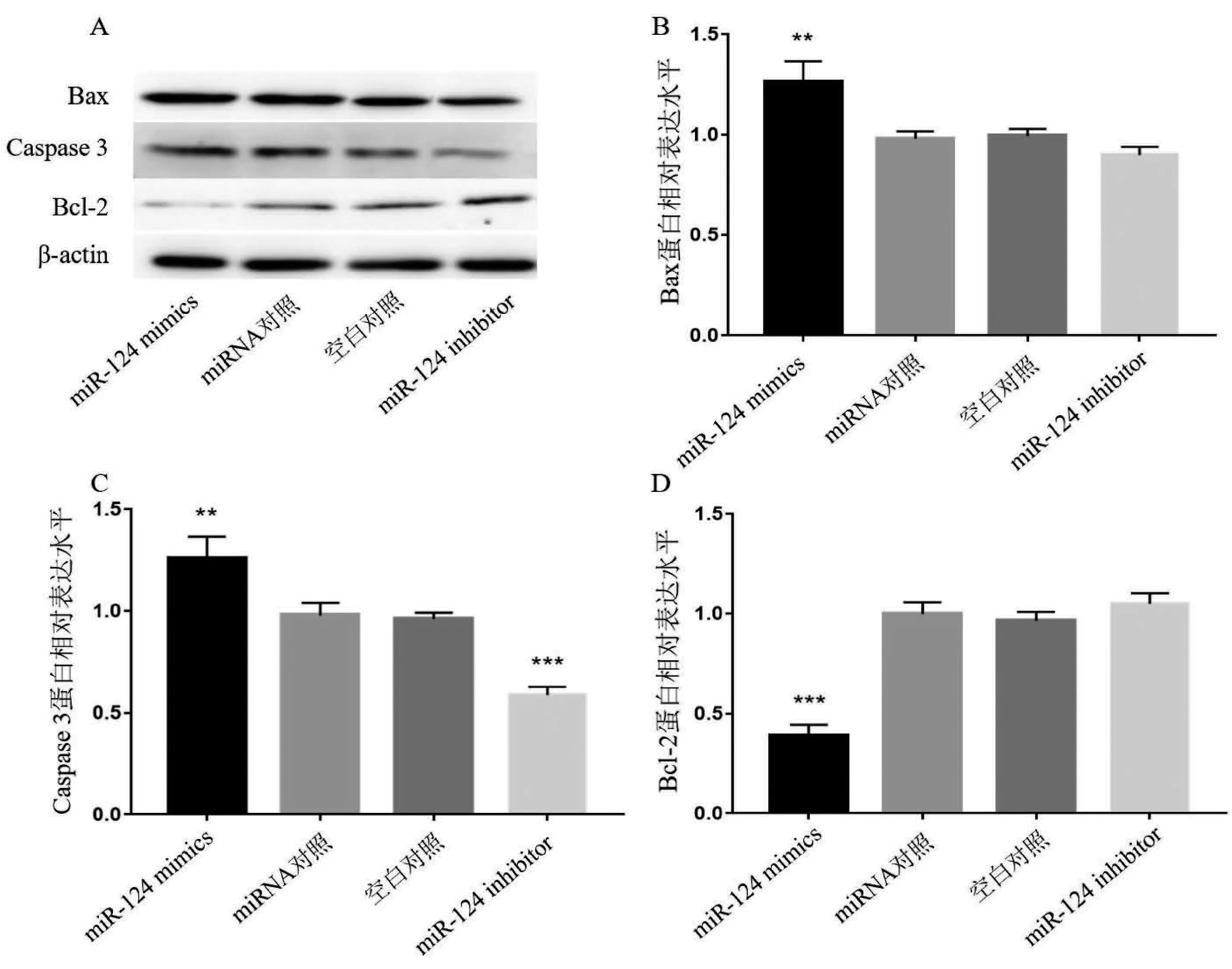
图5 miR-124对癫痫神经元凋亡蛋白表达的影响。A:不同组western blotting代表性结果图;B:不同组神经元Bax蛋白表达统计图;C:不同组神经元caspase 3蛋白表达统计图;D:不同组神经元Bcl-2蛋白表达统计图
3 讨 论
神经元损伤在癫痫等多种神经系统疾病的病理过程中均发挥十分重要的作用[10]。尽管癫痫小发作不一定会引起神经元损伤,但严重癫痫或癫痫的反复发作无疑会导致神经元损伤[11]。尽管神经元损伤与癫痫反复发作的因果关系目前尚存在一定的争议,但动物实验结果表明癫痫导致的海马神经元损伤可引起癫痫发作频率增加与严重癫痫的发作[12]。兴奋性毒性是癫痫相关神经元损伤的重要机制。过度激活的兴奋性神经递质信号可导致大量钙离子内流,继而激活多条细胞内信号转导通路,最终导致神经元损伤[13]。mGluR1在兴奋毒性诱导的神经元损伤中发挥十分重要的作用[14]。笔者前期研究结果证实APLN可抑制癫痫导致的神经元凋亡,上调抗凋亡蛋白表达,下调凋亡蛋白表达,并首次发现APLN可下调mGluR1表达[9]。因此,APLN可能是癫痫预防或治疗的潜在干预靶点。然而,深入研究APLN在癫痫神经元损伤中的表达调控机制具有重要的临床意义。
作为神经系统内保守表达的微小RNA,miR-124在脊椎动物神经系统发育及多种中枢神经系统疾病中均发挥十分重要的作用[15]。miR-124在癫痫病理机制中的作用目前尚存争议。一方面miR-124可能通过抑制神经元兴奋性、延长癫痫发作潜伏期等抑制癫痫的发作,另一方面miR-124可通过激活小胶质细胞与炎症反应等促进癫痫的发作[16]。通过多种生物信息学预测网站分析,我们发现miR-124可能调控APLN表达。因此,在本研究中我们首先通过双荧光素酶报告基因系统分析miR-124对APLN表达的调控作用。结果提示miR-124+APLN基因野生型组荧光素酶活性低于对照组,尽管尚未达到统计学差别,提示miR-124可能与APLN直接结合。此后我们研究了miR-124对APLN表达的影响,结果显示上调miR-124表达可明显上调APLN mRNA与蛋白的表达,下调miR-124表达可下调APLN mRNA表达,但APLN蛋白表达无明显降低。尽管微小RNA负调控靶基因的表达是其发挥生物学功能的主要途径,但有证据提示微小RNA可正调控靶基因表达[17,18]。因此,上述研究结果提示miR-124可能正调控APLN基因的表达。
有研究表明miR-124具有神经保护作用,可抑制神经元凋亡[19,20],但亦有研究报道在缺血性脑损伤中,下调miR-124表达可减少神经元凋亡、缩小脑梗死病灶[21]。采用流式检测发现,上调miR-124表达可促进癫痫海马神经元凋亡,而下调miR-124表达对神经元凋亡无明显影响。机制研究也发现上调miR-124表达可上调促凋亡蛋白Bax、caspase 3表达、下调抗凋亡蛋白Bcl-2表达。尽管miR-124可能正调控APLN表达,但miR-124上调并未显示出神经保护作用,相反却促进癫痫神经元凋亡。因此,miR-124可能通过其他机制促进神经元凋亡。
综上,本研究结果提示miR-124与APLN基因可能存在靶标关系,miR-124可能正调控APLN表达。miR-124除可调控APLN表达外,还可能调控其他基因表达,最终表现为促进癫痫海马神经元凋亡。因此,本研究揭示了癫痫神经元损伤中APLN表达调控的复杂性,其更为精准的表达调控机制仍有待更多研究探索。

