lncRNA-UCA1通过调节TGFβ1对海人酸诱导小鼠癫痫的保护作用
杨诚 罗涛 彭夏培 肖敏 傅曼
(华中科技大学同济医学院附属武汉中心医院神经内科,湖北 武汉 430014)
癫痫患者常表现为反复、突然抽搐、感觉、意识或精神等异常。长期、频繁或严重的癫痫发作会导致进一步的脑损伤甚至持久性的神经精神障碍〔1〕。癫痫持续状态(SE)可导致急性和持久的中枢神经系统损伤及海马神经元损伤。SE的急性期后,缺血、缺氧、水肿和炎症反应会发生在海马区,包括诱导兴奋性氨基酸的释放,大量钠离子和钙离子等相关机制的变化,导致神经元损伤(包括海马神经元丢失,神经细胞凋亡、胶质细胞增殖、苔藓纤维发芽、海马硬化等),这就是慢性自发性癫痫发生和发展的主要原因。最后就逐渐形成难治性的颞叶癫痫〔2〕。颞叶癫痫发病率占所有癫痫的25%,临床上针对该种癫痫类型病人的多种抗癫痫药物的疗效并不理想〔3〕。转化生长因子(TGF)β1的激活可以通过胶质细胞有效率地引起广泛的基因表达和调节细胞因子的目标基因的转录,在炎症和免疫反应中发挥作用来保护神经元的损伤〔4〕。虽然很少有文献报道癫痫发作伴随着TGFβ1在大脑中的表达减少,从而导致神经元死亡和激活的胶质细胞,并促进癫痫小鼠的脑部病变,但有相关报道〔5〕讲述了癫痫中与TGFβ1相关的调节机制。长链非编码RNA(lncRNA)通常分为基因间lncRNA、基因内RNA、竞争内源性RNA,高度保守的转录区域和反义RNA等〔6〕。与可以编码蛋白质的RNA相比,lncRNA具有更短的长度、更少的外显子、更弱的编码能力及组织细胞特异性;与mRNA相比,lncRNA在相近的物种中具有更低的保守性〔7〕。研究〔8〕发现,lncRNA的表达有组织特异性,与大脑发育、神经元分化和神经系统疾病等密切相关,例如神经退行性疾病、脑缺血、胶质瘤与癫痫。尿道上皮癌相关(UCA)1是一个lncRNA,已知在膀胱癌中表达上调。UCA1被认为在胚胎发育与肿瘤侵入及增殖中起到调控作用,它参与调控肿瘤发生和胚胎发育中的好几个基因〔9〕。已有研究〔10〕发现,在海马移除手术的颞叶癫痫病人中UCA1展现出异常的甲基化,但是它导致癫痫发作的可能机制没有进一步研究。本研究旨在探讨lncRNA-UCA1通过调节TGFβ1对海人酸诱导小鼠癫痫的保护作用。
1 材料和方法
1.1实验动物癫痫造模及评级标准 实验材料:C57/B6健康小鼠90只,鼠龄4~6个月,体重160~280 g,由武汉中心医院提供。随机分为对照组30只和实验组60只。动物饲养:C57/B6小鼠(10~12 w)饲养于(23±2)℃,12 h白光/12 h黑暗交替的IVC动物房,自由饮食/进水。
模型制备:实验组腹腔注射海人酸20 mg/kg后即连续观察5 h小鼠行为变化。当小鼠持续癫痫性发作达1 h给予地西泮4 mg/kg腹腔注射,如不能缓解癫痫性发作,可重复给予地西泮一两次,直到癫痫性发作被解除。对照组以35 μl/g生理盐水取代海人酸,其余用药、步骤及方法与实验组相同。分别在建模成功后第1、7、14、30、60天处死小鼠,然后根据实验情况随机选择小鼠进行实验。
1.2免疫荧光染色 小鼠灌流取脑组织蔗糖梯度脱水后利用冰冻切片切冠30 μm,先用1×磷酸盐缓冲液(PBS)在摇床上清洗脑片,5 min一次洗3次;利用0.5%Triton in PBS破膜,室温孵育30 min;利用3%胎牛血清封闭,室温封闭1 h;孵育c-Fos一抗(ab190289,1∶200,abcam),4℃过夜孵育12 h;利用1×PBS清洗脑片,5 min一次洗3次;孵育荧光二抗(A10040,1∶200,invitrogen),室温孵育1 h,最后孵育4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)(1∶500)5 min,清洗贴片。
1.3qRT-PCR 采用Trizol(Invitrogen)法提取总RNA,并使用分光光度计测浓度和纯度,使用FSQ-301 ReverTra Ace qPCR RT Master Mix with gDNA Remove试剂盒进行逆转录,用于UCA1和TGFβ1的检测。按说明使用SYBRs GREEN PCR Master Mix(Applied Biosystems)配置预混液,在ABI7500 qRT-PCR系统(Applied Biosystems)R扩增,采用ΔΔCT 法分析。以GAPDH为UCA1和TGFβ1的内参。
UCA1正向引物:5′-ACCTCA ACCCAAAGGCAG-3′;反向引物:5′-GCCTTTGTGCCGCTACTTTT-3′;TGFβ1 正向引物:5′-CCTCGTCATCTGTCTCGCAT-3′;TGFβ1 引向引物:5′-AGTCGTCCGTCTGTAGTGAT-3′;GAPDH正向引物:5′-TATGATGATATCAAGAGGGTAGT-3′;反向引物:5′-TGTATCCAAAC TCATTGTCATAC-3′。
1.4立体定位注射 麻醉:5%水合氯醛,腹腔缓慢注射,210 mg/kg,随时注意动物状态。头部固定:将小鼠的门齿固定于脑定位仪上颌固定器,然后把一侧的耳捧推入动物的外耳道后,使动物的头在处于两滑道正中。再将另一耳捧推入另一侧的外耳道。这时观察两个耳棒的刻度一致后,将两耳棒上的固定螺丝扭紧,在将牙齿固定器上压鼻环压下后扭紧,这时从各个方向推压动物头部均不会出现移动。开颅钻孔前的备皮:剪去动物头部毛,用2% 碘酒及75% 酒精棉球作头部皮肤的消毒,沿矢状缝做一约0.8 cm长的皮肤切口,分离皮下组织,用双氧水清洁颅骨表面的筋膜及肌肉并剥离,推开骨膜,暴露前囟、人字缝及矢状缝。确定标准中线:将金属定位针向下移动到矢状缝上方后,再前后移动定位针,确保矢状缝在一条直线上;使定位针定位到前囟,然后移动到后囟,保证前后囟的高度一致。海马DG定位:用定位针在前囟后2.1 mm,矢状缝旁开1.3 mm处定位一点,即为海马的平面位置,然后在此点上用钻孔针在颅骨上钻一小圆孔。小鼠海马DG则位于该圆孔下2 mm。注射病毒(LV-U6-shUCA1,Genechem):将微量注射器吸入病毒后,安置到微量注射泵上,使注射器针头由小鼠脑钻孔处下降2 mm时,开始病毒注射。注射速度:50 nl/min。注射剂量:2 μl/DG。留针:注射完成后,原位置留针5 min,然后上移1 mm,继续留针5 min,拔针。缝皮:2% 碘酒及75% 酒精棉球作头部皮肤的消毒后,缝皮。
1.5统计学方法 采用SPSS13.0软件进行方差分析、t检验、χ2检验。
2 结 果
2.1小鼠癫痫发作分级 癫痫性发作按Racine分级标准进行判定:0级,无抽搐发作;Ⅰ级,耳、面部抽搐;Ⅱ级,肌阵挛,但无直立位;Ⅲ级,肌阵挛,伴直立位;Ⅳ级,全身强直阵挛发作;Ⅴ级,强直阵挛发作,并失去体位控制。以出现持续1 h的Ⅲ级以上的发作,并在解除痫性发作后状态良好的小鼠为癫痫持续状态模型成功鼠。实验组均为痫性发作,经处理后呈持续性Ⅲ~Ⅳ级发作,其中56只经地西泮处理后缓解,为癫痫持续状态模型成功鼠,成功率为93.33%(56/60)。实验组海马区c-Fos染色表明海人酸腹腔注射诱导癫痫模型中及早基因c-Fos主要表达在小鼠大脑海马的DG区(图1、2)。
2.2UCA1与TGFβ1在癫痫不同时间点均表达上调 癫痫造模后取不同时间点(1、7、14、30、60 d)小鼠海马组织提RNA进行qRT-PCR检测UCA1与TGFβ1的表达情况。将对照组表达量全部均化为1之后,实验组1 d UCA1相对表达水平(4.831 3±0.072 1),7 d(6.751 8±0.114 3),14 d(12.642 5±1.007 8),30 d(4.765 9±0.069 6),60 d(2.433 1±0.070 2)均明显上升(P<0.01);实验组1 d TGFβ1相对表达水平(0.682 5±0.010 8),7 d(0.753 8±0.080 3),14 d( 0.344 2±0.015 7),30 d(0.160 9±0.008 6),60 d(0.357 1±0.009 3)均明显下降(n=3,均P<0.01)。
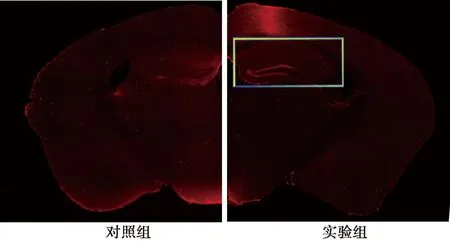
图1 癫痫造模后c-Fos免疫荧光染色(×2)
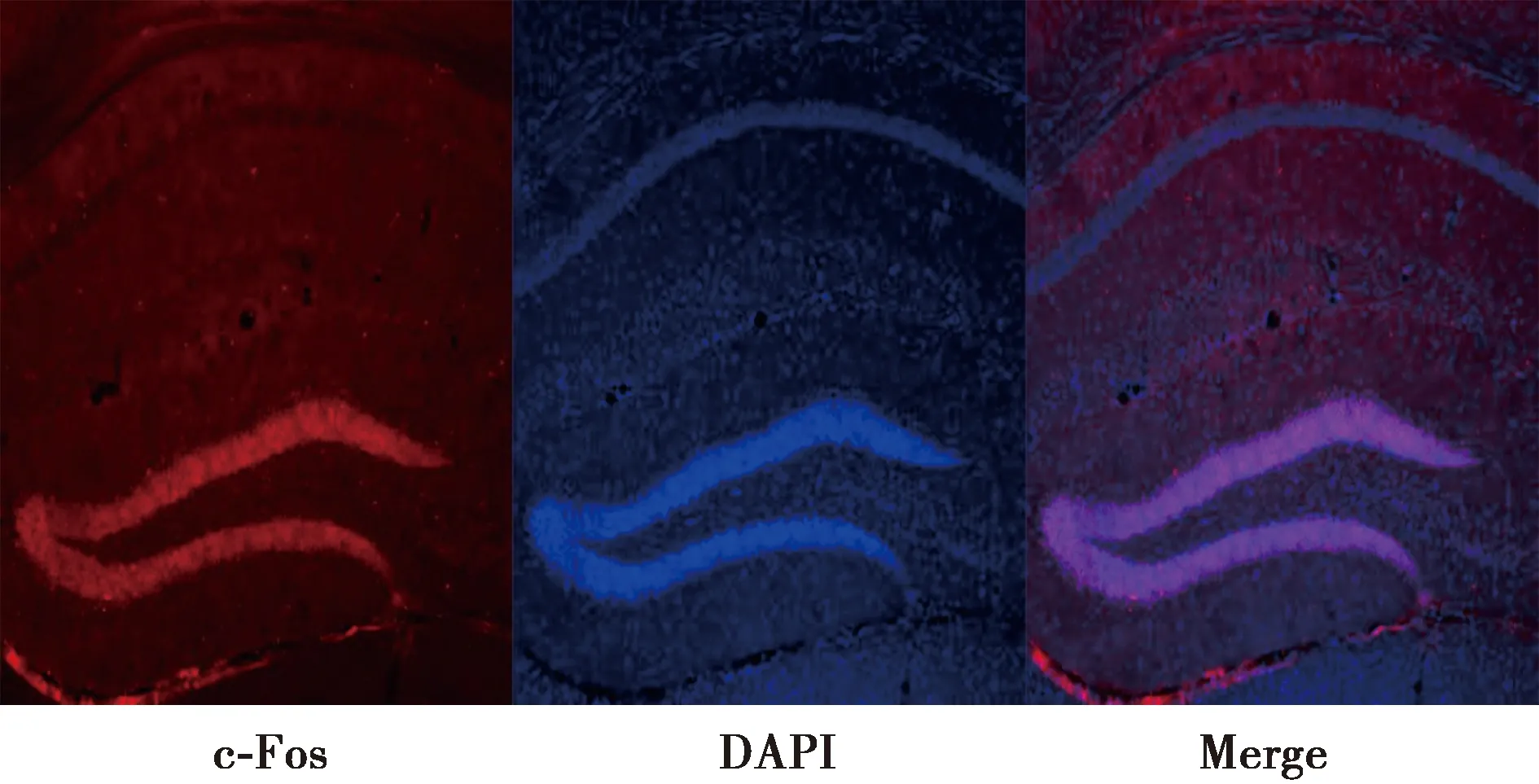
图2 实验组小鼠脑组织海马区放大c-Fos荧光染色结果(×2)
2.3沉默UCA1的表达下调TGFβ1并缓解癫痫发作等级 进一步设计UCA1的shRNA并包装成慢病毒注射到小鼠海马DG区,3 w后取小鼠海马组织提取RNA做qRT-PCR检测TGFβ1的表达发现,病毒注射实验组TGFβ1的表达(2.275 9±0.231 2,P<0.01)较对照组(0.987 3±0.004 5)显著升高(n=4,P<0.01)。将病毒注射组3 w后与正常老鼠同时进行海人酸癫痫造模,结果显示实验组成功率〔43.33%(13/30)〕较对照组〔83.33%(25/30)〕显著降低(n=30,均P<0.01)。
3 讨 论
TGFβ1通过细胞表面的受体信号转导途径调控者细胞的增殖、分化、黏附、转移和凋亡。它参与了多种不同疾病的发生与发展,在神经系统中与许多生理病理过程相关,并发挥着神经保护作用。TGFβ1广泛存在于静息状态细胞的细胞质中。当细胞受到环境的刺激时,特异的抑制性蛋白抑制剂IkB可以被磷酸化和灭活,所以TGFβ1被激活入核;然后TGFβ1 结合到细胞核内的一些增强子基因的元件GGGRNNYYCC,开始启动或调节早期反应基因的转录及参与炎症反应、细胞增殖和细胞凋亡〔11〕。癫痫是一种常见的中枢神经系统疾病,TGFβ1可能通过作用于神经元、星形胶质细胞、小胶质细胞等及经由多种信号转导途径影响癫痫的形成和发展。之前有研究〔12〕癫痫发作后海马的炎症与免疫反应时发现,长时间的癫痫发作导致TGFβ1失活的标志就是TGFβ1的表达减少,癫痫发作引起的炎症级联反应可能会导致TGFβ1在星形胶质中过表达。鉴于TGFβ1激活癫痫的发病机制的复杂性,其信号转导系统已经成为当前的研究热点之一。大量研究〔13,14〕显示,lncRNA在大脑中丰富表达,参与调控大脑发育,在神经系统中发挥重要作用。近年发现〔15〕成年小鼠脑中有849个lncRNA参与神经系统的发育,lncRNA同样可以参与癫痫的发生发展。本研究结果表明,UCA1和TGFβ1的表达水平随时间的变化是成负相关的,由此可以推断UCA1和TGFβ1之间存在着调控作用。本实验结果表明UCA1在海人酸诱导小鼠癫痫中通过与TGFβ1的相互作用来诱发或者加剧癫痫症状,通过抑制UCA1的表达可以上调TGFβ1进而抑制缓解癫痫发作。

