产前地塞米松暴露对极低和超低体重早产儿生存结局及早期并发症的影响
申 璐,殷其改
(徐州医科大学附属连云港医院新生儿科,江苏 连云港 222002)
2012 年世界卫生组织的报告显示,全球的早产率已超过10%,而我国是早产率较高的10 个国家之一[1]。造成早产的病因多种多样,而早产又是导致新生儿死亡和出现各种并发症的重要原因之一[2-3]。近30 年来,我国新生儿疾病的救治水平取得了巨大进步[4]。随着机械通气、肺表面活性物质替代治疗、重症监护等技术的不断发展,早产儿的存活率显著提高,但与发达国家相比,我国超低体重早产儿[出生体重(birth weight,BW)<1 000 g]的存活率仍偏低,仅为50%[5],且这些早产儿在呼吸窘迫综合征(respiratory distress syndrome,RDS)、动脉导管未闭、脑室内出血、坏死性小肠结肠炎、脑室周围白质软化、支气管肺发育不良(broncho-pulmonary dysplasia,BPD)等疾病的发生率较高,这些因素是新生儿早期死亡的主要原因。相关文献显示,孕母在产前使用地塞米松可以降低这些并发症的发生[6]。但目前的研究主要集中在产前地塞米松暴露与胎龄间的关系,而其与BW 间相关性的研究相对较少。本研究回顾性分析孕母产前地塞米松暴露对极低体重早产儿、超低体重早产儿的存活率及早期并发症的影响。
对象与方法
一、对象
以2012 年1 月1 日至2020 年7 月31 日徐州医科大学附属连云港医院由产科直接转入新生儿重症监护病房的BW≤1 500 g 的适于胎龄儿为研究对象,共355 例。
1.入选标准:①BW≤1 500 g 的适于胎龄儿;②生后30 min 内转入新生儿科;③孕母、孕期的产科检查均在我院进行。
2.排除标准:本研究排除存在以下情况的患儿。①存在先天畸形;②患有遗传代谢性疾病;③早产儿出生后因其他原因需糖皮质激素类药物治疗;④孕母患有需糖皮质激素类药物治疗的疾病;⑤孕母在怀孕期间曾使用过糖皮质激素类药物;⑥孕母在产前2 天的地塞米松使用方法不是肌内注射,且使用方法不是每次6 mg,每12 h 1 次;⑦未达临床出院标准而家长放弃治疗的。本研究对于出生后并发症的统计,排除了死亡的患儿。
二、方法
1.分组:根据孕母是否使用过地塞米松(地塞米松磷酸钠注射液,辰欣药业股份有限公司,含地塞米松5 mg/mL),将患儿分为暴露组和未暴露组。暴露组为孕母在分娩前2 d 肌内注射地塞米松,每次6 mg,每12 h 注射1 次,共4 次。
2.临床资料收集:收集入组患儿的一般资料,包括性别、BW、胎龄、胎数、Apgar 评分、分娩方式、住院时间、氧疗时间、生存结局;记录早产儿出生后的早期并发症发生情况,包括新生儿低血糖、新生儿黄疸、新生儿贫血、新生儿肺炎、新生儿败血症、早产儿视网膜病变 (retinopathy of prematurity,ROP)、RDS、BPD、坏死性小肠结肠炎、动脉导管未闭、脑室内出血;统计孕母在孕期所患疾病,包括妊娠糖尿病、妊娠高血压、前置胎盘、胎膜早破、胎盘早剥。
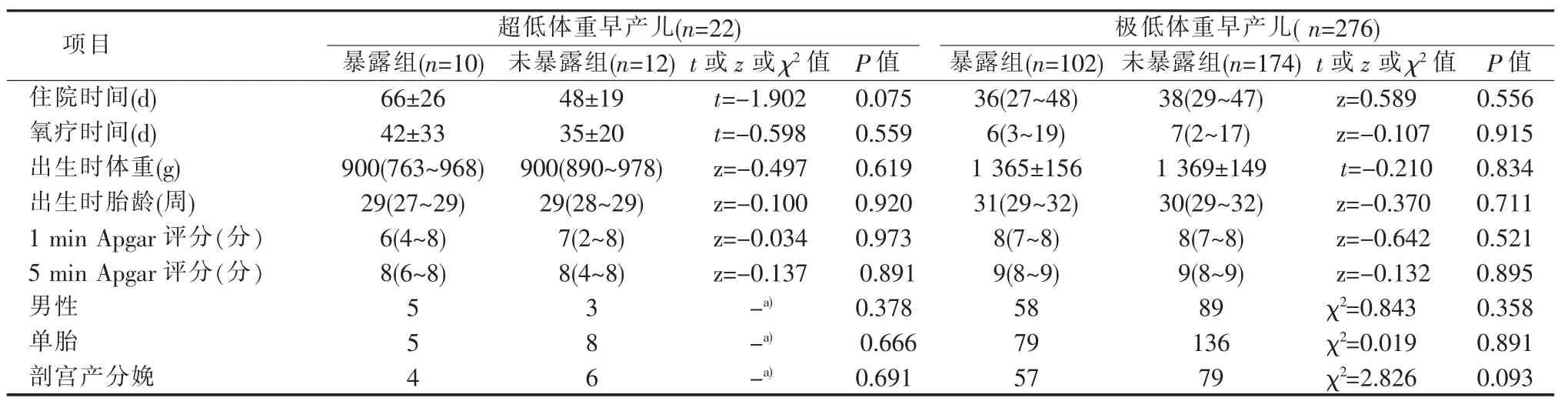
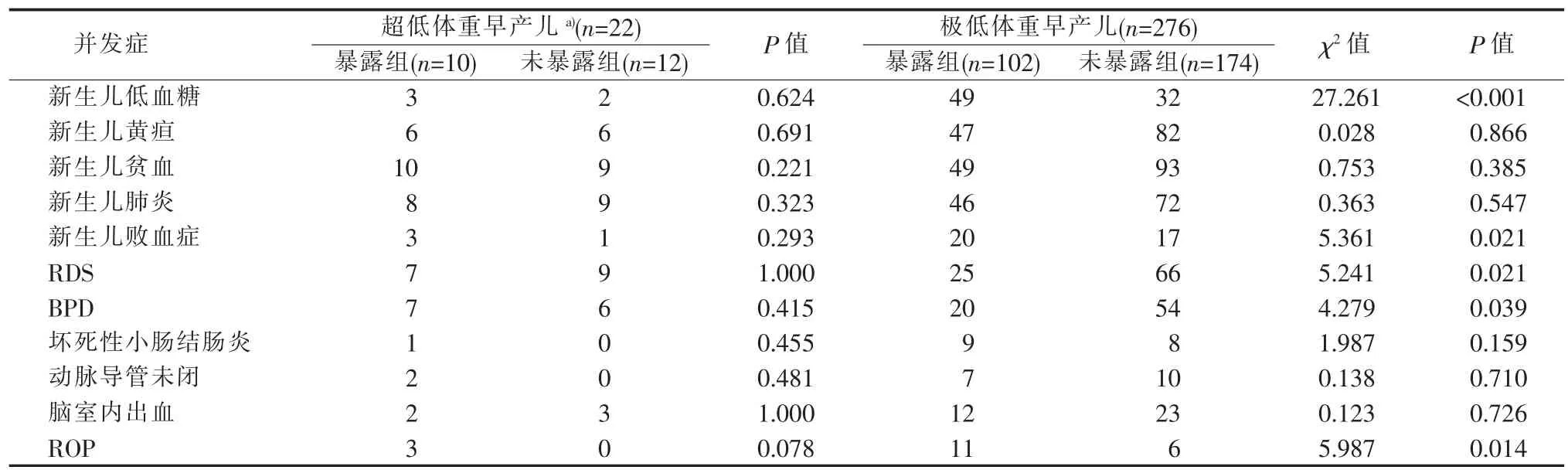
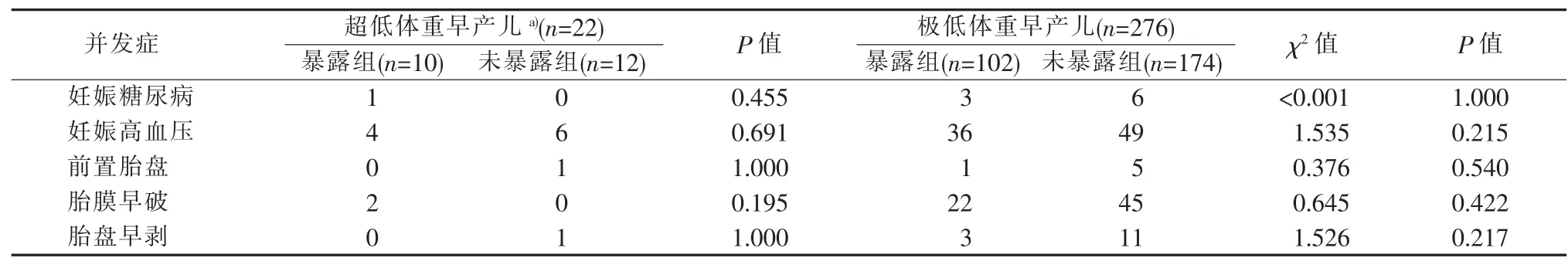
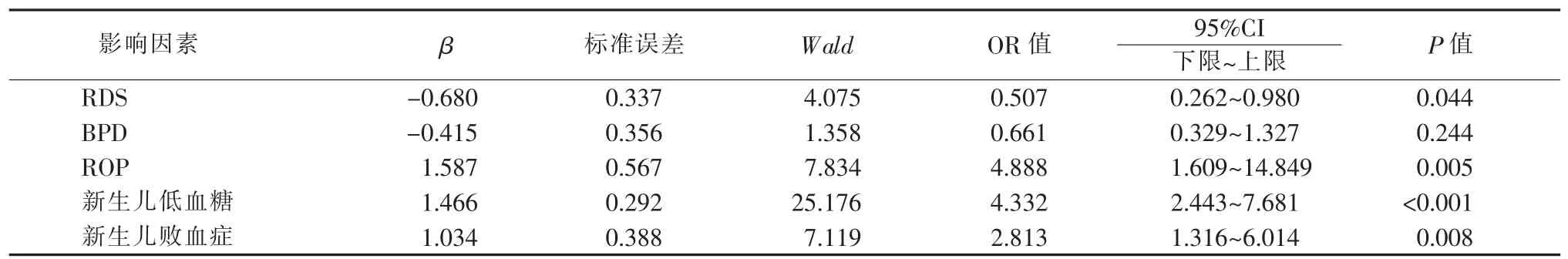
3.诊断标准:新生儿并发症诊断标准参照第4 版《实用新生儿学》;孕母产前并发症诊断标准参照第4 版《实用妇产科学》;③极低体重早产儿是指1 000 g 4.统计学处理:应用SPSS 25.0 软件包对数据进行统计学分析。非正态分布连续变量用中位数(median,M)(Q1~Q3) 表示,组间比较采用Mann-Whitney U 检验;正态分布连续变量用±s 表示,组间比较用两独立样本t 检验;计数资料采用例表示,组间比较使用χ2检验或Fisher 精确检验。对单因素P<0.05 的变量进行二元Logistic 回归分析。P<0.05 时认为差异有统计学意义。 本研究纳入的355 例早产儿中有57 例死亡,298 例存活。29 例超低体重早产儿中,暴露组12 例,死亡2 例;未暴露组17 例,死亡5 例,2 组间差异无统计学意义(P>0.05)。326 例极低体重早产儿中,暴露组111 例,死亡9 例;未暴露组215 例,死亡41 例,暴露组和未暴露组的病死率分别为8.1%和19.1%,未暴露组的病死率明显高于暴露组,差异有统计学意义(χ2=6.774,P=0.009)(见表1)。 暴露组(10 例)与未暴露组(12 例)存活的超低体重早产儿组间性别、出生体重、胎龄、出生后1 min及5 min 的Apgar 评分、胎数、分娩方式、住院时间、氧疗时间差异均无统计学意义 (P>0.05);存活的276 例极低体重早产儿中,暴露组(102 例)与未暴露组(174 例)间比较,以上各项目及指标间差异亦无统计学意义(P>0.05)(见表2)。 表1 暴露组与未暴露组的极低和超低体重早产儿出生后的生存转归[n(%)] 存活的22 例超低体重早产儿中,暴露组与未暴露组间的新生儿黄疸、新生儿贫血、新生儿肺炎、新生儿低血糖、新生儿败血症、坏死性小肠结肠炎、动脉导管未闭、脑室内出血、RDS、BPD、ROP 发生率比较,差异无统计学意义(P>0.05)(见表3)。存活的276 例极低体重早产儿中,暴露组与未暴露组间的新生儿黄疸、新生儿贫血、新生儿肺炎、坏死性小肠结肠炎、动脉导管未闭、脑室内出血的发生率比较,差异无统计学意义(P>0.05);暴露组的新生儿低血糖、新生儿败血症、ROP 发生率高于未暴露组,而RDS(24.5%比37.9%)、BPD(19.6%比31.0%)发生率则低于未暴露组,差异均有统计学意义 (P<0.05)(见表3)。 在极低体重早产儿以及超低体重早产儿中,各自的暴露组与未暴露组的组间比较,其孕母孕期的妊娠糖尿病、妊娠高血压、胎膜早破、胎盘早剥、前置胎盘发生率差异均无统计学意义(P>0.05)(见表4)。 表2 暴露组与未暴露组的极低和超低体重早产儿一般资料比较 采用二元logistic 回归模型对单因素P<0.05 的变量进一步行统计分析,结果显示,孕妇产前地塞米松暴露是极低体重早产儿出生后发生BPD 的独立保护因素(P>0.05),但是极低体重早产儿出生后发生新生儿低血糖、新生儿败血症、RDS、ROP 的独立危险因素(P<0.05)(见表5)。 据统计,全世界的早产儿出生率占新生儿出生率的5%[7],早产仍然是导致新生儿死亡的主要原因。随着产科技术的不断发展,临床对有早产风险的孕妇广泛开展产前使用地塞米松。但发展中国家与发达国家在产前地塞米松的使用比例上存在很大差距[8]。在澳大利亚,胎龄为23~28+6周[9]、23~31+6周[10]孕妇的糖皮质激素使用率高达90%以上。我国一项多中心研究则显示,24~34+6孕周的孕妇产前地塞米松使用率仅为53.3%[11]。在本研究纳入的355 例极低体重和超低体重早产儿中,产前地塞米松的使用率仅为34.6%,远低于国内外水平,其原因可能为部分产妇由基层医院转入我院,转入前未给予地塞米松治疗,而转到我院后多为急产,再予地塞米松为时已晚;本研究排除了产前使用地塞米松多个疗程以及不足1 个疗程的患者,导致产前地塞米松总体使用率较低;此外,保胎失败也可造成产前地塞米松使用率统计结果偏低[12]。 产前使用地塞米松可以降低新生儿生后一些并发症的发病率及死亡率,从而改善预后[10,13-14]。本研究结果显示,极低体重早产儿中地塞米松暴露组的死亡率明显低于未暴露组(8.1%比19.1%),差异有统计学意义(χ2=6.774,P=0.009);而在超低体重早产儿中,地塞米松暴露组的死亡率虽有低于未暴露组的趋势,但差异尚无统计学意义 (P>0.05),考虑与本研究的样本量较小有关,同时本研究排除了放弃治疗的患儿,可能也有一定影响。 表3 暴露组与未暴露组的极低和超低体重早产儿出生后并发症比较(n) 表4 暴露组与未暴露组的极低和超低体重早产儿其母亲孕期并发症比较(n) 表5 暴露组与未暴露组极低体重早产儿出生后并发症的多因素分析 1.地塞米松使用与RDS、BPD 间的关系:本研究中极低体重早产儿地塞米松暴露组的RDS 发生率明显低于未暴露组(24.5%比37.9%),差异有统计学意义(P<0.05),且产前使用地塞米松是RDS 发生的独立保护因素 (OR=0.507,95%CI 为0.262~0.980)。同时还发现,极低体重早产儿地塞米松暴露组的BPD 发生率明显低于未暴露组 (19.6%比31.0%),差异有统计学意义(P<0.05),但多因素分析结果提示,2 组间BPD 的发生风险差异无统计学意义(OR=0.661,95%CI 为0.329~1.327),这可能与RDS、BPD 的发病机制有关。RDS 主要是由于肺表面活性物质缺乏所致,当孕母产前使用地塞米松时,可以促进胎儿肺表面活性物质分泌,改善肺泡顺应性,从而促进其肺发育成熟。但BPD 的病因多种多样,如高浓度氧的暴露、气压伤、容量伤、炎症反应等[15]。本研究经Logistic 回归分析显示,孕妇产前使用地塞米松是BPD 发生的独立保护因素。一项针对10 541 例胎龄为22~25 周早产儿的队列研究显示,孕妇使用地塞米松可以预防RDS 的发生,但其预防BPD 的作用则尚不确定[16]。本研究显示,超低体重早产儿中,地塞米松暴露组与未暴露组间的RDS、BPD 发生率差异无统计学意义(P>0.05),可能与本研究超低体重早产儿的样本量较小有关。目前关于早产儿BW 与产前使用地塞米松的关系尚不明确,仍需大样本多中心的研究。 2.地塞米松使用与新生儿低血糖间的关系:Pettit 等[17]、Gyamfi-Bannerman 等[18]的研究表明,产前使用糖皮质激素的新生儿出生后更易发生低血糖,本研究也得出相似的结论,且产前使用糖皮质激素是极低体重早产儿出生后发生低血糖的独立危险因素 (OR=4.332,95% CI 为2.443~7.681)。但Kirshenbaum 等[19]的研究表明,然有产前地塞米松暴露的新生儿出生后虽有更易发生低血糖的倾向,但差异尚无统计学意义。孕母使用地塞米松可导致极低体重早产儿出生后低血糖的发生率增加,其机制可能类似于孕妇妊娠糖尿病对新生儿生后血糖的影响[20]。有文献报道,使用地塞米松可使胎儿脐血C肽和葡萄糖处于一个较高的水平[21],导致新生儿出生后体内出现一过性的高胰岛素血症,从而发生低血糖。本研究的超低体重早产儿中,地塞米松暴露组与未暴露组间的新生儿低血糖发生率差异无统计学意义(P>0.05)。目前,关于孕母产前使用糖皮质激素与早产儿出生后发生低血糖间关系的研究较少,其相关机制尚不明确,还有待于进一步研究。 3.地塞米松使用与ROP、新生儿败血症间的关系:本研究还发现,在极低体重早产儿中,地塞米松暴露组的ROP、新生儿败血症发生率均高于未暴露组,差异有统计学意义(P<0.05),且孕母产前使用糖皮质激素是极低体重早产儿出生后发生ROP、新生儿败血症的独立危险因素(OR=4.888,95% CI 为1.609~14.849;OR=2.813,95% CI 为1.316~6.014)。而在超低体重早产儿中,暴露组与未暴露组间的ROP、新生儿败血症发病率比较,差异无统计学意义(P>0.05)。本研究中的超低体重早产儿的BW 范围为650 g~990 g,极低体重早产儿与超低体重早产儿的样本量差异较大,且超低体重早产儿样本量小,可能是造成地塞米松对极低体重早产儿与超低体重早产儿ROP、新生儿败血症影响的差异。但目前关于孕母产前糖皮质激素与新生儿ROP、新生儿败血症间关系的研究较少,关于地塞米松在ROP、新生儿败血症发生中的作用机制以及相互关系尚不明确,有待进一步研究了解。 总之,孕母使用地塞米松可以降低极低体重早产儿的病死率,同时降低其RDS 和BPD 的发生率,但会使其新生儿低血糖、ROP、新生儿败血症的发生率增加。因此,对于孕母产前使用地塞米松的早产儿,在出生后应更加关注其血糖水平及发生ROP和感染的风险。孕母产前使用地塞米松是改善早产儿预后的较大医学进展之一,但其在临床上的应用还面临着一些问题和挑战,如糖皮质激素神经发育、心血管问题、代谢等潜在的长期不利影响。本研究仅对产前地塞米松暴露与早产儿出生后早期并发症之间的关系进行了分析,今后将继续加强纵向随访。现阶段临床应加强产科与新生儿科间的合作,同时加强基层医院产科医师的培训,提高产前地塞米松的使用率,并进行多中心研究,根据孕母体重、孕期并发症、胎儿情况等差异制定个体化的产前地塞米松治疗方案,以使早产儿获益最大化;同时还应加强对孕母产生使用地塞米松的早产儿的随访工作,关注其远期预后,以明确产前使用地塞米松对早产儿远期的影响,从而使地塞米松被更好地应用于临床。结 果
一、暴露组与未暴露组的极低和超低体重早产儿出生后的生存转归比较
二、暴露组与未暴露组的极低和超低体重早产儿一般资料比较

三、暴露组与未暴露组的极低和超低体重早产儿出生后的并发症比较
四、暴露组与未暴露组的极低和超低体重早产儿其孕母孕期的并发症
五、多因素分析
讨 论
一、地塞米松使用与生存结局
二、地塞米松使用与极低、超低体重早产儿出生后早期并发症间的关系

