血清白蛋白与纤维蛋白原比值与接受放疗的原发性肺癌患者预后的关系
房咏,周洁,王畅,徐莹,任雪,姜曈,阎英
肺癌是全球范围内发病率最高、死亡率增长最快的恶性肿瘤之一,对人类的健康和生命造成极大威胁[1]。放疗作为肺癌治疗的重要组成部分,对于不同分期的肺癌均有潜在的治疗作用。据报道,在小细胞肺癌的治疗中,约54%的患者在其病程的不同时期需要接受放疗,而非小细胞肺癌放疗患者占60%~70%[2]。尽管在放疗技术及设备方面已取得了长足的进展,但是肺癌患者的长期生存率仍然很低[3]。
研究表明,白蛋白水平降低和高纤维蛋白原水平升高与肺癌预后不良显著相关[4-5]。高纤维蛋白原血症和低蛋白血症与非小细胞肺癌的复发、转移和生存率低显著相关[6-7]。然而,并不是所有的肿瘤患者会在同一时间出现血清白蛋白水平的降低和纤维蛋白原水平的升高,因此与单一指标相比,反映综合状态的指标更具说服力。白蛋白与纤维蛋白原比值(albumin to fibrinogen ratio,AFR)可以反映肿瘤患者营养和凝血的综合状态。研究发现,AFR与非小细胞肺癌患者的预后相关,在接受手术或化疗的非小细胞肺癌患者中,AFR是影响预后的因素之一[8]。然而,迄今为止,AFR与接受放疗的肺癌患者预后之间的相关性,尚无明确的定论。因此,本研究回顾性分析在接受放疗的肺癌患者中,AFR是否可以作为放疗后生存的有效预测指标,以期为肺癌放疗提供有益的指导依据。
1 资料与方法
1.1 病例纳入和排除标准
病例纳入标准:(1)接受放疗;(2)病理学证实为肺癌,根据美国癌症联合会(American Joint Committeeon Cancer,AJCC)第8版肺癌TNM分期标准诊断为Ⅲ~Ⅳ期;(3)无严重的基础疾病;(4)获得患者或其直系亲属的知情同意,并签署放疗知情同意书,能够提供患者的详细资料。
病例排除标准:(1)既往接受过放疗;(2)未按计划完成放疗;(3)重要脏器功能的严重异常;(4)肿瘤治疗信息不完整。
1.2 一般临床资料
收集2014年1月1日—2018年12月29日在北部战区总医院放疗科诊治的144例诊断为Ⅲ~Ⅳ期肺癌的患者。其中,男性118例、女性26例;中位年龄为62岁(范围:0~86岁);小细胞肺癌64例,腺癌27例,鳞癌47例,其他病理类型6例;Ⅲa期33例,Ⅲb期42例,Ⅲc期16例,Ⅳ期53例(包括双侧肺转移、对侧肺转移、胸膜转移、肝转移);单纯放疗33例,序贯放化疗105例,同步放化疗6例(表1)。
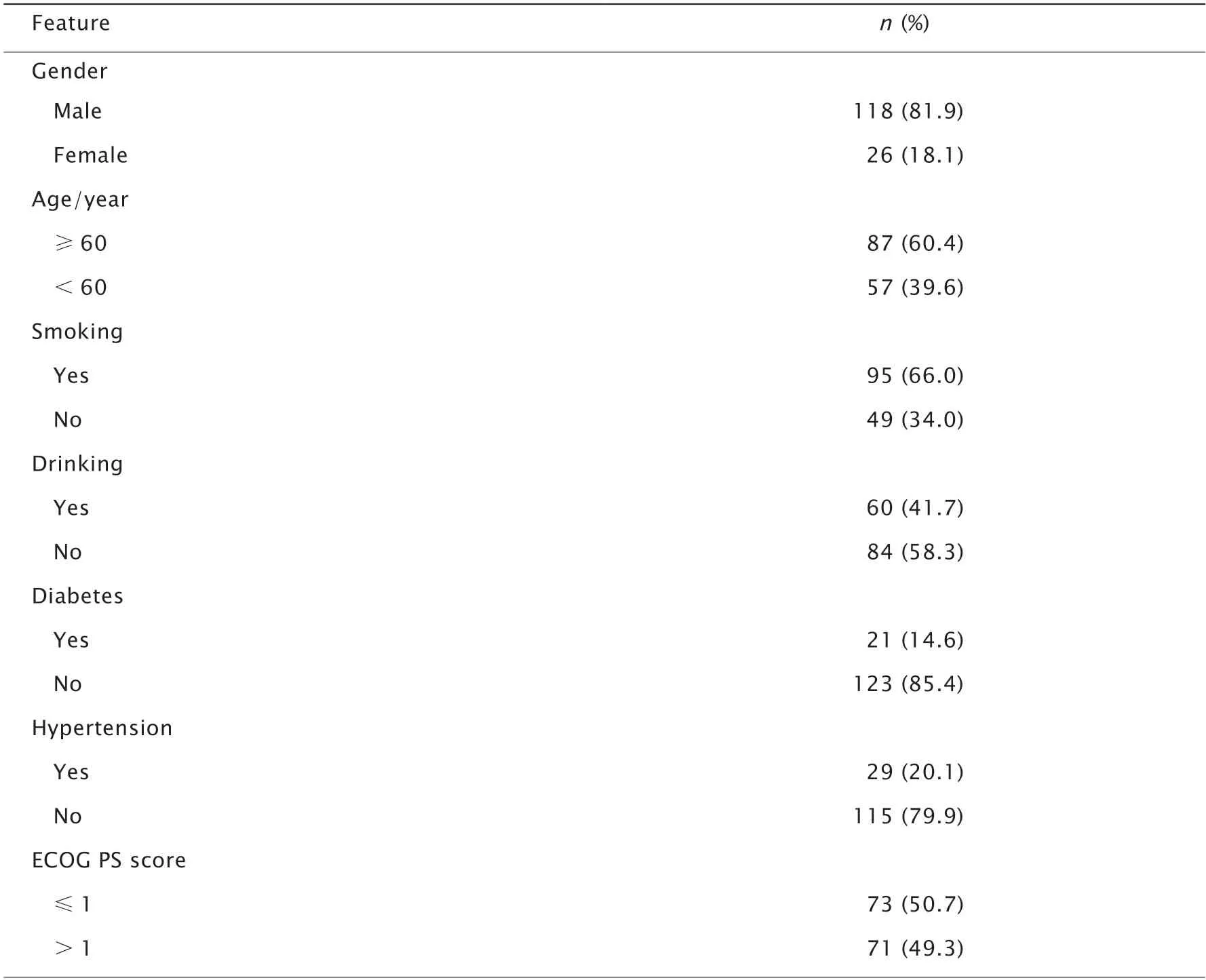
表1 144例Ⅲ~Ⅳ期肺癌患者的一般临床特征Table 1 Clinical features of 144 patients with stage Ⅲ-Ⅳ lung cancer(N=144)

表1(续)144例Ⅲ~Ⅳ期肺癌患者的一般临床特征Table 1 (continued) Clinical features of 144 patients with stage Ⅲ-Ⅳ lung cancer(N=144)
1.3 治疗方案
1.3.1 放疗与血液学指标检测
144例Ⅲ~Ⅳ期肺癌患者接受胸部放疗,采用直线加速器6 MV X线。使用CT模拟机定位,将CT图像传输至Pinnacle计划系统,根据定位CT图像勾画靶区,处方剂量大体肿瘤体积(gross tumor volume,GTV)为36~69 Gy,分割次数为5~30次,单次剂量为1.8~11 Gy/次,1次/d。95% GTV受到的照射剂量≥处方剂量,正常器官限量在可接受范围内。
首次放疗前7 d内(33例因体弱、高龄或个人因素拒绝联合化疗而仅接受放疗,在首次放疗前3 d内采集血液样本)依据放疗结束后采集血液样本检测AFR。
1.3.2 化疗
144例患者中,111例患者接受序贯放化疗或同步放化疗。(1)小细胞肺癌化疗方案为EP方案(依托泊苷100 mg/m2d 1~3+顺铂80 mg/m2d 1,21 d为1个化疗周期,4~6个周期;依托泊苷100 mg/m2d 1~3+卡铂药时曲线下面积为5 d 1,21 d为1个化疗周期,4~6个周期)。(2)非小细胞肺癌化疗方案为TP、DP和PC方案(TP方案:紫杉醇135~175 mg/m2d 1+顺铂75 mg/m2d 1,21 d为1个化疗周期,4个周期;DP方案:多西他赛 75 mg/m2d 1+顺铂 75 mg/m2d 1,21 d为1个化疗周期,4个周期;PC方案:培美曲塞500 mg/m2d 1+顺铂 75 mg/m2d 1,21 d为1个化疗周期,4个周期)。
1.4 随访
随访采用电话随访和门诊复查方式。随访截至2020年9月1日,平均随访时间为38个月,随访率为100%。总生存(overall survival,OS)期的定义是从治疗开始至死亡的时间或末次随访时间。无进展生存(progression-free survival,PFS)期的定义是从治疗开始至第1次肿瘤进展或死亡的时间。失访视为“截尾数据”。
1.5 疗效评价指标
治疗结束后进行疗效评价,包括影像学检查(胸部或腹部增强CT以及颅脑MRI等)和血液学指标(血常规、生化和凝血功能等)。
1.6 统计学方法
应用SPSS 26.0软件进行统计学分析。符合正态分布的定量资料采用t检验或近似t检验,偏态分布的数据采用Mann-WhitneyU检验。计数资料的比较采用χ2检验或Fisher精确概率法。绘制受试者工作特征曲线(receiver operating characteristic,ROC)曲线得到AFR的最佳临界值,将患者分为高AFR组和低AFR组。COX模型评估AFR与预后的关系。Kaplan-Meier法绘制生存曲线,二元logistic回归模型和COX比例风险回归模型确定AFR与肺癌患者放疗预后的关系。P<0.05为差异有统计学意义。
2 结果
2.1 生存结果
截至2020年9月,60例存活,84例死亡;无疾病进展26例,疾病进展118例。中位生存期为33.5个月(95%置信区间:22.3~44.7个月),1、3和5年OS率分别为79.0%、46.2%和38.7%;中位PFS期为7.9个月(95%置信区间:6.9~8.9个月)。
2.2 放疗前AFR最佳临界值
应用ROC曲线确定AFR临界值(图1)。AFR最高约登指数为0.343,对应AFR为7.82(敏感度为96.3%,特异度为38%)。因此,选择7.82作为AFR最佳临界值[曲线下面积(area under curve,AUC)为0.618(95%置信区间:0.521~0.716);P=0.024]。
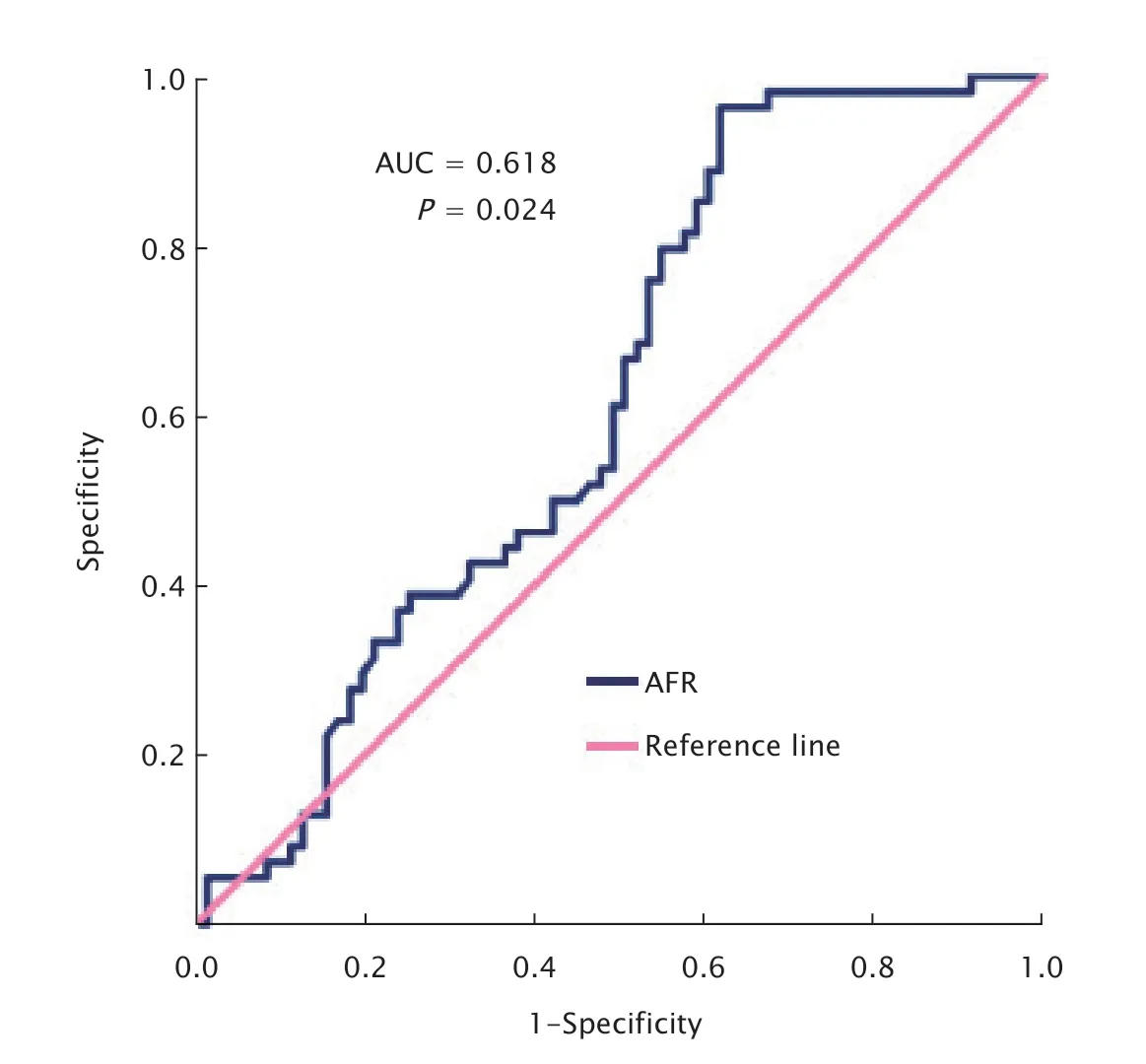
Fig.1 Receiver operating characteristic (ROC) curve of albumin to fibrinogen ratio (AFR) before radiotherapy in 125 patients with stages Ⅲ-Ⅳ lung cancer.AUC:Area under the curve.图1 125例Ⅲ~Ⅳ期肺癌患者放疗前AFR的ROC曲线
2.3 放疗前AFR与临床病理特征之间的关系
根据ROC曲线确定放疗前AFR最佳临界值,将125例患者分为放疗前高AFR组(AFR≥7.82,96例)和放疗前低AFR组(AFR<7.82,29例)。2组的临床病理特征差异无统计学意义(P>0.05,表2)。
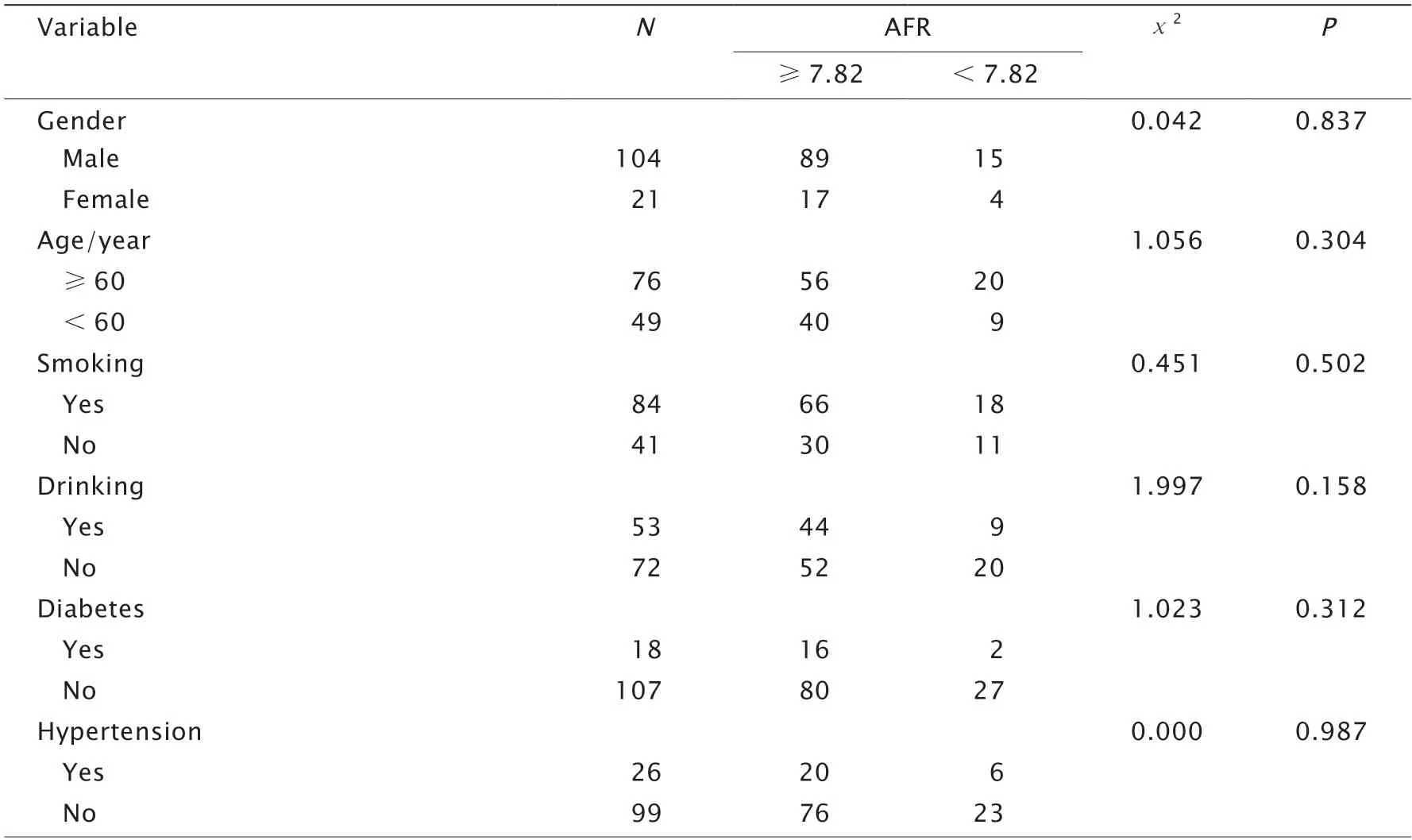
表2 Ⅲ~Ⅳ期肺癌患者放疗前AFR与临床病理特征之间的关系Table 2 Relationship between albumin to fibrinogen ratio (AFR) and clinicopathological characteristics of patients with stages Ⅲ-Ⅳ lung cancer before radiotherapy(n)
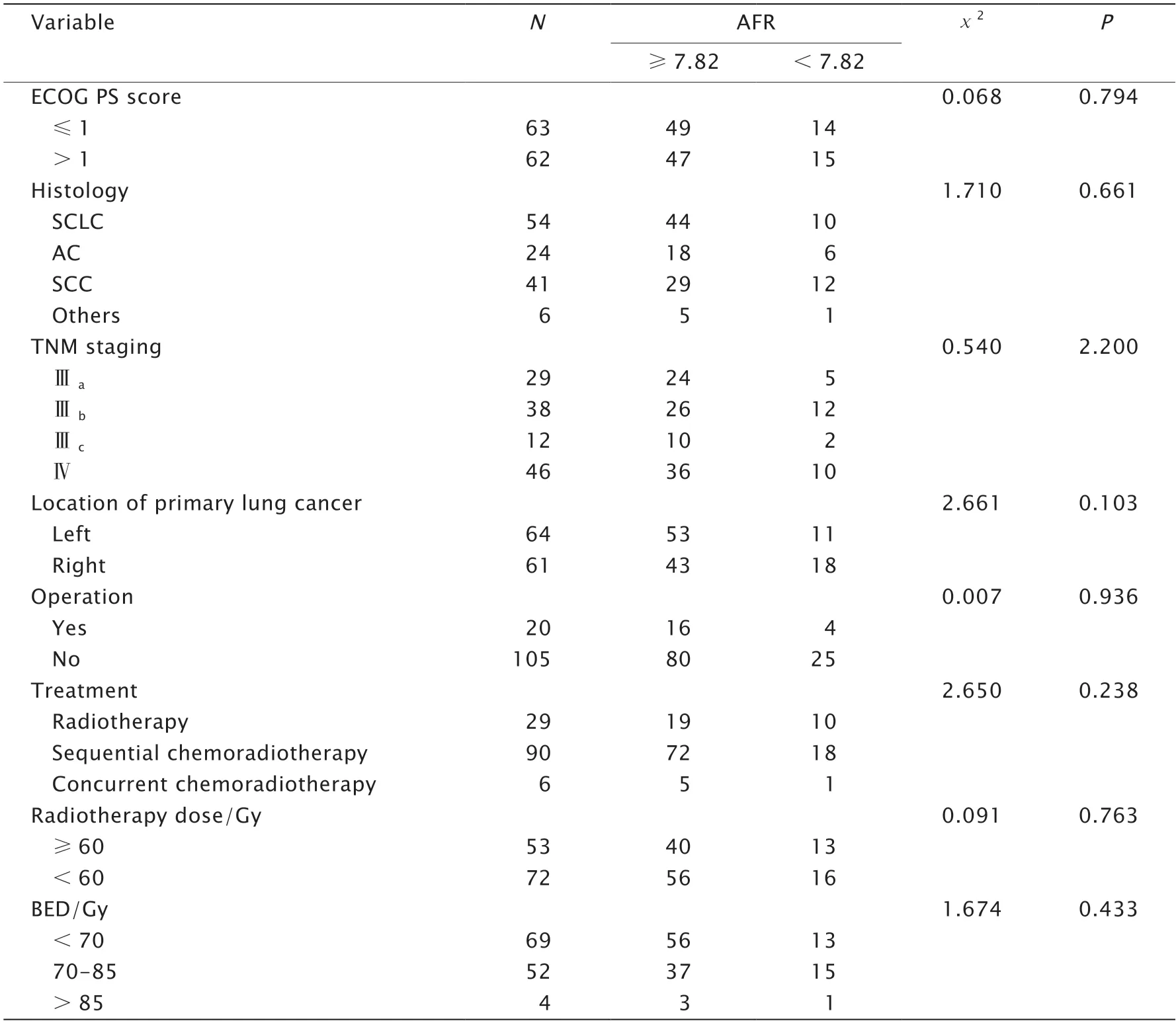
表2 (续)Ⅲ~Ⅳ期肺癌患者放疗前AFR与临床病理特征之间的关系Table 2 (continued) Relationship between albumin to fibrinogen ratio (AFR) and clinicopathological characteristics of patients with stages Ⅲ-Ⅳ lung cancer before radiotherapy(n)
2.4 OS与PFS的影响因素
应用ROC曲线确定放疗前白细胞计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数、白蛋白水平、纤维蛋白原水平和中性粒细胞与淋巴细胞计数比值(neutrophil to lymphocyte ratio,NLR)的最佳临界值分别为5.15×109/L、1.45×109/L、0.95×109/L、0.85×109/L、158.5×109/L、37.05 g/L、4.91 g/L和0.93。
单因素分析结果显示,肿瘤原发部位(P=0.005)、中性粒细胞计数(P=0.042)、单核细胞计数(P=0.038)、血小板计数(P=0.034)、纤维蛋白原水平(P<0.001)、NLR(P=0.025)和放疗前AFR(P<0.001)均与OS相关(表3);多因素分析结果显示,肿瘤原发部位[风险比为0.540(95%置信区间:0.325~0.897);P=0.017]、单核细胞计数[风险比为0.431(95%置信区间:0.208~0.893);P=0.024]和放疗前AFR[风险比为0.377(95%置信区间:0.149~0.950);P=0.039]是OS的独立预后因素。单因素分析结果显示,糖尿病(P=0.022)、中性粒细胞计数(P=0.004)、NLR(P=0.006)和AFR(P=0.001)均与PFS相关(表3);多因素分析结果显示,放疗前AFR是PFS的独立预后因素[风险比为0.402(95%置信区间:0.243~0.664);P<0.001]。
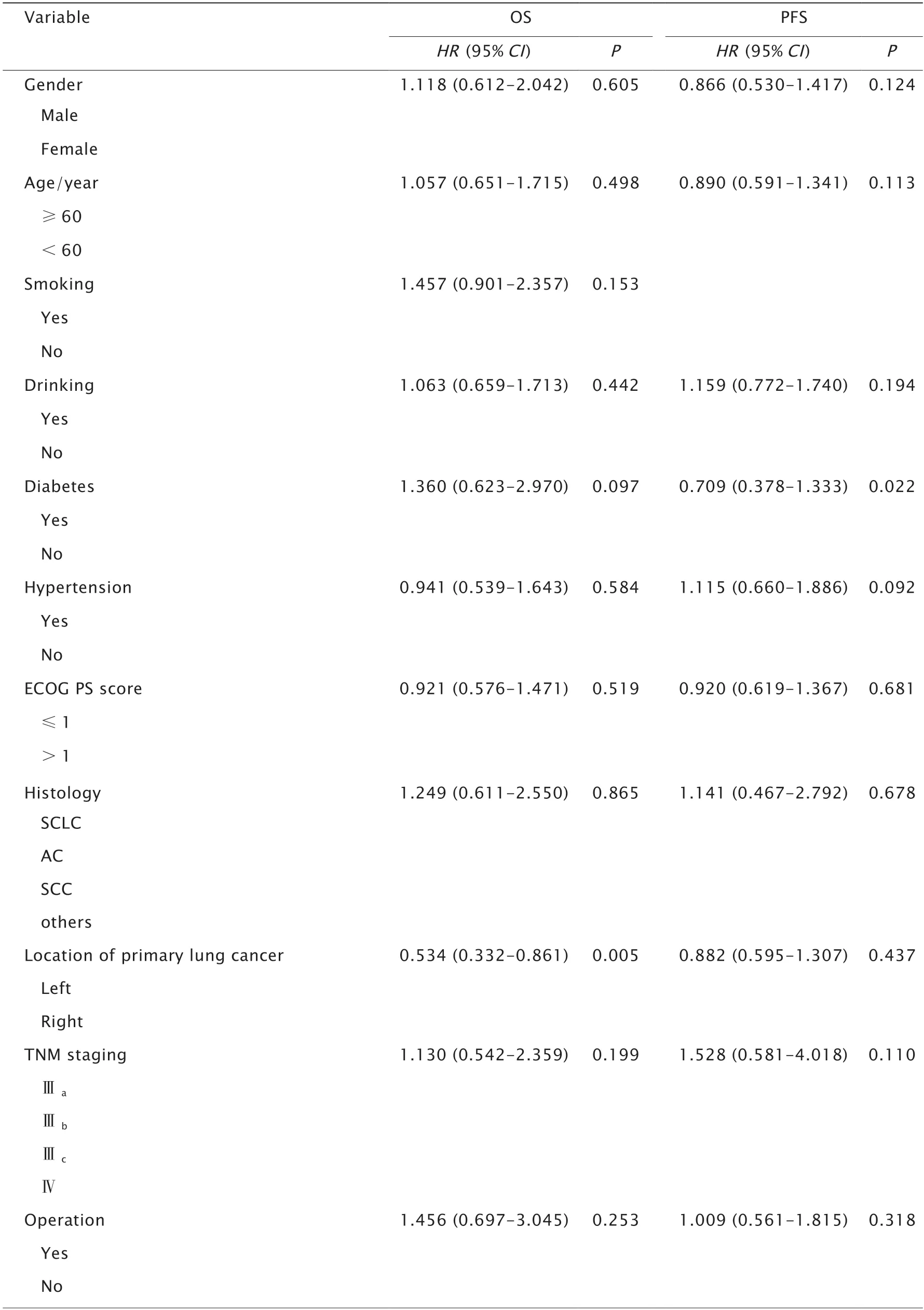
表3 125例Ⅲ~Ⅳ期肺癌放疗患者OS和PFS的单因素分析Table 3 Univariate analysis of overall survival (OS) and progression-free survival (PFS) of 125 patients with stages Ⅲ-Ⅳ lung cancer before radiotherapy

表3(续)125例Ⅲ~Ⅳ期肺癌放疗患者OS和PFS的单因素分析Table 3 (continued) Univariate analysis of overall survival (OS) and progression-free survival (PFS) of 125 patients with stages Ⅲ-Ⅳ lung cancer before radiotherapy
放疗前高AFR组的中位生存期长于放疗前低AFR组(分别为62.8个月和17.1个月,P<0.001)。放疗前高AFR组1、3和5年OS率分别为83.2%、57.0%和50.3%,放疗前低AFR组1、3和5年OS率分别为65.5%、17.2%和9.2%。放疗前高AFR组的中位PFS期长于放疗前低AFR组(分别为12.2个月和7.2个月,P=0.022),见图2。
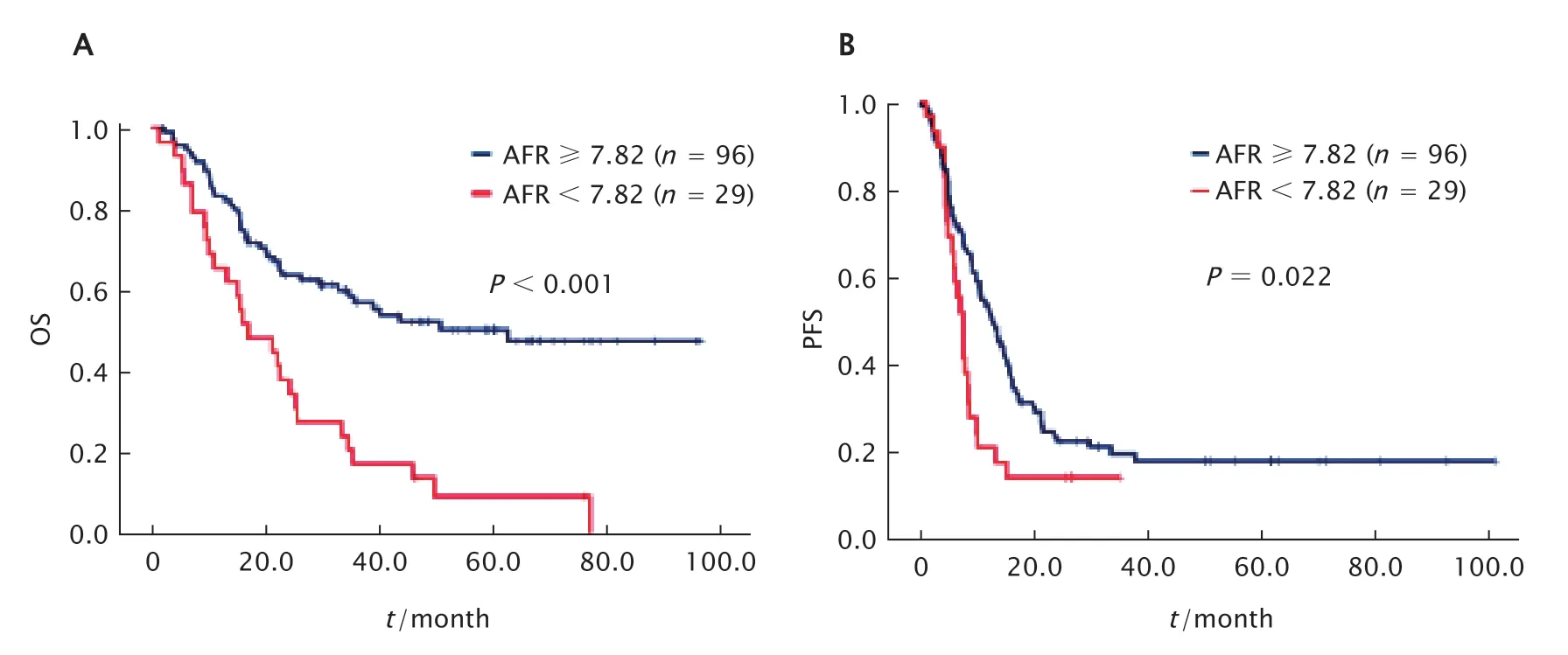
Fig.2 Comparison of survival of 125 patients with stagesⅢ-Ⅳ lung cancer according to different albumin to fibrinogen ratio (AFR) values before radiotherapy.A:Overall survival (OS);B:Progression-free survival(PFS).图2 125例Ⅲ~Ⅳ期肺癌患者放疗前不同AFR组的生存比较
2.5 放疗后AFR最佳临界值
根据ROC曲线确定放疗后AFR最佳临界值。放疗后AFR最高约登指数为0.215,对应AFR为7.63(敏感度为77.6%,特异度为43.9%),见图3。因此,选择7.63作为AFR临界值[AUC为0.618(95%置信区间:0.511~0.725);P=0.037]。
2.6 放疗后AFR与临床病理特征之间的关系
将106例患者分为放疗后高AFR组(AFR≥7.63,70例)和放疗后低AFR组(AFR<7.63,36例)。2组的临床病理特征差异无统计学意义(P>0.05,表4)。
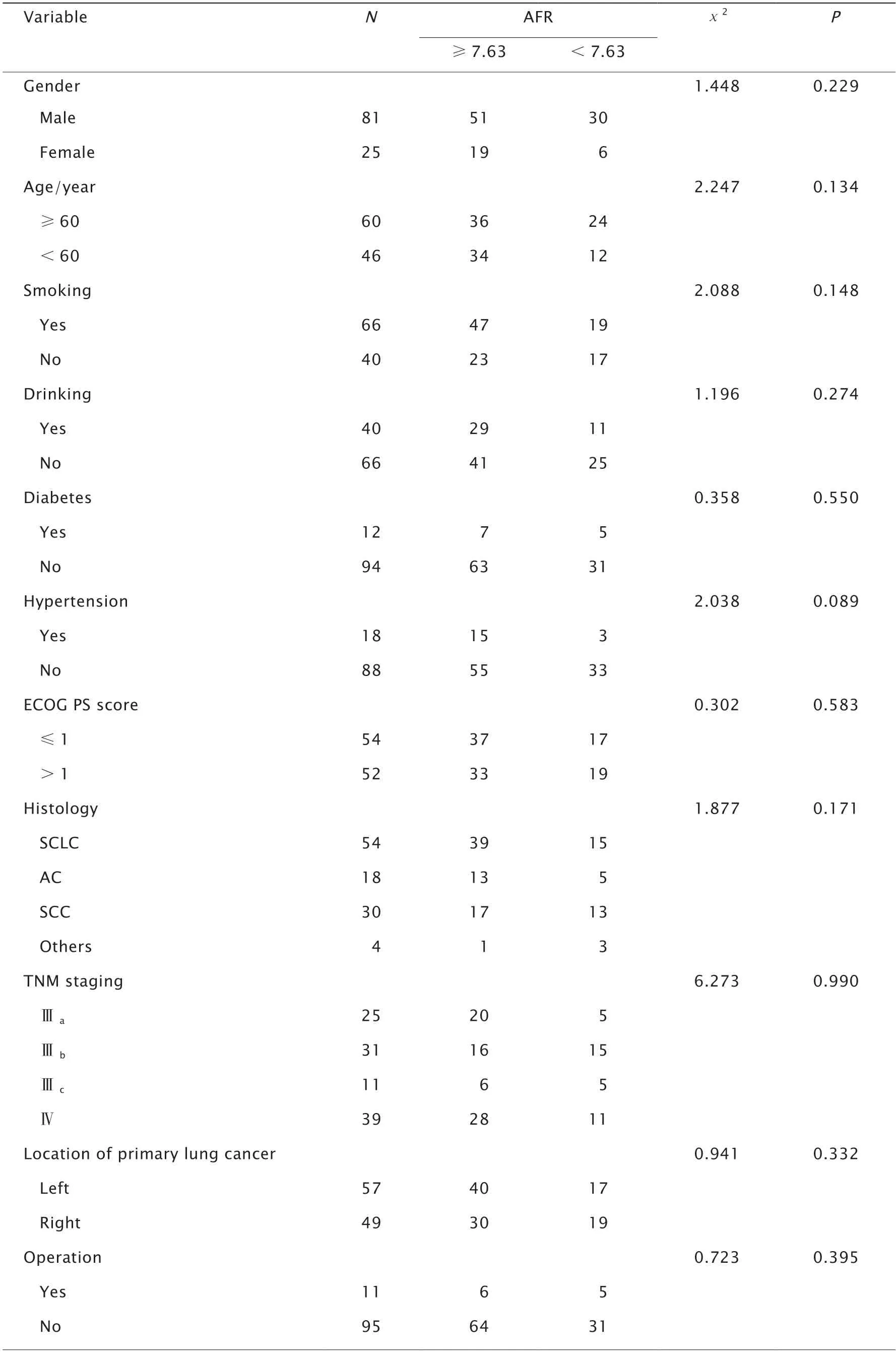
表4 Ⅲ~Ⅳ期肺癌患者放疗后AFR与临床病理特征之间的关系Table 4 Relationship between albumin to fibrinogen ratio (AFR) and clinicopathological characteristics of patients with stages Ⅲ-Ⅳ lung cancer after radiotherapy(n)
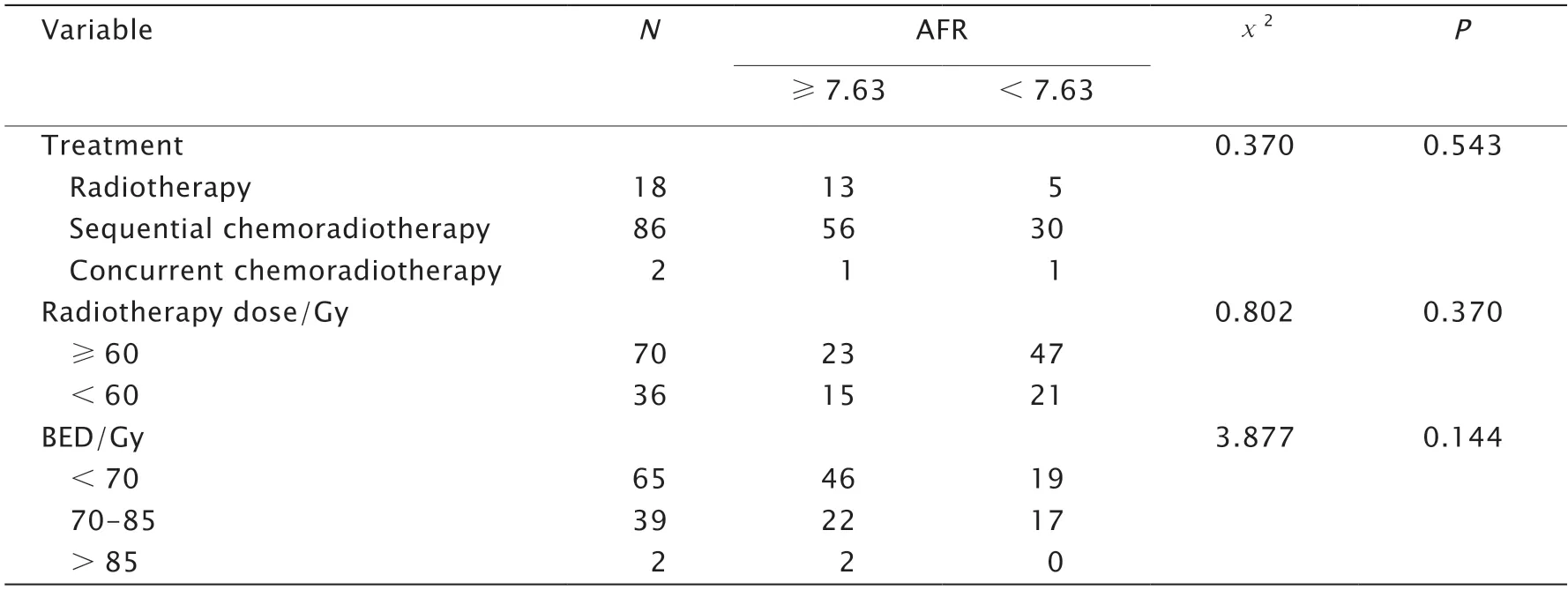
表4(续)Ⅲ~Ⅳ期肺癌患者放疗后AFR与临床病理特征之间的关系Table 4 (continued) Relationship between albumin to fibrinogen ratio (AFR) and clinicopathological characteristics of patients with stages Ⅲ-Ⅳ lung cancer after radiotherapy(n)

Fig.3 Receiver operating characteristic (ROC) curve of albumin to fibrinogen ratio (AFR) after radiotherapy in 106 patients with stages Ⅲ-Ⅳ lung cancer.AUC:Area under the curve.图3 106例Ⅲ~Ⅳ期肺癌患者放疗后AFR的ROC曲线
2.7 OS与PFS的影响因素
应用ROC曲线确定放疗前白细胞计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数、白蛋白水平、纤维蛋白原水平和NLR的最佳临界值分别为3.35×109/L、4.50×109/L、0.45×109/L、0.35×109/L、194.00×109/L、39.65 g/L、3.70 g/L和3.36。
单因素分析结果显示,肿瘤原发部位(P=0.027)、白蛋白水平(P=0.022)和放疗后AFR(P=0.020)均与OS相关(表5);多因素分析结果显示,放疗后AFR不是OS的独立预后因素(P>0.05)。
单因素分析结果显示,TNM分期(P=0.005)、白细胞计数(P=0.002)、单核细胞计数(P=0.019)和放疗后AFR(P=0.048)均与PFS相关(表5);多因素分析结果显示,放疗后AFR不是PFS的独立预后因素(P>0.05)。

表5 106例Ⅲ~Ⅳ期肺癌放疗患者OS和PFS的单因素分析Table 5 Univariate analysis of overall survival (OS) and progression-free survival (PFS) of 106 patients with stages Ⅲ-Ⅳ lung cancer after radiotherapy
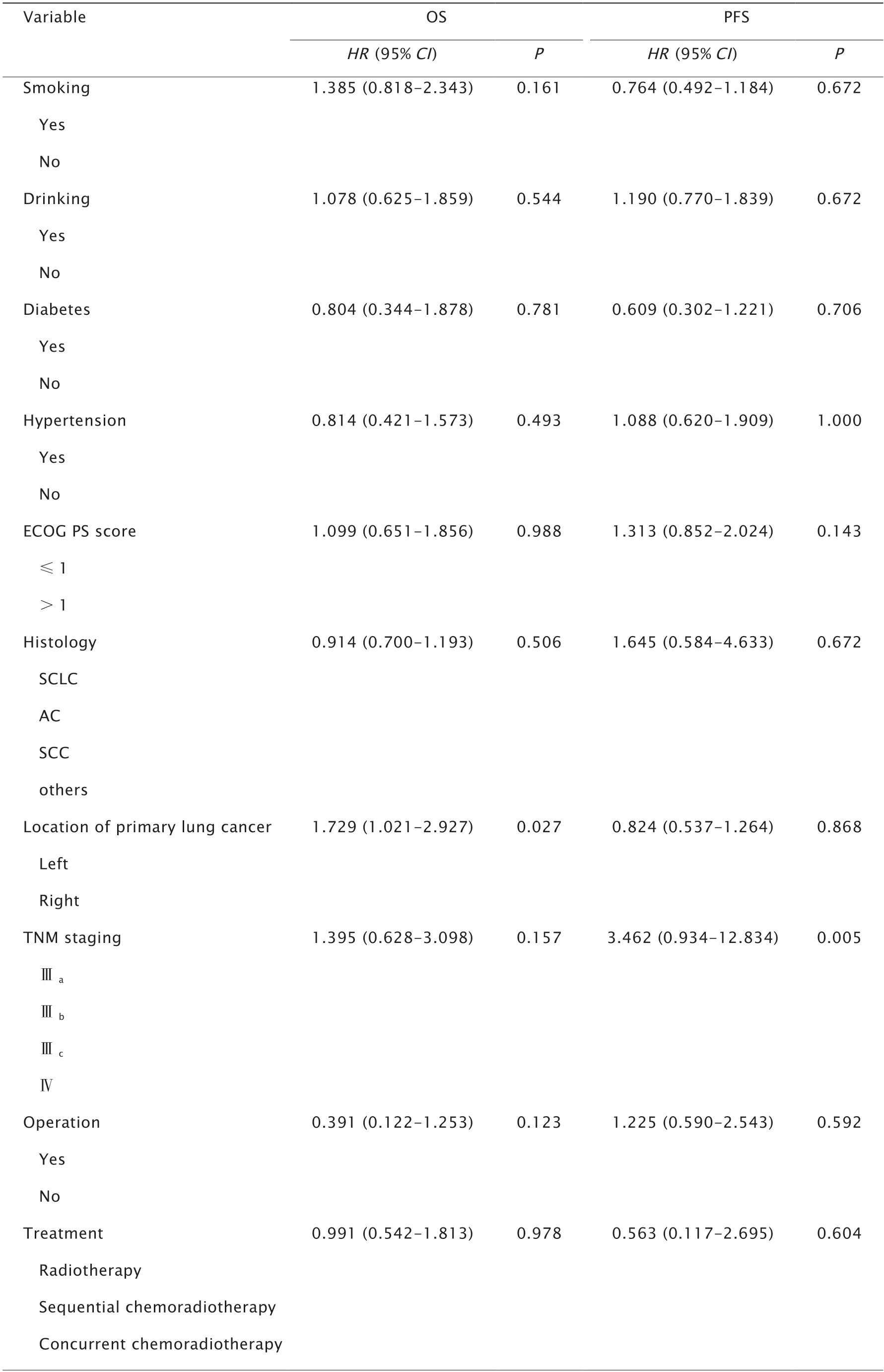
表5 (续1)106例Ⅲ~Ⅳ期肺癌放疗患者OS和PFS的单因素分析Table 5 (continued 1) Univariate analysis of overall survival (OS) and progression-free survival (PFS) of 106 patients with stages Ⅲ-Ⅳ lung cancer after radiotherapy
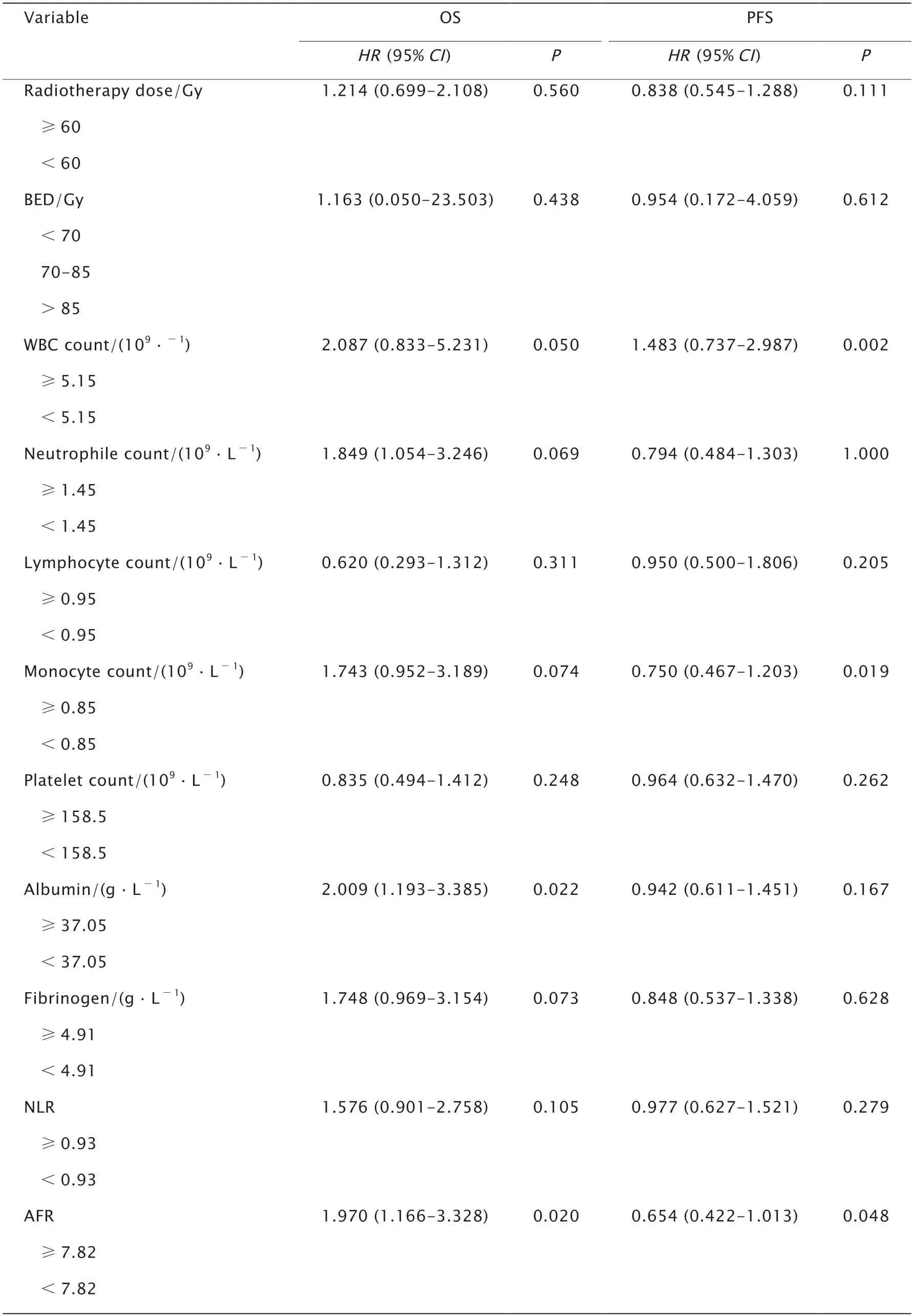
表5 (续2)106例Ⅲ~Ⅳ期肺癌放疗患者OS和PFS的单因素分析Table 5 (continued 2) Univariate analysis of overall survival (OS) and progression-free survival (PFS) of 106 patients with stages Ⅲ-Ⅳ lung cancer after radiotherapy
截至2020年9月,106例Ⅲ~Ⅳ期肺癌放疗患者中,49例存活,57例死亡;疾病进展90例,无疾病进展16例。放疗后高AFR组的中位生存期长于放疗后低AFR组(分别为50.9个月和16.7个月,P=0.010)。放疗后高AFR组1、3和5年OS率分别为87.1%、57.5%和47.0%,放疗后低AFR组1、3和5年OS率分别为69.4%、41.3%和37.2%。放疗前高AFR组的中位PFS期长于放疗前低AFR组(分别为8.8个月和4.2个月,P=0.001,图4)。
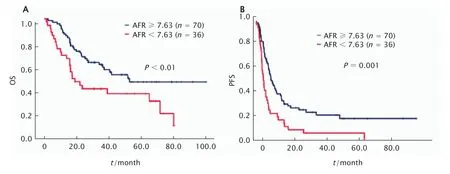
Fig.4 Comparison of survival of 106 patients with stages Ⅲ-Ⅳ lung cancer according to different albumin to fibrinogen ratio (AFR) values after radiotherapy.A:Overall survival (OS);B:Progression-free survival (PFS).图4 106例Ⅲ~Ⅳ期肺癌患者放疗后不同AFR组的生存比较
3 讨论
在肿瘤的治疗和疾病进展过程中,患者的凝血和营养状态是影响疗效和疾病进展的重要因素之一[9-11]。血清纤维蛋白原和白蛋白水平可以分别反映患者的凝血和营养状态。AFR反映了肿瘤患者凝血和营养的综合状态。AFR降低提示血清白蛋白水平下降或纤维蛋白原水平升高。目前,越来越多的研究将全身营养状况与凝血功能相结合以评估肿瘤患者的预后。本研究旨在探讨AFR与肺癌患者放疗预后的相关性。
本研究应用ROC曲线确定放疗前和放疗后AFR的最佳临界值分别为7.82和7.63(P=0.024,P=0.037),根据临界值将患者分为高AFR组和低AFR组。单因素分析结果显示,放疗前AFR与OS和PFS均相关(P<0.001,P=0.001),放疗后AFR也与OS和PFS均相关(P=0.020,P=0.048)。多因素分析结果显示,放疗前AFR与OS(风险比为0.377,P=0.039)和PFS(风险比为0.402,P<0.001)均独立相关。与放疗前高AFR组相比,低AFR组的中位生存期较短,疾病进展更早。放疗后AFR则与OS和PFS均无显著相关性(P>0.05)。相较于放疗前AFR,放疗后AFR对生存的影响明显减小,导致此结果的原因可能是放疗后低AFR组的患者中有一部分来自于放疗前高AFR组,因治疗后AFR降低,从而改善了生存结局。因此,给予患者预防性营养干预以提高治疗前AFR,可以使患者取得更好的生存获益。
肿瘤进展可诱导宿主反应,促进炎症因子分泌,抑制血清白蛋白合成,从而导致低白蛋白血症[12]。纤维蛋白原作为一种急性期蛋白,主要由肝脏产生。炎症因子的分泌可以显著促进纤维蛋白原的产生,破坏凝血平衡,增加血栓风险。此外,部分恶性肿瘤细胞可以产生纤维蛋白原[13-14]。肿瘤晚期血清白蛋白合成受抑也可能是导致AFR下降的原因。目前,已有研究报道AFR可以作为肿瘤患者的独立预后因素,并且AFR的高低与OS和PFS相关[15-21]。一项关于术前AFR与非小细胞肺癌患者预后的相关性研究[22]显示,与低AFR组相比,高AFR组患者的术后OS和PFS更好(P<0.001);低AFR组的OS率为64.2%,高AFR组的OS率为85.0%(P<0.001);与低AFR组相比,高AFR组的DFS率较高(40.0%vs65.8%,P<0.001),这一结果与本研究的结果相似。
除血液学指标以外,一些临床病理特征也可能是肺癌放疗患者的预后因素。本研究的预后单因素分析结果显示,肿瘤原发部位(P=0.017)是OS的预后因素,与肿瘤原发于右肺相比,肿瘤原发于左肺的患者的中位生存期较长,今后尚需进一步验证;糖尿病也与PFS相关(P=0.022)。既往有研究发现,糖尿病患者较非糖尿病患者的存活时间更长[23],但是LUO等[24]的前瞻性研究却发现糖尿病肺癌患者的OS不如糖尿病肺癌患者,呈现出相反的结果,因此尚待进一步验证。
综上所述,AFR是Ⅲ~Ⅳ期肺癌放疗患者的独立预后因素。鉴于本研究为回顾性研究,且样本量较小,因此今后尚需开展更大样本的前瞻性研究以验证研究结果,为肺癌的个体化放疗提供理论依据。