系统免疫炎症指数对食管癌放疗患者预后的影响
赵彦,祝淑钗,沈文斌,王旋,宋春洋,李曙光,许金蕊,苏景伟,李娟
食管癌发病率位居中国常见恶性肿瘤发病率第5位,其死亡率位居第4位[1],由于发病隐匿,早期诊断率低,对晚期、老龄或有严重基础疾病的患者,根治性放化疗是主要的治疗手段。尽管放疗技术不断进步,化疗药物不断更新,但食管癌的总体预后仍不尽如人意。因此,筛选能够预测食管癌预后的指标是研究热点。
研究表明,全身炎性反应与肿瘤的进展和转移有关,对多种恶性肿瘤的预后具有重要的预测价值[2-3]。系统免疫炎症指数(systemic immuneinflammation index,SII)是基于中性粒细胞、血小板和淋巴细胞3种外周血细胞的系统性炎性反应指标。研究显示,SII可有效预测肺癌、肝癌和结直肠癌等恶性肿瘤的预后[4-7],对食管癌预后的预测价值也得到了初步证实[8-10]。然而,既往研究纳入的病例大多为接受手术治疗的食管癌患者,而有关SII在接受放疗的食管癌患者中的预后预测价值,则报道较少。本研究回顾性分析106例接受根治性放疗的食管癌患者的临床资料,分析SII变化趋势及其对预后的影响,以期为临床实践提供参考。
1 资料与方法
1.1 病例选择标准
病例纳入标准:(1)经组织学或细胞学证实为食管鳞状细胞癌,需要接受根治性放疗,并且放疗之前未接受化疗等其他抗肿瘤治疗;(2)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分;(3)无重要器官功能障碍。
病例排除标准:(1)有放疗禁忌证;(2)患有严重的基础疾病影响肿瘤治疗;(3)合并其他恶性肿瘤。
1.2 一般临床资料
回顾性收集2013—2017年在河北医科大学第四医院放疗科接受根治性放疗的符合病例选择标准的106例食管癌患者的临床资料,其中男性60例、女性46例;中位年龄为66岁(范围:44~90岁)。根据中国非手术治疗食管癌专家组提出的食管癌临床分期标准进行分期,其中Ⅰ期7例、Ⅱ期40例、Ⅲ期59例;病变位于颈段13例、胸上段20例、胸中段52例、胸下段21例;接受联合化疗55例,其中接受同期化疗31例、序贯化疗24例,化疗方案均以顺铂为基础。
1.3 放疗
106例食管癌患者均接受调强放疗,参照定位CT图像,结合食管钡餐造影、内窥镜检查、超声诊断和(或)PET(CT)等影像学资料勾画靶区。靶区包括食管原发肿瘤及转移淋巴结,处方剂量为54~68 Gy,选择性食管淋巴引流区处方剂量为46~52 Gy,单次剂量为1.8~2.0 Gy,放疗1次/d,5次/周。正常组织的放疗耐受剂量限制:双肺V5≤60%,V20≤30%,V30≤20%;心脏平均照射剂量<30 Gy,V25≤50%,V40≤30%,脊髓最大照射剂量<45 Gy。
1.4 SII检测
分别于放疗前、放疗期间每周以及放疗结束时进行血常规检查。SII=(血小板计数×中性粒细胞计数)/淋巴细胞计数。通过建立受试者工作特征(receiver operating characteristic,ROC)曲线,确定放疗前SII最佳临界值,并根据SII最佳临界值,将患者分为低SII组和高SII组。
1.5 血清前白蛋白和白蛋白检测
分别于放疗前、放疗期间每周以及放疗结束时检测血清前白蛋白和白蛋白水平。
1.6 随访
放疗后2年期间,每3个月随访1次;2年后,每6个月随访1次。随访方式以门诊随访和电话随访为主。随访截至2020年5月31日。总生存期的定义是从确诊至死亡或末次随访的时间。根据美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准对不良反应进行评价。
1.7 统计学方法
应用SPSS 23软件进行统计学分析。采用ROC曲线确定SII最佳临界值,Pearson相关性分析评估SII与临床病理特征之间的关系,观察SII变化趋势。Kaplan-Meier法计算总生存率,应用COX风险回归模型进行食管癌放疗患者预后的单因素和多因素分析。P<0.05为差异有统计学意义。
1.8 伦理学
本研究符合《赫尔辛基宣言》,所有患者均签署知情同意书,并经过河北医科大学第四医院伦理委员会批准。
2 结果
2.1 SII与食管癌放疗患者临床病理特征之间的关系
以总生存期为终点,绘制SII的ROC曲线(图1),确定放疗前SII最佳临界值为646.8(敏感度为57.3%,特异度为70.8%),根据SII最佳临界值(646.8),将106例患者分为高SII组(SII≥646.8,51例)和低SII组(SII<646.8,55例)。高SII组和低SII组患者的临床病理特征见表1,2组的性别、年龄、病变部位、T分期和淋巴结转移的差异均无统计学意义(P>0.05),仅TNM分期的差异有统计学意义(P=0.028)。Pearson相关性分析结果显示,SII与血清前白蛋白(r=-0.403,P=0.002)和白蛋白(r=-0.405,P<0.001)水平均呈负相关(图2)。
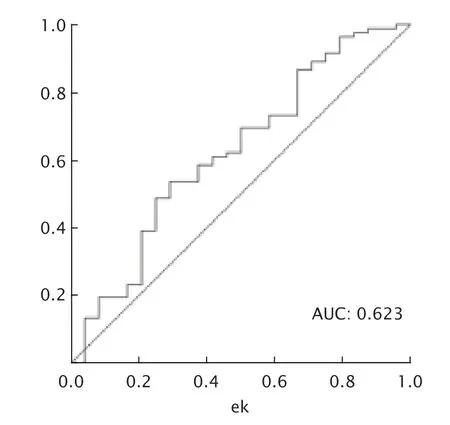
Fig.1 Receiver operating characteristic curve of the patients with esophageal squamous cell carcinoma according to SII (systemic immune-inflammation index).AUC:Area under the curve.图1 食管癌患者放疗前SII的受试者工作特征曲线
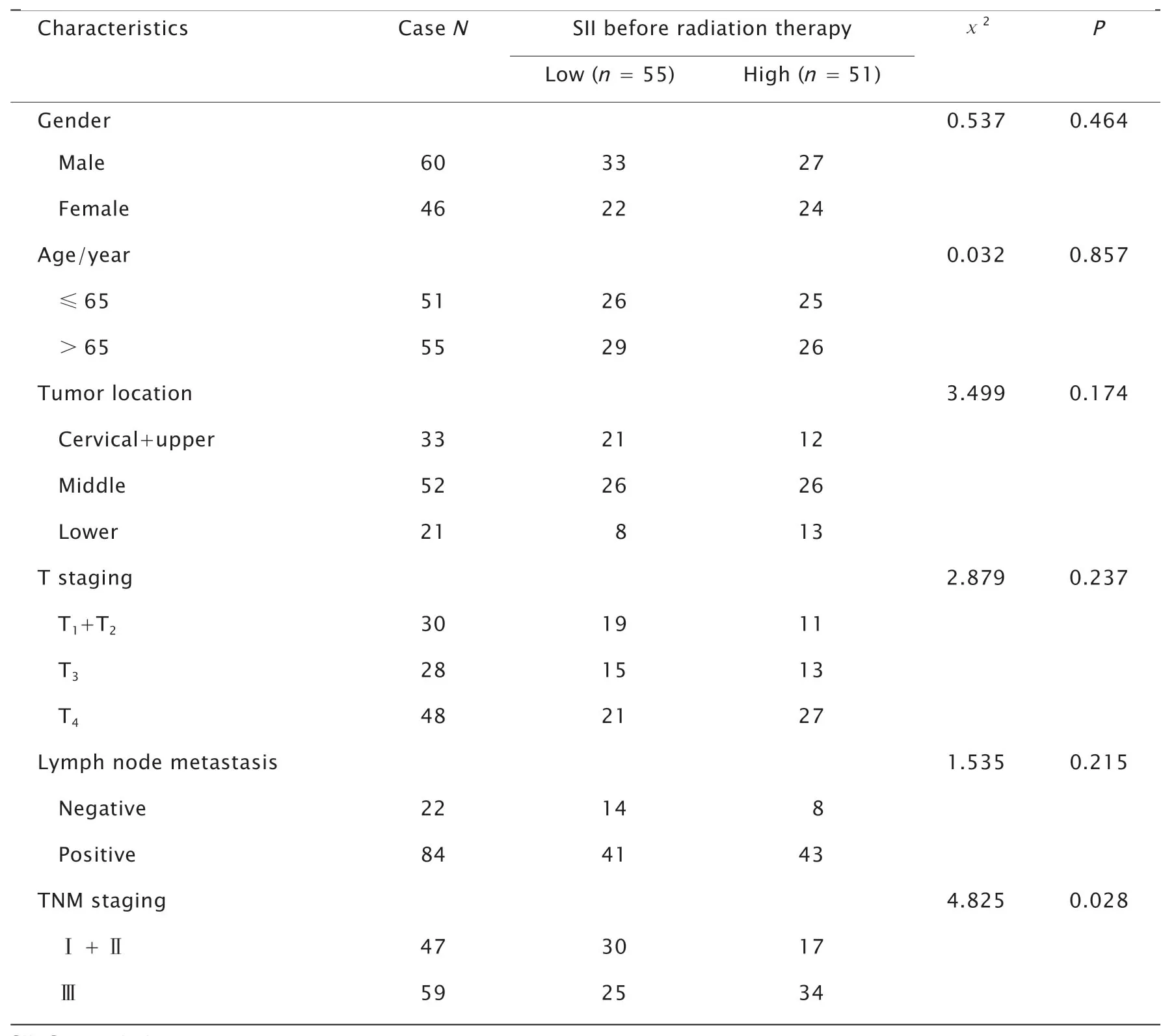
表1 106例食管癌患者放疗前SII与临床病理特征之间的关系Table 1 The relationship between SII before radiation therapy and clinical characteristics of 106 patients with esophageal squamous cell carcinoma undergoing radical radiotherapy
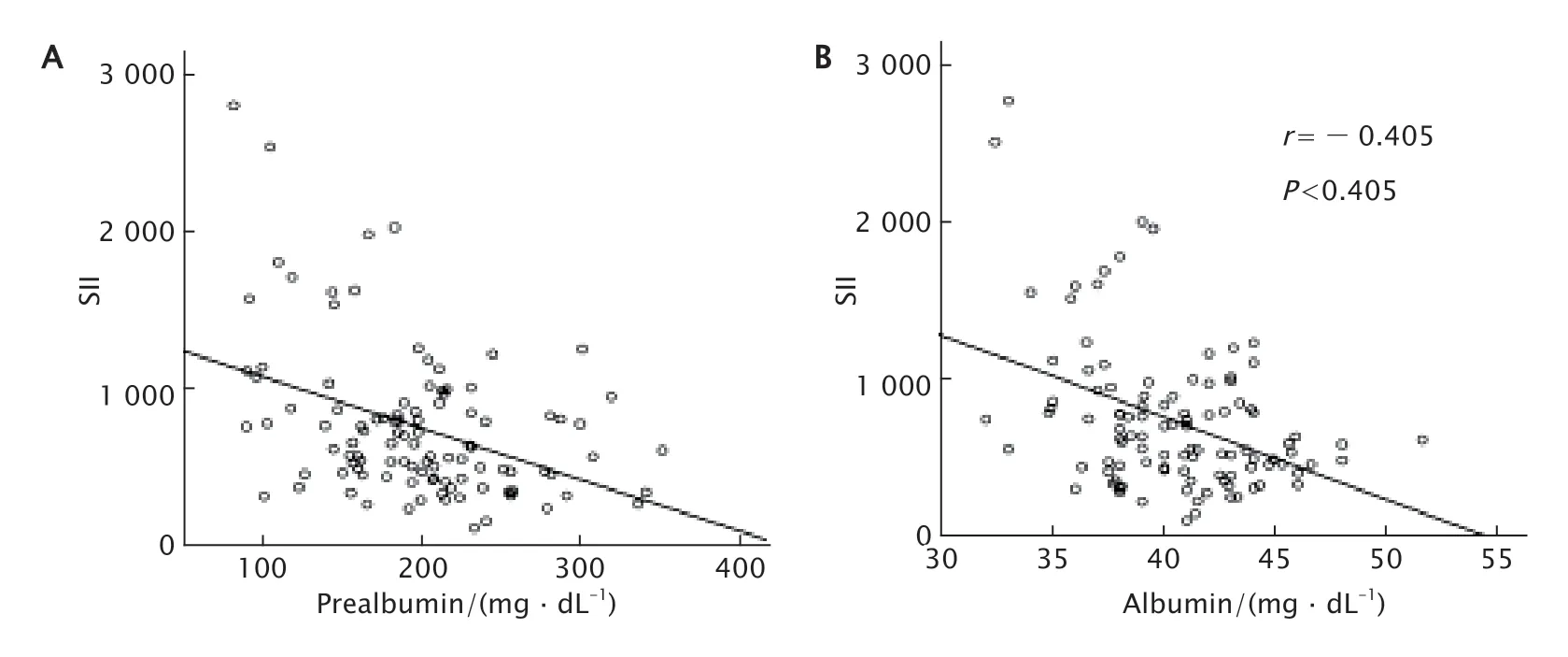
Fig.2 Correlations of SII with serum prealbumin (A) and albumin (B) before radiation therapy were assessed using Pearson’s correlation analysis in 106 patients with esophageal squamous cell carcinoma undergoing radical radiotherapy SII:systemic immune-inflammation index图2 106例食管癌患者SII与血清前白蛋白(A)和白蛋白(B)水平的相关性
2.2 SII变化趋势
采用106例食管癌患者放疗前、放疗期间每周以及放疗结束时的SII平均值绘制箱式图(图3)。放疗期间,SII呈上升趋势。分别计算106例食管癌患者、高SII组患者和低SII组患者每周SII平均值,并且绘制拟合曲线(方程式分别为y=625e0.219x、y=828e0.194x、y=454e0.247x)(y是SII平均值,x是放疗时间),结果提示SII平均值随放疗时间逐渐升高(P<0.001)。
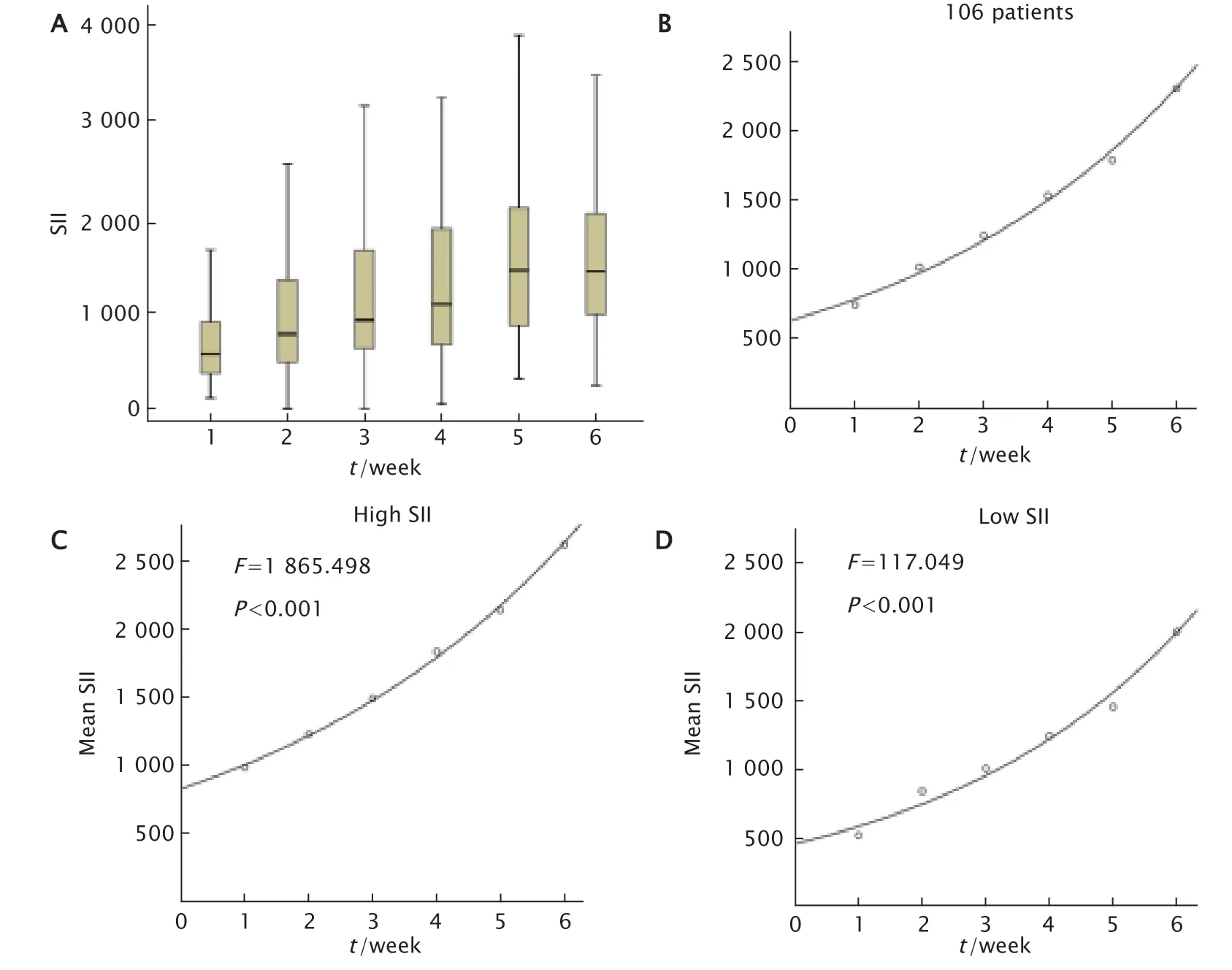
Fig.3 The change trend of SII (systemic immune-inflammation index) during radiotherapy in 106 patients with esophageal squamous cell carcinoma undergoing radical radiotherapy.A:The box plot of SII during radiotherapy;B:The change trend of mean SII of 106 patients;C:The change trend of mean SII in high SII group;D:The change trend of mean SII in low SII group.图3 106例食管癌患者放疗期间SII变化趋势
2.3 SII与生存之间的关系
随访率为96.2%。106例食管癌患者1年、3年和5年总生存率分别为76.4%、36.6%和22.9%,中位生存期为24.2个月(95%置信区间:18.974~29.426)。放疗前,高SII组患者1年、3年和5年总生存率分别为62.7%、26.3%和15.0%,低SII组患者1年、3年和5年总生存率分别为89.1%、46.4%和30.2%。Kaplan-Meier曲线显示,高SII组患者总生存率明显低于低SII组(P=0.003,图4)。
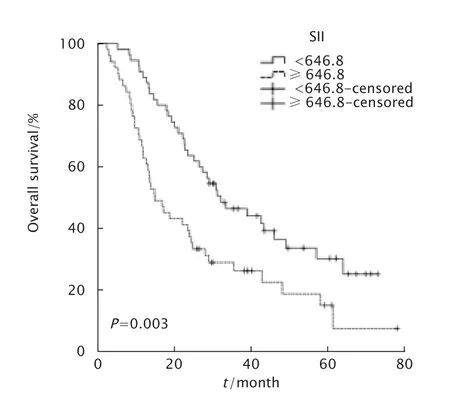
Fig.4 Kaplan-Meier curves of survival based on SII (systemic immune-inflammation index) in 106 patients with esophageal squamous cell carcinoma undergoing radical radiotherapy.图4 106例食管癌患者高SII组与低SII组Kaplan-Meier生存曲线
2.4 预后相关因素分析
单因素分析结果显示,病变部位(P=0.026)、TNM分期(P<0.001)、放疗方式(P=0.001)、放疗处方剂量(P=0.001)、化疗(P=0.002)及SII(P=0.003)为总生存影响因素。多因素预后分析显示,TNM分期(P=0.002)、放疗处方剂量(P=0.276)和SII(P=0.011)为总生存独立影响因素(表2)。
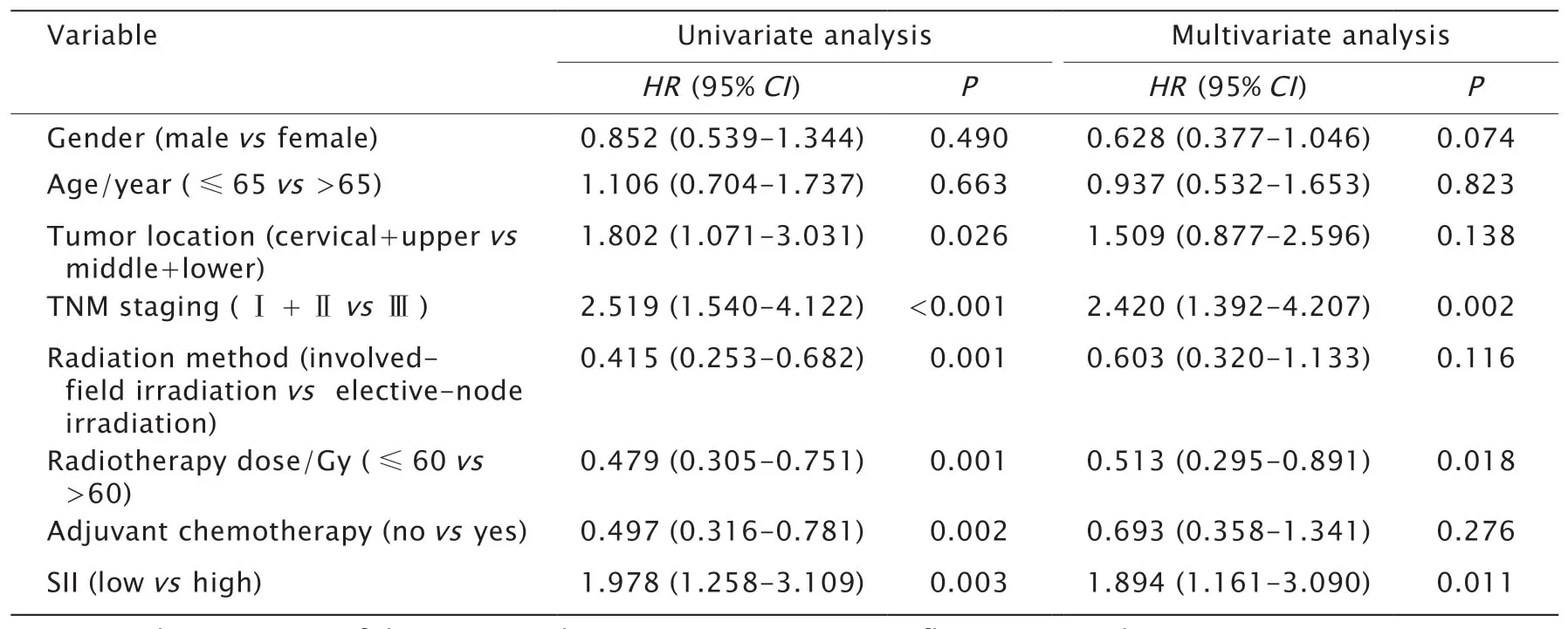
表2 106例食管癌放疗患者总生存的单因素及多因素分析Table 2 Univariate and multivariate analyses of prognostic factors for overall survival of 106 patients with esophageal squamous cell carcinoma undergoing radical radiotherapy
2.5 SII与放疗不良反应
高SII组患者≥2级放射性食管炎和≥2级放射性肺炎的发生率均高于低SII组患者(分别为P=0.003和P=0.007,表3);高SII组与低SII组患者≥2级血液学不良反应的差异无统计学意义(P>0.05,表3)。
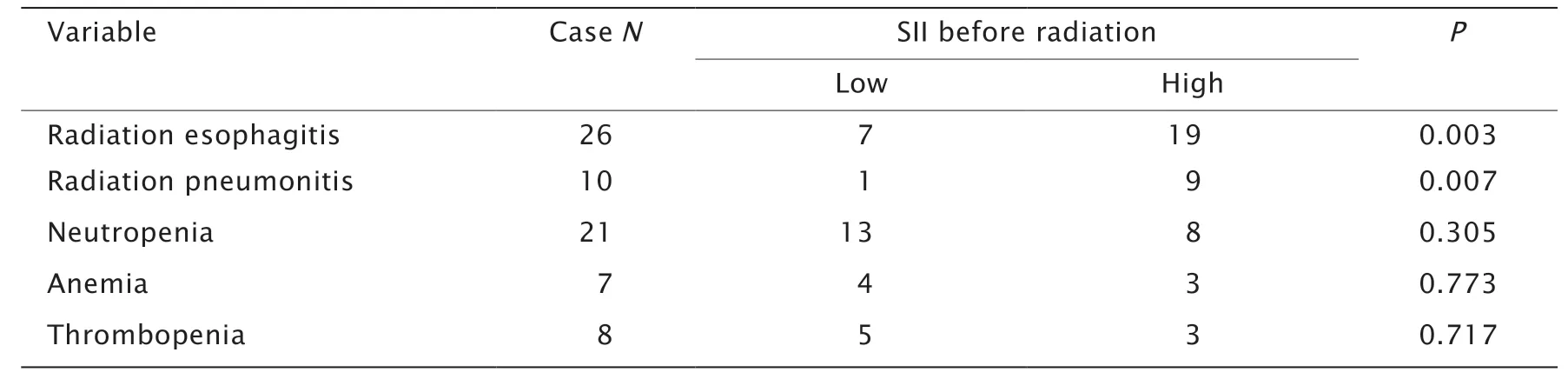
表3 106例食管癌患者放疗前SII与放疗急性不良反应(≥2级)之间的关系Table 3 Relationship of SII before radiation therapy with acute adverse reactions (≥grade 2) of 106 patients with esophageal squamous cell carcinoma undergoing radical radiotherapy(n)
3 讨论
研究证实,TNM分期是食管癌预后的重要影响因素[11]。本研究的多因素分析结果显示,TNM分期是食管癌放疗患者总生存的独立影响因素,与既往研究报道的结果一致。目前,临床上判断食管癌患者预后的临床因素主要为TNM分期,但在实际工作中经常遇见同样分期的患者接受同样的治疗,却得到不同的生存结果,因此除TNM分期以外,探索其他影响食管癌预后的指标具有重要意义,可以为临床决策提供一定的参考。
研究已证明,系统性炎症可以促进肿瘤进展和转移,在肿瘤的发生和发展中发挥重要作用[12-13]。全身性炎性反应指标如中性粒细胞与淋巴细胞计数比值、血小板与淋巴细胞计数比值以及单核细胞与淋巴细胞计数比值,均是食管癌等多种恶性肿瘤的独立预后因素[14-15]。基于中性粒细胞、血小板和淋巴细胞计数的SII是肺癌、肝癌和结直肠癌等恶性肿瘤的独立预后因素[4-7]。GENG等[8]首次报道了SII对食管癌患者预后的影响,通过对916例接受食管癌根治术的食管癌患者进行回顾性分析,发现SII是生存的独立影响因素,并且其预测价值优于中性粒细胞与淋巴细胞计数比值、血小板与淋巴细胞计数比值,以及单核细胞与淋巴细胞计数比值。ZHANG等[16]对655例食管鳞癌根治术患者进行回顾性分析,发现术前高SII是预后的有效预测指标。GAO等[17]回顾性分析了468例行根治术的食管鳞癌患者,发现SII可以作为可手术的食管鳞癌患者的简单且颇有前景的预后预测指标,高SII与性别和术中失血有关,分层分析发现SII也是Ⅰ~Ⅱ期和Ⅲ期患者的预后影响因素。既往关于SII对食管癌患者预后影响的研究主要关注于可手术患者,而对接受根治性放疗的食管癌患者预后相关因素的相关研究很少。本研究分析了106例接受根治性放疗的食管癌患者,结果显示放疗前高SII组患者总生存率明显低于低SII组患者,多因素分析显示SII水平是接受放疗的食管癌患者总生存率的独立影响因素,这与既往研究的结果一致。SII与肿瘤患者总生存率相关性的机制尚不明确。肿瘤介导的骨髓细胞生成及其过程中释放的多种细胞因子可以促进肿瘤血管生成以及肿瘤细胞侵袭和转移,帮助肿瘤细胞逃避免疫监视,并且诱导肿瘤细胞对细胞毒药物的抵抗[18]。同时,中性粒细胞计数升高,释放大量一氧化氮和精氨酸酶等,导致T细胞活化紊乱[19]。血小板和中性粒细胞通过分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)促进肿瘤细胞在远处器官的黏附和种植[6,20]。淋巴细胞参与肿瘤细胞的破坏和凋亡。3种外周血细胞的SII有可能影响食管癌患者的预后[21]。
关于治疗前SII的影响因素,有研究显示食管癌患者术前高SII与肿瘤大小、T分期、N分期和TNM分期相关[22]。ZHANG等[16]的研究结果显示,术前高SII与肿瘤大小、组织学类型、肿瘤浸润深度和TNM分期显著相关。与既往研究类似,本研究发现SII与TNM分期相关,还与血清前白蛋白和白蛋白水平呈负相关。关于SII的影响因素,各项研究报道的结果不尽相同,但也存在共性,即治疗前SII与TNM分期相关。分析其原因,可能是系统性炎症可以促进肿瘤进展和转移。分期较晚的患者的系统性炎症较为明显,因此SII偏高。
本研究收集了放疗期间每周的实验室检查结果,观察了放疗期间SII的变化趋势,结果显示无论是所有106例患者还是高SII组和低SII组患者,SII在放疗期间均呈上升趋势。MACLENNAN等[23]在英国医学研究委员会协议下对急性淋巴细胞白血病儿童进行预防性颅脑放疗(仅照射头颅,未照射骨髓和胸腺组织),结果显示随着放疗次数的增加,血淋巴细胞计数逐渐下降。LIU等[24]对207例接受放(化疗)的鼻咽癌患者进行了观察,发现放(化疗)期间血中性粒细胞与淋巴细胞计数比值和血小板与淋巴细胞计数比值均显著升高。这些研究与本研究的观察指标虽然不同,但反映了一致的外周血细胞变化趋势。
本研究的不足之处在于仅观察了放疗期间SII的变化趋势,并未分析SII变化的影响因素及其对预后的影响。放疗期间SII可能受到多种因素的影响,是一个非常复杂的过程。放疗除了可以直接破坏肿瘤细胞以外,还能够激活免疫应答,引发肿瘤相关炎症反应,影响肿瘤微环境中炎症细胞水平的变化,导致中性粒细胞和淋巴细胞数量及其表型的变化[25-26]。此外,放化疗可能导致骨髓造血功能受抑制,出现中性粒细胞和血小板计数下降,而临床上应用促进造血细胞增殖和分化的药物(如重组人粒细胞刺激因子和重组人白细胞介素11等)可使中性粒细胞和血小板计数升高。这些外周血细胞还可能受到感染、创伤和应激状态等因素的影响。目前尚不清楚上述变化对食管癌患者预后的影响及其临床意义,值得进一步研究。
本研究还发现,高SII与急性放射性食管炎和肺炎的发生相关,考虑可能是SII上升反映了中性粒细胞和血小板计数的升高以及多种细胞因子水平的增加,从而抑制细胞免疫,导致淋巴细胞数量减少,进而抑制机体的放射性损伤修复[27],临床上表现为较为明显的放射性食管炎和肺炎。
综上所述,SII在放疗期间呈上升趋势。高SII是食管癌放疗患者的预后影响因素,并且与放射性食管炎和放射性肺炎的发生相关。鉴于本研究的样本量较小且为回顾性研究,今后尚需开展多中心大样本的前瞻性随机对照研究以进一步验证。