颐脑解郁方对卒中后焦虑大鼠炎性因子及p38-MAPK信号蛋白表达的影响
寇 娜,郝 钰,赵瑞珍,赵子珺,王 丹,唐启盛
卒中后焦虑(post stroke anxiety,PSA)是发生于脑卒中后以焦虑为主要表现的情绪障碍,发病率呈逐年增长趋势,对病人的生存质量及死亡风险影响较大,故有效控制和治疗至关重要[1]。本团队前期研究证实p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinase,p38-MAPK)在脑卒中后病理变化和转归的过程中占有重要地位,且对脑神经炎症应答有一定的影响[2]。临床研究发现,运用颐脑解郁方治疗脑卒中后精神疾病疗效显著[3]。因此,本研究旨在探讨炎性因子及p38-MAPK信号蛋白表达与卒中后焦虑的关系及颐脑解郁方的干预作用。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级雄性Wistar大鼠90只,6周龄,体质量200~220 g,由北京维通利华实验动物技术有限公司提供[动物许可证:SCXK(京)2016-0006]。大鼠分笼喂养,适应实验环境1周,室温22~25 ℃,相对湿度55%~65%,自由进食、饮水,普通饲料由北京科澳协力饲料有限公司提供。
1.2 动物模型建立及分组 大鼠卒中后焦虑模型参考Longa等[4]报道的线栓造模方法,手术过程中室内温度保持在27~30 ℃,并采用数字量表评价大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)神经功能,选择术后24 h评分为7~12分中度损伤大鼠,采用不确定性空瓶饮水应激制备卒中后焦虑大鼠模型。实验将30只卒中后焦虑大鼠随机分为模型组、治疗组,每组15只。另选取15只MCAO大鼠不予应激干预作为卒中组,15只正常大鼠作为正常组。其中治疗组大鼠灌胃中药颐脑解郁方,正常组、卒中组、模型组大鼠常规饲养,灌胃生理盐水,每日剂量10 mL/kg,连续4周。动物保健及使用经过北京中医药大学伦理委员会实验协议批准。
1.3 主要试剂及药品 肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1α(interleukin-1α,IL-1α)、白细胞介素-6(interleukin-6,IL-6)放免试剂盒由北京华英公司提供;p38-MAPK抗体(单克隆抗体,兔抗鼠)购于上海Abcam公司;BCA蛋白含量检测试剂盒、50x蛋白酶抑制剂混合物购于北京凯基生物公司;5x SDS-PAGE蛋白上样缓冲液、PAGE胶促凝剂、过硫酸铵及封闭专用脱脂奶粉购买于北京普利莱公司;细胞裂解液、5x Tris-甘氨酸电泳缓冲液、10x电转液、10x封闭-洗涤缓冲液、分离胶缓冲液、浓缩胶缓冲液及30%双丙烯酰胺溶液购买于北京Solarbio公司;蛋白免疫印迹(Western Blot)一抗稀释液购于上海Beyotime公司;聚偏二氟乙烯(PVDF)膜购于Millipore公司;蛋白质分子量Marker购于Thermo公司;辣根过氧化物酶标记山羊抗兔IgG及内参抗体购于北京博奥森公司;化学发光剂购于美国GE Healthcare公司;戊巴比妥购于国药集团化学试剂北京有限公司;二甲苯购于天津市进丰化工有限公司;无水乙醇购于北京化工厂等。颐脑解郁方配方颗粒剂(刺五加20 g、栀子10 g、五味子10 g、郁金10 g)由北京康仁堂药业有限公司提供。灌胃剂量按照成人用量(每天20 mg/60 kg)的7倍计算大鼠用量浓煎,储存于4 ℃冰箱中备用。灌胃前加热,大鼠每日剂量为10 mL/kg,早晚各灌胃1次。
1.4 主要仪器 超纯水仪(型号D7411)购于美国Barnstead公司;超声破碎仪(型号YD-6L)购于金华市益迪医疗设备有限公司;转移脱色摇床(型号TS-8型)购于海门市其林贝尔公司;电子天平(型号MP5002)购于上海舜宇恒平科学仪器有限公司;微型电动匀浆器(型号AG285)购于美国Sigma公司;电泳仪(型号DYY-8C)购于北京市六一仪器厂;垂直电泳槽、稳压稳流电泳仪、半干转电转印仪购于美国Bio-Rad公司等。
1.5 旷场实验 大鼠于末次灌胃后行旷场实验,选取大小为100 cm×100 cm×40 cm的敞箱,四壁涂黑,底面平均划分为25块方格,实验时将大鼠朝同一方向放入底部中心方格,安静状态下记录大鼠中央区穿越方格数。水平次数以大鼠四肢均进入方格为准;直立次数以大鼠两前肢离地1次为准。每只大鼠测定1次,每次3 min。每只大鼠实验结束后清理粪便,用乙醇擦拭箱底,待酒精挥发后,进行下一只测试。
1.6 高架十字迷宫实验 大鼠于旷场实验后行高架十字迷宫实验,两条开放臂(50 cm×10 cm)、两条闭合臂(50 cm×10 cm)以及连接开放臂和闭合臂的呈十字形的中央区(10 cm×10 cm)组成高架十字迷宫。实验时将大鼠放到中央区,使其头部正对其中一侧开放臂,释放后分别记录大鼠3 min进入开放臂的次数、时间。每只大鼠实验结束后清理粪便,用乙醇擦拭箱底,待乙醇挥发后,进行下一只测试。
1.7 TNF-α、IL-1α和IL-6的含量检测 在末次灌胃行为学检测后,每组随机选取12只大鼠麻醉并腹主动脉取血,4 ℃离心10 min取血清,并用全自动放免计数仪按试剂盒说明的放射免疫法测定血清TNF-α、IL-1α和IL-6的含量。
1.8 p38-MAPK蛋白检测 在末次灌胃行为学检测后,每组随机选取6只大鼠麻醉并断头取脑皮质和海马体组织并迅速投入液氮中冷冻,然后转移到-70 ℃冰箱保存。采用Western Blot法检测p38-MAPK蛋白表达,其方法为将组织取出,放入预冷的研钵中加入液氮进行快速研磨成粉末,制备蛋白样品并等量加载到SDS-PAGE凝胶上制胶、电泳、转膜于PVDF膜、脱脂奶粉封闭,加入一抗(p38-MAPK浓度为1∶2 000;actin浓度为1∶2 000),封口,4 ℃封闭培养过夜,二抗孵育(浓度为1∶2 000)1 h后曝光扫描,利用Image Pro Plus(Roper Industries,纽约,美国)测定波段的光学密度,结果以相对密度比表示。
1.9 统计学处理 采用IBM SPSS 20.0统计软件及Graphpad Prism进行数据处理。定量资料以均数±标准差(x±s)表示,检测数据均符合正态性分布,各组间方差齐,采用单因素方差分析(One-Way ANOVA),两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠行为学测试 与正常组比较,卒中组水平及垂直运动次数减少(P<0.01),开放臂次数减少,开放臂时间增加,但差异均无统计学意义(P>0.05),模型组、治疗组的水平及垂直运动次数、开放臂次数及时间均明显减少(P<0.05或P<0.01);与卒中组比较,模型组水平及垂直运动次数、开放臂次数及时间均降低(P<0.01);与模型组比较,治疗组水平及垂直运动次数、开放臂次数及时间均明显升高(P<0.05或P<0.01)。详见表1。
2.2 炎性因子应答 与正常组比较,卒中组、模型组、治疗组大鼠血清TNF-α、IL-1α、IL-6含量均升高(P<0.01);与卒中组比较,模型组大鼠血清TNF-α、IL-1α、IL-6含量升高(P<0.05或P<0.01),与模型组比较,治疗组大鼠血清TNF-α、IL-1α、IL-6含量降低(P<0.01)。详见表2。
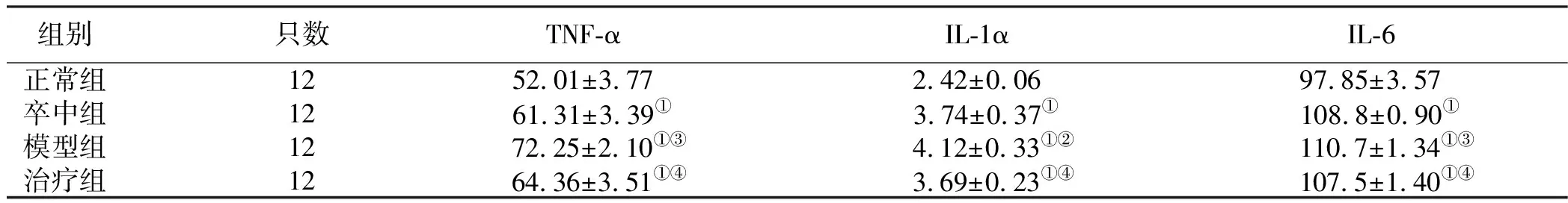
表2 颐脑解郁方对血清TNF-α、IL-1α、IL-6含量的影响(x±s) 单位:pg/mL
2.3 p38-MAPK蛋白的表达 与正常组比较,模型组大鼠海马及皮质p38-MAPK表达显著升高(P<0.01);与卒中组比较,模型组大鼠海马p38-MAPK表达明显升高(P<0.05),皮质p38-MAPK表达比较差异无统计学意义(P>0.05);与模型组比较,治疗组大鼠海马及皮质p38-MAPK表达下降(P<0.01)。详见表3、图1。
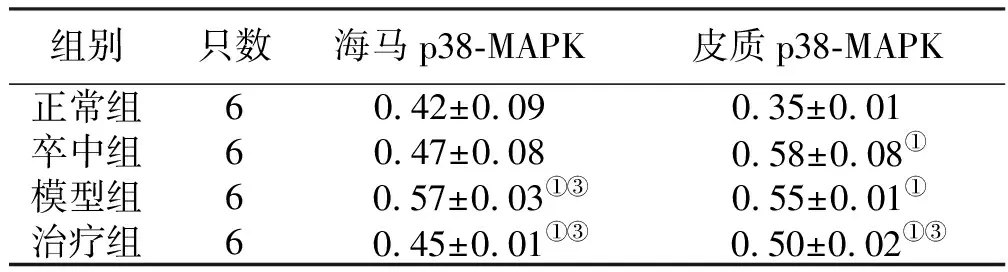
表3 颐脑解郁方对P38-MAPK蛋白表达的影响 (x±s)
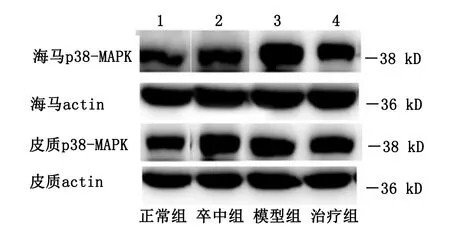
图1 颐脑解郁方对p38-MAPK蛋白表达的影响
3 讨 论
卒中后焦虑与原发性焦虑障碍相似,属中医学“郁证”“不寐”“脏躁”“百合病”等范畴[5]。唐启盛教授认为,卒中后焦虑属本虚标实,肾精亏虚为本,气机壅滞为标。肾虚精水空虚,水不涵木,肝阳上亢而致气血上逆,气血瘀滞而致神窍闭阻,发为中风;中风病后,肾精亏虚,肝失所养,肝疏泄功能不调,气机不畅,致肝气郁结,肝气郁久化热,神受其扰,则出现坐立不安、烦躁担心及汗出、心悸、手抖等一系列自主神经症状的焦虑样表现[3]。其治疗当以益肾调气、解郁安神为治疗原则[6]。颐脑解郁方由刺五加、五味子、郁金、栀子组成,方中刺五加益气健脾、补肾安神,郁金疏肝解郁、行气活血、清心安神,五味子益气生津、补肾宁心,栀子泻火除烦,四味药物共奏益肾调气、解郁安神之功效。本课题组前期研究已证实,唐启盛教授临床使用颐脑解郁方治疗该病证有效率高达86.67%[7]。
本实验采用不确定性空瓶饮水刺激复合脑缺血建立大鼠卒中后焦虑模型。在动物行为学方法中,高架十字迷宫能够检测动物焦虑模型是否建立成功。旷场实验是利用大鼠惧怕空旷环境但又喜欢探索的心理冲突,其中大鼠进入中央区次数反映了对新环境的探究行为及适应度[8-10]。本研究数据显示,模型组大鼠倾向选择黑暗安全环境,开放臂停留时间以及次数明显缩短,进入旷场中央区水平及垂直活动次数减少,表明不确定性空瓶饮水刺激复合脑缺血建立大鼠卒中后焦虑模型成功。与模型组比较,治疗组大鼠开放臂停留时间及次数、进入旷场中央区水平及垂直活动次数增加,表明颐脑解郁方能够减轻卒中后焦虑大鼠的焦虑程度。
近年来,大量研究表明炎性因子应答参与脑卒中及精神障碍的发病过程[11-12]。脑卒中后大量炎症细胞浸润和激活,引起强烈的免疫应答,同时激活小神经细胞、白细胞、巨噬细胞等产生炎性细胞因子,如TNF-α、IL-1α、IL-6等参与脑卒中的发病[13-14]。另有研究表明,TNF-α、IL-1α、IL-6等炎性因子由破坏的血-脑屏障进入中枢系统,促进下丘脑-垂体-肾上腺(HPA)轴的活化,并引起神经细胞丢失,促进焦虑的发生[13]。p38-MAPK活化参与多种炎性因子反应,而在下丘脑应激信号传导系统中,通过外界应激,如促炎因子或细胞应激引起p38-MAPK磷酸化,增加神经元细胞损伤[2]。另外,研究证实在焦虑症状行为时,大鼠海马p38-MAPK表达明显升高,而抗焦虑药物可降低p38-MAPK及其通路相关蛋白的表达,改善焦虑症状[15]。本实验结果表明,与正常组比较,模型组大鼠血清TNF-α、IL-1α、IL-6浓度,海马及皮质p38-MAPK蛋白表达升高,与先前的研究结果[16]一致。而治疗组大鼠TNF-α、IL-1α、IL-6浓度,海马及皮质p38-MAPK蛋白表达均较模型组降低,表明颐脑解郁方可能通过降低脑卒中引起的p38-MAPK磷酸化水平,减轻炎性因子的应答,改善脑卒中后引起的焦虑障碍。
综上所述,通过不确定性空瓶饮水刺激复合脑缺血成功建立卒中后抑郁大鼠模型,颐脑解郁方可改善脑卒中后引起的焦虑障碍,其机制可能与抑制下丘脑和皮质p38-MAPK磷酸化水平,减轻炎性因子应答相关,初步验证p38-MAPK可能是颐脑解郁方发挥作用的一个靶点。

