大鼠海马神经干细胞的原代培养方法
丁海月,薛 冰,刁华琼,魏 丹,李小黎
神经干细胞(neural stem cells,NSCs)是指分布于神经系统的具有自我更新和多分化潜能的干细胞。其主要功能是作为一种储备,参与神经系统损伤修复或细胞正常死亡的更新。因此,NSCs在中枢神经系统损伤和退行性疾病中可能发挥重要的治疗作用[1-2],如帕金森病、阿尔茨海默病、缺血性脑卒中等疾病[3]。脑内海马区分布的NSCs较多,尤其海马齿状回是哺乳动物脑内存在NSCs的主要区域之一。NSCs的增殖与分化有益于神经系统的生长发育,对学习和记忆有着重要的作用[4-5]。然而NSCs的原代培养难度大,细胞活力低,纯度不高。因此,本实验取新生大鼠海马组织,总结一种体外培养海马NSCs的简便方法,为进一步研究神经系统疾病中NSCs的增殖分化提供实验基础。
1 材料与方法
1.1 实验动物 新生24 h的SD大鼠,普通无特定病原体(SPF)级,由斯贝福(北京)生物技术有限公司提供,许可证号:SCXK(京)2019-0010。
1.2 主要试剂与仪器 DMEM/F12培养基、B27、青链霉素(美国Gibco公司);表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF,美国Proteintech公司);D-Hanks液(美国HyClone公司);5-嗅-2-脱氧尿苷(5-Bromo-2-deoxy-uridine,BrdU)、二甲基亚砜(DMSO)、多聚赖氨酸(美国Sigma公司);兔抗巢蛋白(Nestin)抗体、小鼠抗BrdU抗体、异硫氰酸荧光素(FITC)标记的羊抗兔IgG、Cy3标记羊抗小鼠IgG(美国Peprotech公司);二氧化碳培养箱(德国Memmert公司);激光共聚焦显微镜(日本OLYMPUS公司)。
1.3 海马NSCs的培养与鉴定
1.3.1 溶液配制及器材准备 培养基:DMEM/F12培养液、20 ng/mL EGF、20 ng/mL bFGF、2% B27、1%双抗(青霉素、链霉素)。取材用的手术器械、玻璃烧杯及玻璃培养皿、滤纸等要提前高压蒸汽灭菌,然后放置于60 ℃烘箱中干燥4~6 h。
1.3.2 预处理 鉴定所用的细胞爬片需要提前用多聚赖氨酸处理,具体步骤为:将细胞爬片浸在多聚赖氨酸溶液中,常温放置5 min,然后吸去多余多聚赖氨酸,超净台中晾干,然后用磷酸缓冲盐溶液(PBS)冲洗3次,晾干备用。
1.3.3 取材及培养 新生24 h的SD大鼠,用75%的乙醇浸泡消毒10 min后剪下大鼠头部,移入放有无菌滤纸的培养皿中(滤纸用于吸去多余血水)。弯镊夹住大鼠眼眶以固定头部,用眼科剪从断头切口的中线将头皮和颅骨剪至嗅球部,用另一把镊子将头皮及颅骨向两侧掀开,暴露出大小脑及延髓,用镊子夹断正前方嗅球与全脑的连接,并从侧面轻轻将全脑与脑底分离,小心将全脑取出放入一个盛有D-Hanks液的培养皿中。因左右大脑相连,用游丝镊在大脑皮层背侧表面正中矢状位夹断,使左右脑分开,并向外侧小心掀开大脑皮质表面,即可见“C”形海马卧在皮层内,用游丝镊夹断海马前后及边缘组织,即可分离出整个海马,然后将周围的脑膜剥离干净(以见不到含有血管的脑膜为佳),将剥离出的海马单独放置在盛有DMEM/F12培养液的培养皿中。将海马组织剪成1 mm3大小的组织块,吹打40~60次,制成细胞悬液,过40 μm细胞筛,收集入离心管中,1 000 r/min室温离心5~10 min,加培养基重悬细胞,再反复吹打20次,取少量细胞悬液加在计数板上,在显微镜下计数细胞密度,以1.5×105~2.5×105个/mL接种于培养皿或25 mL的培养瓶中,置37 ℃、5%CO2培养箱培养,每隔3 d半量换液,5~7 d可传代1次,每天在荧光倒置显微镜下观察细胞生长情况。
1.3.4 鉴定 取传代后第3天的海马NSCs,在培养皿中加入BrdU,终浓度为10 μmol/L,继续培养48 h。然后再接种到放有预先处理过多聚赖氨酸的细胞爬片的6孔板中,孵育24 h使细胞贴壁。在培养板中将已经爬好细胞的玻片用PBS洗3次,每次5 min;用4%多聚甲醛常温固定30 min,PBS洗3次,每次5 min;用含0.3%的TritonX-100的PBS溶液室温破膜30 min,PBS洗3次,每次5 min;含10%山羊血清的PBS液室温下封闭1 h,除去山羊血清,不洗;分别滴加用PBS稀释后的兔抗Nestin单克隆抗体(1∶100)、小鼠抗BrdU抗体(1∶200)4 ℃过夜,清洗3次后,分别加入含FITC标记的羊抗兔、Cy3标记羊抗小鼠IgG(1∶100)的PBS溶液,室温避光1 h,清洗3次后在激光共聚焦显微镜下观察并摄片。
2 结 果
2.1 NSCs的生长情况 第1天可见细胞悬浮生长,形态不一,体积微小,有少量大小不等的片状物及杂质,因细胞是悬浮生长,所以培养基的每个层面都存在细胞,镜下会很密集(图1A)。第3天可见片状物减少,杂质越来越少,大量的单个细胞悬浮生长,细胞呈球形(图1B)。第5天可见细胞数量增多,体积变大,多个神经球易聚集形成细胞团似桑葚样,细胞团体积大小各不相同,周围有新增殖的体积相对较小的神经球,无明显的片状物,杂质细胞越来越少(图1C)。当神经球中心开始变黄变暗时需要传代,若继续培养细胞球很可能贴壁分化,每5~7 d可传代1次。
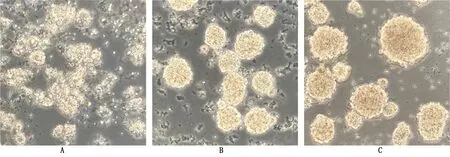
图1 海马NSCs生长情况(×200)
2.2 NSCs的鉴定 将第2代培养的NSCs悬液行Nestin、BrdU的免疫荧光细胞化学染色鉴定。鉴定结果表明,培养的NSCs呈Nestin阳性(图2A);部分细胞检测为BrdU阳性(图2B);说明本实验方法培养出的细胞为NSCs且具有增殖能力。详见图2。
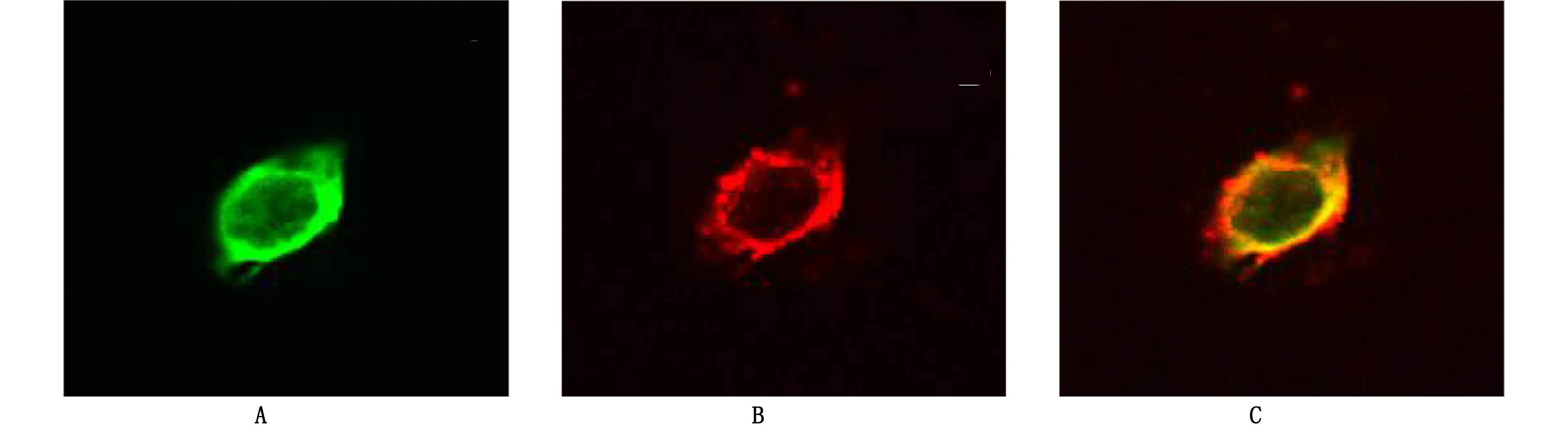
图2 海马NSCs鉴定(×600)
3 讨 论
NSCs是一类能够向特定类型神经元或神经胶质细胞分化的原始细胞的总称,对NSCs的研究已经成为神经科学中重要的领域。有研究发现,NSCs移植治疗神经退行性疾病在动物模型中显示出有益的作用[6]。王凌飞[7]认为NSCs移植治疗具有保护血脑屏障、抑制炎症反应、促进神经发生等作用,是治疗缺血性脑卒中的有效方法。NSCs用于神经功能障碍等疾病的治疗具有广阔的开发前景,一直以来都是研究的重点方向。
本实验中海马组织的正确取出对细胞的培养极为重要,因为鼠脑的海马组织过小,肉眼难以分辨,且脑组织柔软,易融为一体,所以原代培养取材难度大,且纯度不够高,杂质细胞多,成活率低。研究表明用新生鼠培养NSCs取材相对简单,且不易造成污染,选用孕鼠海马的取材难度大[8]。这是因为新生鼠与孕鼠相比脑组织更大,易分辨,操作更容易,不易损伤,获得的海马组织更多更完整,从而使得培养的细胞无其他混杂细胞的生长,纯度高,因此,本实验选用新生鼠作为细胞培养的来源。其次,脑组织易融化,取材过程在冰盒上进行,所用到的试剂要提前预冷,低温能保持海马形态,同时提高细胞活力。取出的全脑要放在盛有无酚红的D-Hanks液中,无色透明的D-Hanks液可以使全脑的形态完整呈现出来,即肉眼下就可操作而不用借助解剖显微镜,避免污染,相比苗宗宁等[9]在显微镜下操作更简便。按照本实验方法取材,可以清楚地看到海马的位置,能较完整地剥离出海马,缩短取材时间,快速培养,可以用于培养海马NSCs,选用不同的培养基也可用来培养海马神经元。
在细胞培养过程中,NSCs不断增殖,周围杂质逐渐减少,纯度不断增加,其关键在于海马组织的完整性。培养的第一代NSCs经台盼蓝染色计数细胞存活率高达96%,与实验过程中的操作有关,动作越轻柔,细胞损伤越小,取材速度越快,细胞活性越高。Nestin是目前作为识别NSCs的重要标志蛋白,Nestin阳性细胞具有干细胞的特征。BrdU可以替代胸腺嘧啶在细胞增殖时期渗入DNA,是反映增殖能力的重要指标。本实验对第二代细胞进行鉴定,结果显示几乎所有的细胞都呈Nestin阳性,表明培养的细胞为NSCs,且纯度较高,大部分细胞呈BrdU阳性,显示NSCs具有较强的增殖力。
中医药治疗神经系统疾病具有一定的优势,在动物实验中发现中药可以诱导体内海马NSCs增殖分化,从而保护脑损伤[10]。有研究者在离体实验中通过培养NSCs来探讨中药对疾病的治疗作用。陈琳等[11]发现三七总皂苷对缺糖缺氧-再灌注损伤新生大鼠海马NSCs具有保护作用;Han等[12]建立糖尿病脑病的细胞模型,发现降糖胶囊对海马NSCs存活、自我更新和分化产生积极作用;为了探讨补益脾胃元气类方药治疗阿尔茨海默病的作用,岳涛等[13]研究方药对海马NSCs增殖分化的影响。因此,培养获得稳定的NSCs是关键,为下一步探讨中药对海马NSCs增殖分化的作用提供支持。
综上所述,本实验以新生大鼠培养海马NSCs,对海马的损伤小,细胞活力高,并且操作简便,降低了原代取材的难度。细胞的成功培养为下一步的实验研究奠定了基础。

