甘露醇对脂多糖致小鼠脑水肿治疗的多参数评估*
宁雪,刘洋洋,李韪韬
(南京航空航天大学生物医学工程系,南京 211106)
1 引 言
脑水肿[1]是神经科常见问题,也是导致颅内压[2]增高的最常见原因,颅内压升高可能对脑造成严重影响[3]。脑血氧[4]与脑水肿相关联,血氧降低二氧化碳含量升高,脑水肿会加剧,脑水肿的治疗研究具有极其重要的医学实用性[5]。郭莉丽等[6]研究甲强龙与地塞米松对脑水肿治疗效果,陈敬星等[7]采用依达拉奉治疗脑水肿,孟小鹏等[8]将尼莫地平合甘露醇对脑水肿患者进行治疗,复发率较低。程济玲[9]对急性颅内高压患者实施甘露醇等药物,发现可改善脑氧代谢和血流灌注。研究发现甘露醇可用于临床脑水肿的治疗,但由于监测参数较少,甘露醇治疗脑水肿的相关机理[10]尚不明确,如甘露醇的施用时间、剂量[11]等仍在探索中。
为研究甘露醇对脂多糖致小鼠脑水肿治疗效果,通过脑含水量测定小鼠脑水肿过程[12],探究对白细胞介素IL-1β[13]、肿瘤坏死因子TNF-α[14]、水通道蛋白AQP4[15]三种炎症因子及光学内源[16]信号的变化规律,结合脑组织病理检查结果,分析甘露醇的疗效,比较不同时间甘露醇对小鼠脑水肿的治疗效果,为甘露醇治疗脑水肿机理研究提供参考价值,为小鼠脑水肿治疗方案制定奠定基础。
2 材料与方法
2.1 实验准备
2.1.1实验动物分组 实验采用ICR雌性小鼠(青龙山动物实验中心,南京),在小鼠出生约8周后,将小鼠饲养与恒温(25±1)℃和恒湿(55±10)%的饲养笼中,昼夜间隔12 h,连续饲养7 d,在此过程中保证水和食物供应充足。所有的动物实验程序都是按照南京航空航天大学动物保护与伦理委员会批准的程序进行的。
将30只实验小鼠随机分为3组,分别为脂多糖组(LPS组,n=5),生理盐水组(NS组 ,n=5)、甘露醇治疗组(MT组,n=20)。其中MT组分为四个亚组,2、4、12、24 h组均5只,注射甘露醇2、4、12、24 h后分别断头取脑,实验步骤见图1。
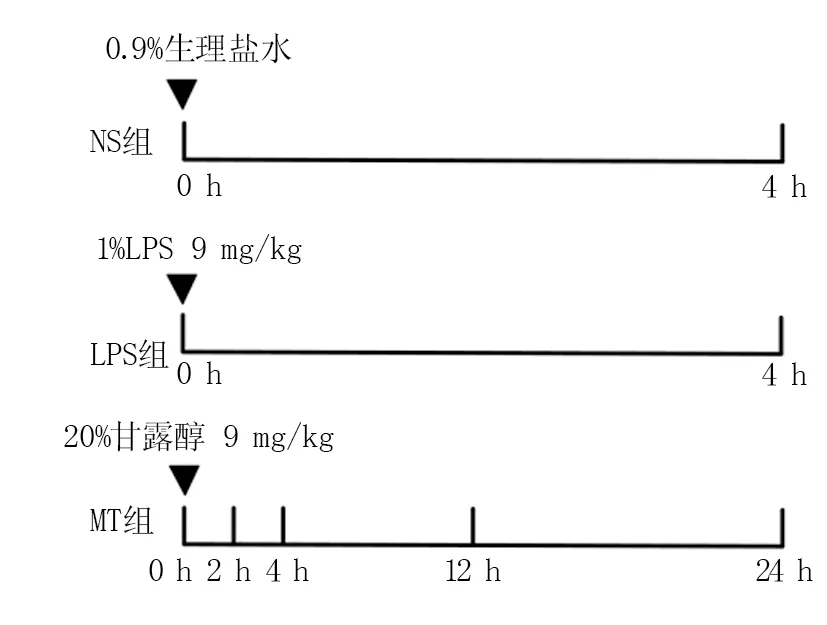
图1 实验步骤示意图Fig.1 Schematic diagram of experimental steps
2.1.2动物模型建立 实验前,用5%水合氯醛(400 mg/kg,腹腔注射)麻醉小鼠,并将其置于立体定向定位仪上,温棉球热敷鼠尾,使尾静脉扩张,对鼠尾消毒后,LPS组用 1 mL 注射器根据小鼠体重吸取相应剂量(体重×5 g/kg)脂多糖(1 g/100 mL),注入脂多糖试剂,再次消毒鼠尾,完成小鼠脑水肿模型[17]建立,NS组用同样的操作方法进行注射生理盐水溶液。4 h后LPS组、NS组小鼠断头取脑。小鼠脑水肿模型建立4 h后,MT组均注射甘露醇试剂(1 g/5 mL),在注射后的2、4、12、24 h后用上述方法依次断头取脑。
2.2 多参数测定
2.2.1脑组织含水量测定 脑组织含水量用干湿法测定,观察到相应时间断头取脑后,用电子分析天平秤称取湿重,放置100℃的烘干机24 h。计算如下:脑组织含水量(%)=(湿重-干重)×100 %/湿重。
2.2.2IL-1β、AQP4、TNF-α测定 采用酶联免疫吸附法测定IL-1β及TNF-α含量,链霉亲和素-生物素复合物免疫组织化学方法检测AQP4,试剂盒均购买于南京森贝伽科技有限公司,均由专业人员按照要求进行操作。
2.2.3光学内源信号检测 光学内源信号成像系统[18]利用卤素灯通过柔软的双导光光纤将白光照射在小鼠的脑部皮层成像区域,通过放置在镜筒与CCD相机之间有6个不同波长滤光片轮进行光传输。依次采集到450、470、500、550、570、600 nm的5幅图像。各个吸收色团其吸收特性有差异,不同波长下的反射光强存在差异,根据修正的朗伯比尔定律[9],在内源光信号成像中,根据采集的原始图像中得到氧合血红蛋白(HbO2)、脱氧血红蛋白(Hb)、光散射(scattering)、细胞色素c(cytc-R)、细胞色素氧化酶(cytcaa-R)、还原性辅酶的氧化态(FAD)6个参数的变化情况。
2.2.4病理学检查 采用免疫组化染色方法进行检测。
2.3 统计分析
采用SPSS 22.0软件进行统计分析,数据均采用x±s表示。对数据进行方差分析和t检验,(P<0.05)为差异有统计学意义。对光学内源信号参数分别与三种细胞因子之间进行相关性分析。
3 结果
3.1 小鼠脑含水量检测结果
小鼠大脑水含量的变化及变化趋势见表1。LPS组的小鼠脑组织含水量较NS组、MT组含量明显增高,具有显著差异性(P<0.05);2、4、12、24 h治疗组的脑组织含水量低于NS组,其中2、4 h的脑组织含水量相较于LPS组有所降低,但12、24 h比2、4 h降低较为明显(P<0.05)。
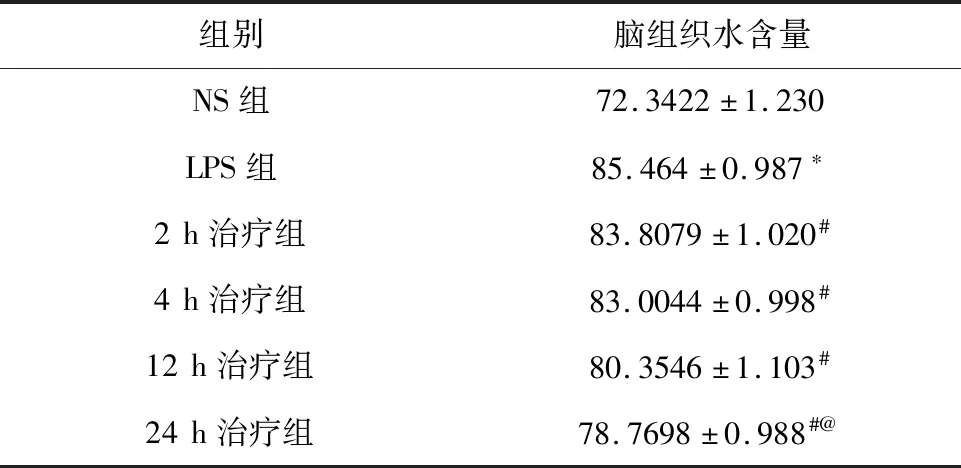
表1 不同实验组小鼠脑含水量变化Table 1 Changes of brain water content in different experimental groups
3.2 三种细胞因子测定结果
3.2.1AQP4因子测定结果 LPS组AQP4因子含量较NS组明显升高,MT组四个亚组的AQP4相较于LPS组都明显降低,MT组的2、4 h两个亚组间无明显差异(P>0.05),但分别与12、24 h亚组具有显著差异(P<0.05),治疗组的AQP4含量仍高于NS组。
3.2.2TNF-α因子测定结果 LPS组TNF-α因子的含量较NS组明显升高(P<0.05),NS组与LPS组之间差异明显(P<0.05)。MT组的四个亚组较LPS组明显降低具有显著差异(P<0.05),2、4 h两个亚组之间无明显差异(P>0.05),2、4 h两个亚组分别与12、24 h亚组的AQP4具有显著差异(P<0.05),12、24 h治疗亚组之间有显著差异(P<0.05),治疗组TNF-α因子含量仍高于NS组。
3.2.3IL-1β因子测定结果 LPS组的IL-1β因子的含量明显高于NS组(P<0.05),两者之间有明显差异性(P<0.05)。MT组的四个亚组相较于NS组均有明显差异性(P<0.05),2、4 h两个治疗亚组之间因子含量无明显差异(P>0.05),2、4 h两个亚组分别与12、24 h亚组的AQP4具有显著差异(P<0.05),12、24 h治疗亚组之间有显著差异(P<0.05),治疗组的IL-1β因子的含量仍高于NS组。三种细胞因子的变化情况及变化趋势见图2。
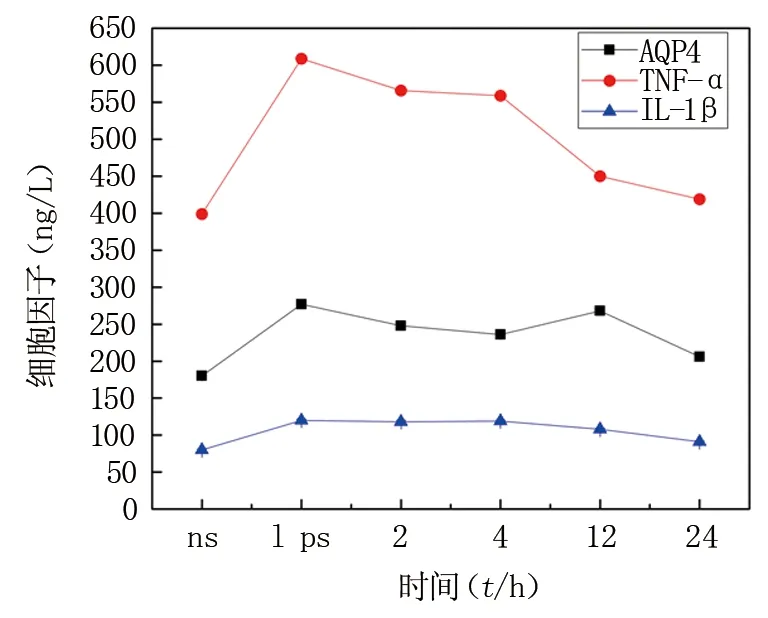
图2 三种细胞因子变化曲线Fig.2 Change curve of three cytokines
3.3 光学内源信号检测结果
光学内源信号实验结果见图3,注射甘露醇后2、4、12、24 h,HbO2参数变化呈逐渐上升趋势,Hb呈相反趋势,scattering、cytc-R、cytaa-R、FAD参数在治疗2 h变化明显,4、12、24 h无明显变化,不具备分析价值。
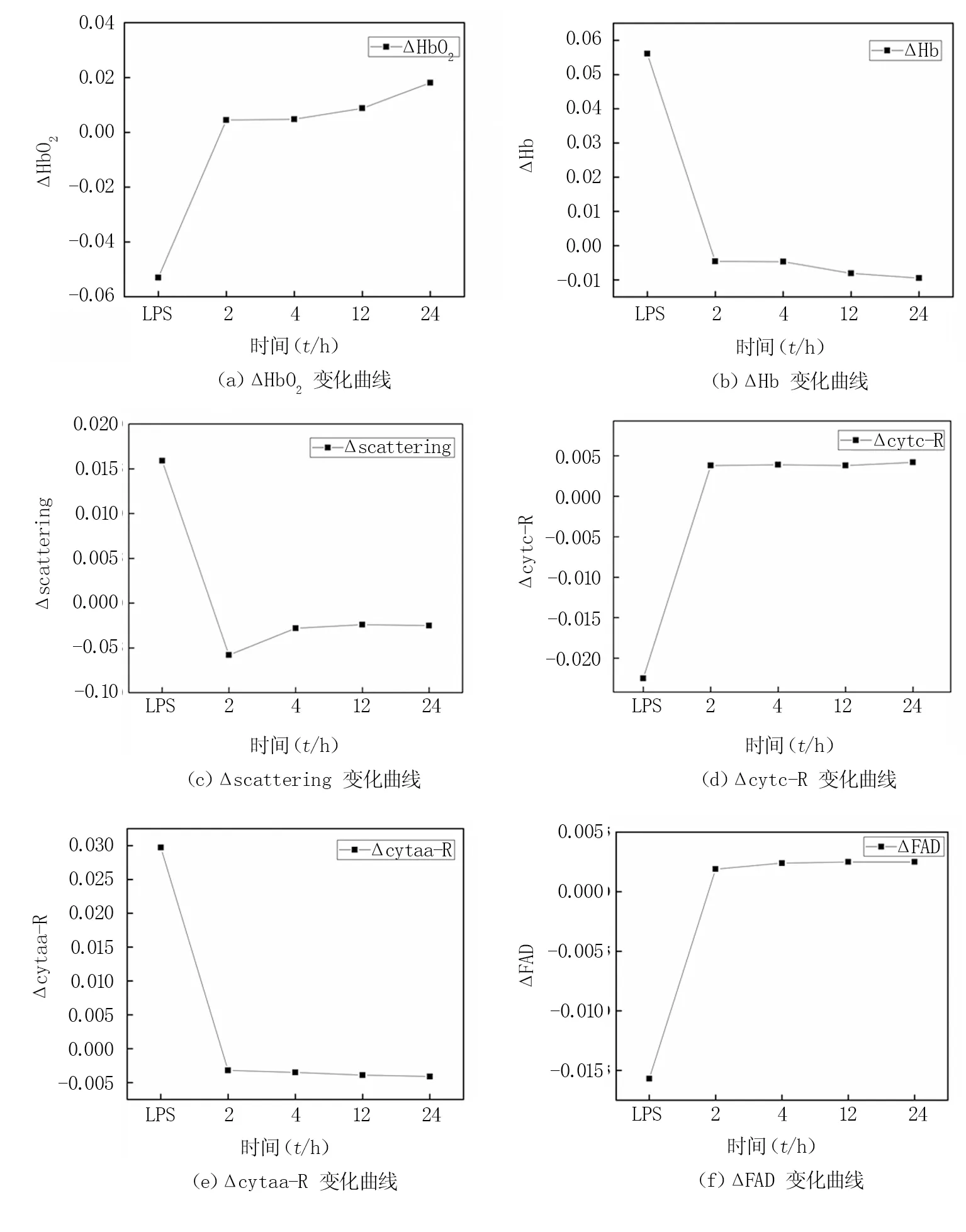
图3 光学内源信号参数变化曲线Fig.3 Change curve of optical intrinsic signal parameters
3.4 IL-1β、AQP4、TNF-α因子与HbO2、Hb相关性分析结果
相关性分析结果见表2,AQP4与血氧参数HbO2变化量之间高度负相关、与Hb变化量之间高度正相关。
IL-1β与HbO2显著相关,与Hb低相关性;TNF-α与HbO2低相关,与Hb显著相关。

表2 三种细胞因子与△HbO2、△Hb相关性Table 2 Correlation of three cytokines with △HbO2 and △Hb
3.5 病理检查结果
病理检查结果见图4。图4(a)、(b)、(c)、(d)分别为NS组、LPS组、2 h组和4 h组。由图可知,LPS组注入脂多糖后炎症因子的含量相较于NS组细胞因子含量显著增加,图4(c)、(d)中治疗组细胞因子含量比图4(b)明显降低,但仍高于图4(a)。
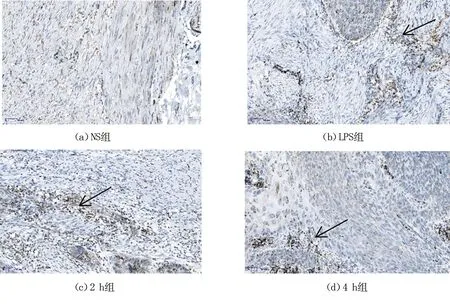
图4 不同实验组免疫切片图(×400倍)Fig. 4 Immunosection of different experimental groups (× 400)
4 讨论
甘露醇是治疗脑水肿及其所产生的颅内高压的有效解决方案[19],具备高渗透性[20]。其作用是增加血浆的渗透压,使脑和脑脊液等组织内的水分进入血管,减轻脑部组织的水肿情况。比较实验结果发现,LPS注入4 h后,不同时间MT亚组中,脑水组织含量较LPS组显著升高(P<0.05),仍高于NS组。细胞因子IL-1β、AQP4、TNF-α的含量较LPS组的显著降低(P<0.05),仍高于NS组。脑部病理切片结果也显示2、4 h的细胞因子的含量较LPS组均降低。
将三种细胞因子分别与HbO2、Hb做相关性分析,发现AQP4与HbO2之间有高度负相关性、与Hb之间有高度正相关。通过相关性分析血氧参数HbO2、Hb可以作为脑水肿细胞因子TNF-α检测的有效指标,可以通过血氧[21]间接反映脑水肿发展及治疗情况。
随着甘露醇治疗的时间增加,治疗组的治疗效果24 h>12 h>2 h和4 h,其中2、4 h之间的治疗效果无显著差异(P<0.05),2 h和4 h两个亚组分别与12 h和24 h亚组具有显著差异(P<0.05),12 h和24 h治疗亚组之间有显著差异(P<0.05)。本研究表明,甘露醇治疗2、4、12、24 h后对于脂多糖致脑水肿具有明显治疗效果,其中24 h的治疗效果最明显。本研究认为甘露醇是一种有效的脑水肿治疗药物[22]。
5 结论
研究了不同时间甘露醇对脂多糖致小鼠脑水肿的治疗效果,首先注入脂多糖建立小鼠脑水肿模型,然后对模型注入甘露醇进行治疗,发现注入2、4、12、24 h后小鼠脑水肿有改善,其中24 h治疗效果最为明显,而且长时间(12、24 h)的治疗效果优于短时间(2、4 h)的治疗效果。检测脑组织内源光信号发现,细胞因子TNF-α与血氧参数HbO2之间存在高度负相关性、与Hb呈高度正相关,血氧可以间接反映脑水肿发展及治疗情况。本研究为小鼠脑水肿的治疗研究提供了参考价值。

