骨质疏松症动物模型的构建及实验方法研究进展*
周静媛,刘肖珩,沈阳,曾烨,陈宇△,蒋文涛
(1.四川大学生物力学工程省重点实验室,成都 610065;2.四川大学华西基础医学与法医学院,成都 610041)
1 引 言
由于临床试验成本高、时间长,动物模型在骨质疏松症治疗药物的鉴定和选择中起着至关重要的作用。针对不同类型的骨质疏松,诱导动物产生骨质疏松的方法并不相同,有效的药物对骨质疏松的治疗作用如何体现也需要考虑,因此,构建骨质疏松动物模型的方法及药物具有治疗作用的判断依据的发展与完善将越来越重要。我们介绍了现有的构建骨质疏松动物模型的方法、给药实验的实验方法及药物具有治疗作用的判断依据,并为研发治疗骨质疏松的新型药物的选择提供思路。
2 原发性骨质疏松症动物模型构建及给药实验的实验方法
原发性骨质疏松是随着年龄增长必然发生的一种生理退行性病变,可分为绝经后骨质疏松(I型)和老年骨质疏松(II型)。其中绝经后骨质疏松症是由于机体内雌激素水平下降,成骨细胞和破骨细胞共同维持的骨代谢的动态平衡遭到破坏,导致骨质流失增加,骨微结构破坏,造成骨脆性增加[1]。近年来的研究发现,雌激素具有明显的抗氧化作用,雌激素的缺乏可能会损害抗氧化系统并导致骨骼中氧化应激水平增加,导致骨吸收增加和骨形成减少,引发骨质疏松[2]。而老年骨质疏松是指随着年龄增加,人体单位体积骨量低于正常,骨小梁间隙增大,骨基质减少,骨强度降低所造成的骨质疏松。
2.1 绝经后骨质疏松
绝经期雌激素缺乏引起的骨转换加速是骨质疏松症最常见的原因,因此,在临床的治疗药物检查中,因雌激素缺乏而产生骨质疏松的动物模型是首选。
大鼠骨质疏松动物模型对研究原发性骨质疏松有积极意义,目前广泛使用的动物模型是Wistar大鼠,周龄大多为12周,要求健康特异性无病原体。广泛用于动物模型造成绝经后骨质疏松的方法是双侧卵巢切除法(去势法)[3-6]。
选取大鼠后,对大鼠进行手术并分为假手术组和去卵巢组,分组过程中,应保持每组的大鼠数量相同。假手术组有两种处理方式:一是麻醉之后只切除一小部分脂肪,而不是双侧卵巢[1];二是由于采用2%异氟烷麻醉大鼠,假手术组切口缝合而不切除卵巢[5]。去卵巢组又分为模型组和药物作用组。药物作用组可根据需要设置高剂量药物组、中剂量药物组、低剂量药物组等,以对药物作用的最佳用量进行大概估计。设置药物用量时,应注意基于人体的用量进行转换,可采用人与大鼠之间的剂量转换表来得到用量[3]。 治疗期过后,对大鼠进行安乐死,取血样进行生化分析,采集左/右股骨、子宫、阴道,将用于组织学分析的样品保持在10%中性甲醛中。
2.2 老年骨质疏松
依旧选用大鼠骨质疏松动物模型,可选择SD(Sprague Dawley)大鼠作为动物模型,不限制动物性别,大鼠此时的骨头已经发生生理性退化,可采取双能X射线吸收测定法测定骨密度与骨矿含量,将老年大鼠的测定结果与3月龄大鼠的测定结果进行比较,进一步证实老年大鼠的骨质疏松的发生[7]。
选取大鼠后,需将老年大鼠平均分为模型组与药物作用组,模型组不做其他处理,药物作用组可根据需要设置N(N≥1)组,每组作用不同剂量的药物。
与绝经后骨质疏松不同的是,研究老年骨质疏松,若需要明确骨质疏松造成的影响,则需要设置同等数量的低月龄大鼠(未发生老年骨质疏松)作为模型组的对照组[7],而研究绝经后骨质疏松的影响,只需要将假手术组与模型组进行对照。另外,以老年骨质疏松为研究对象时,无需进行手术获得骨质疏松动物模型,但大鼠的月龄应控制在15个月以上,以尽可能再现人类骨质疏松的状态。此外,需要注意的是,21个月以上的大鼠由于雌激素的缺乏, 雌性大鼠乳腺肿瘤发病率上升, 已不适合用于骨代谢研究。
3 继发性骨质疏松症动物模型构建及给药实验的实验方法
继发性骨质疏松是指由于疾病或药物等原因所致的骨量减少,骨微结构破坏,骨脆性增加和易于骨折的代谢性骨病,继发性骨质疏松症的病因有很多,包括药物治疗、甲状腺功能亢进、维生素D缺乏、原发性甲状旁腺功能亢进等。
糖皮质激素性骨质疏松症(GC-induced osteoporosis,GIO)是继发性骨质疏松症的常见形式,是导致发病率和死亡率增加的一个原因[8]。糖皮质激素(Glucocorticoids,GCs)是治疗炎症性和风湿性疾病的广泛药物。 然而,GCs可通过抑制成骨细胞的增殖和分化,增加骨脆性和骨折的概率[9],导致继发性骨质疏松甚至骨坏死。据估计,30%~50%的接受长期GCs治疗的患者会发生糖皮质激素诱发的骨质疏松[10]。
大鼠糖皮质激素性动物模型对研究人类糖皮质激素引起的继发性骨质疏松有积极意义,目前广泛使用的动物模型是SD大鼠和Wistar大鼠,周龄大多为8周[11]或12周[9-10],目前广泛用于动物模型上诱导糖皮质激素诱发的骨质疏松的药物是地塞米松[9-11],该药物是一种人工合成的强效、长效糖皮质激素,具有抗炎、抗过敏、抗休克作用,易获得且价格便宜。
大鼠糖皮质激素性动物模型建立之后,设置样本对照组、模型组和药物作用组,药物作用组的动物已被地塞米松诱导,患有骨质疏松GIO,每组大鼠数量相同,药物用量不同,设置多组实验组,避免实验偶然性,同时,有望通过多个实验组,找出治疗GIO的药物的最佳用量[12]。某些药物被提取出来之后是以结晶粉末的形式存在,给药时,需要根据其溶解性溶于助溶剂中[13]。处死大鼠后,取其股骨和血清作进一步评估。
4 药物具有治疗作用的判断依据
对于不同类型的骨质疏松,实验分组见图1。
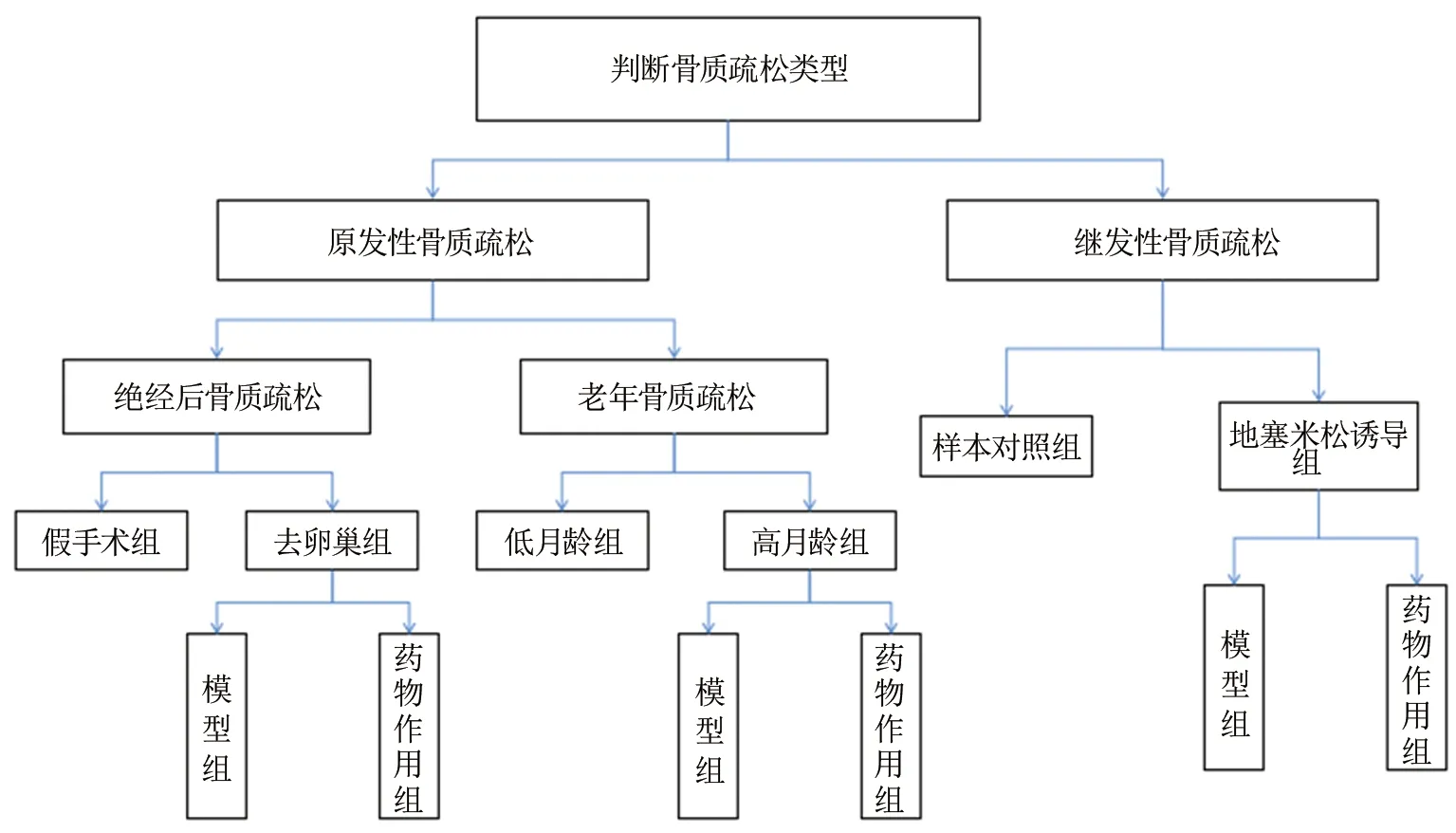
图1 各类骨质疏松动物实验的实验分组Fig.1 Experimental group of animal experiments on osteoporosis
以大鼠为模型研究不同类型的骨质疏松时,动物实验的分组可分为空白对照组、模型组与药物作用组。图1中假手术组、低月龄组、样本对照组均属于空白对照组,由于股骨是最容易骨折的部位[13],在骨质疏松动物模型中,大都以股骨为研究对象来测定骨密度、骨矿含量等,在进行试验时,测得各类指标之后,模型组与空白对照组对照,得出患有骨质疏松对各类指标的影响,药物作用组与模型组对照,得出药物治疗后,骨质疏松的改善情况。
药物是否具有治疗作用需要客观的指标来判断。现有的判断指标主要有骨量变化、骨组织形态计量学测定、血样生化参数、骨生物力学指标检测等。其中,骨量变化和骨组织显微结构变化与骨生物力学性能是主要指标,各类指标见表1。

表1 药效判断指标Table 1 Pharmacodynamic index
值得注意的是,在对血清中的钙、磷进行检测时,钙、磷水平变化不明显[3],因此,该项指标应作为辅助指标。对绝经后骨质疏松而言,由于该类型骨质疏松的发病与雌激素的减少有关,在比较各项指标时,可增加对雌二醇的检测[1,3],若药物能提高动物体内的雌二醇水平,可进一步评定药物有效,另外,可以计算出大鼠子宫、阴道等的器官系数,器官系数提高,表明药物对子宫和阴道组织有保护作用,器官系数计算公式如下[3]:
(1)
(2)
最后,相比老年骨质疏松而言,绝经后骨质疏松是高转换型骨质疏松,经过药物治疗后,骨钙素水平会降低得更为明显,因此,骨钙素是绝经后骨质疏松的药物研究中的一个重要指标,在老年骨质疏松中重要程度较低。以上指标均能从不同方面反映骨质疏松的治疗情况,需要对多种指标进行全面分析,才能得到关于药物治疗效果的全面判断。
5 改进骨质疏松治疗方案的实验方法
骨质疏松症的特征是低骨量、易骨折。由于骨质疏松症涉及到骨形成减少和骨吸收增加,很明显可以通过联合抗吸收和骨合成的药物来治疗骨质疏松症;另外,某些治疗骨质疏松合成代谢药物存在治疗窗口不长,患者对注射这些药物的依从性较差,患者有针头恐惧症等问题,这种情况下,可从给药方式进行优化,如将皮下注射改为鼻腔给药等。
因此,研究联合药物进行治疗和改变给药方式对研究骨质疏松具有重要意义。
5.1 联合药物进行治疗
对于联合药物的研究,大鼠糖皮质激素性动物模型建立之后,对大鼠进行分组,注意每组大鼠数量应该相同。实验分组见图1,就药物作用组而言,设置静脉注射两种药物联合组,单独抗吸收药物组,单独骨合成药物组,并注意联合作用药物组的药物用量可根据剂量反应的研究成果来确定[15]或设置为单独药物作用时的含量的叠加[7]。在治疗结束时,采集大鼠血清和股骨,对表1中各类指标进行检测,若联合药物的疗效好于单独的药物作用情况,证实联合药物具有一定的可行性。
5.2 改变给药方式
选取健康SD大鼠,设置鼻腔给药组、皮下注射组,评价鼻腔喷雾剂治疗骨质疏松的潜力,鼻腔喷雾剂有效性的关键因素是药代动力学,若结果显示鼻腔喷雾剂在大鼠模型中具有与皮下注射等效的药代动力学曲线,峰值血药浓度相当,证明该药物可由鼻腔给药[16]。
6 治疗骨质疏松的新型药物的选择方向
综合原发性骨质疏松与继发性骨质疏松的发病机制进行考虑,研发新药时,可从以下几个方面进行选择:
(1)对原发性骨质疏松而言,由于雌激素减少导致容易氧化,可选择具有抗氧化性能的物质[1,6];
(2)具有促进成骨细胞分化提高成骨作用的物质[9]和抑制破骨细胞骨吸收的物质[17]都可作为备选研发药物;
(3)从治疗其他疾病的药物中进行选择[17-18];
(4)根据以往的研究,在统计上去除体重的机械负荷效应后,体脂质量与骨量呈负相关,提示可以通过减重来增加骨量,从而预防骨质疏松[1];
7 总结
综上所述, 根据研究目的的不同,需采取不同的方法建立骨质疏松动物模型,这对于骨质疏松的发病机理的研究、新药研究、药物的改进均十分关键。目前,双侧卵巢切除法获得原发性骨质疏松动物模型和激素诱导获得继发性骨质疏松动物模型是两种常用方法。
总体来说,有效药物应能改善血液生化指标,提高骨密度、骨矿含量及骨力学性能等。比较各类指标,确认药物有效之后,也应考虑药物在治疗骨质疏松时的副作用、最佳用量、是否可以通过改变给药方式或与其他药物的联合治疗来增强疗效等问题。考虑继发性骨质疏松的病因,今后的研究中,需要克服的问题还有如何控制会引起骨质疏松的药物(如糖皮质激素等)的用量,使其既能有效治疗病症,又不会引起继发性骨质疏松。随着新技术的发展和骨质疏松研究的不断深入,相信建立骨质疏松动物模型、药物研发及提升药物疗效的方法将会越来越完善。
致谢
感谢国家自然科学基金重点项目“骨质疏松骨钙流失与血管壁钙盐沉积:基质囊泡介导钙转移的力学生物学机制(11932014)”的支持。

