8 周游泳运动对2 型糖尿病大鼠海马胰岛素抵抗的影响及机制
邓鹏辉,刘 霞,谭倩宇
(湖南师范大学体育学院 体适能与运动康复湖南省重点实验室,湖南 长沙410012)
相关研究人员预计至2045 年, 全球糖尿病人群将达到6.93 亿[1]。 同时,不断有学者将阿尔茨海默病称之为“3 型糖尿病”,并指出其与2 型糖尿病的内在联系体现在海马胰岛素抵抗[2]。因此海马胰岛素抵抗可能是2 型糖尿病所累及的中枢神经系统病变及认知功能改变的重要机制之一。
针对胰岛素抵抗的机制研究, 巨噬细胞分泌的TNFα 和IL1β 曾被认为是导致胰岛素抵抗的关键因子,然而,采用抑制此二者方法的临床试验所取得的疗效有限[3-5]。 目前,有研究指出半乳糖甘凝集素3(Gal-3)在诱导病理性胰岛素抵抗的发生发展过程中扮演重要角色, 并指出Gal-3 通过C 端的碳水化合物识别区域与糖基化的胰岛素受体结合, 降低其酪氨酸磷酸化,从而干扰胰岛素信号通路,最终导致IR[6]。 半乳糖苷凝集素-3 在正常大脑中的表达较弱。 研究发现,Gal-3 在成年大鼠海马中表达,并且在高脂饮食诱导的大鼠海马中gal-3 水平上升,同时伴随着海马组织胰岛素抵抗,紫甘薯色素干预可使海马组织中Gal-3 表达下调, 并以此改善海马组织胰岛素抵抗[7]。
另外,脂联素在抗胰岛素抵抗过程中同样扮演重要角色。脂联素是脂肪组织分泌的主要蛋白质之一, 其通过与受体结合发挥胰岛素增敏作用, 在胰岛素抵抗相关疾病中均发现脂联素和脂联素受体活性下调[8]。 早年研究显示,脂联素敲除大鼠中肌肉表现出严重的胰岛素抵抗, 具体表现为胰岛素受体底物1(IRS-1)以及磷脂酰3-激酶(PI3K)活性下降[9];运动干预,因其具有降血糖及降T2DM 发病率等作用,其在2 型糖尿病海马胰岛素抵抗的发病及其运动干预机制中是否发挥作用,本文将对此进行研究。
1 材料与方法
1.1 实验对象与分组
本实验以6 周龄雄性SD 大鼠为对象, 体重150~190g,(购于长沙市天勤生物技术有限公司(S(XK(湘)2014-0011))每笼5~6 只,自然光,每天定时更换垫料。 实验前适应喂养3天,后随机分为两组:空白对照组(NC 组,n=10),糖尿病模型组(DM 组,n=30)。 DM 组采用高脂膳食饲养基础上,自由进食。高脂喂养4 周后,DM 组大鼠禁食、禁水后按40mg/kg 剂量注射1%STZ。 一周后测大鼠尾静脉空腹血糖浓度, 超过7.8mmol/L,说明建模成功。 建模成功后恢复正常饮食。 并将大鼠分为糖尿病对照组(DM 组,n=7)和糖尿病运动组(DME 组,n=7)。
1.2 运动方案
DME 组大鼠每天进行无负重游泳训练60min,每周6 天,休息一天,共8 周。 前一周为适应周,一周内训练时间过渡到60min。 训练过程中,时刻观察大鼠状态,防溺死,并及时捞出大鼠粪便,保持水清洁卫生。 运动结束后用干毛巾迅速吸水,并吹干放回笼中。
1.3 实验取材
取材于末次训练后12h 进行,禁食禁水。 以2.5ml/kg 的剂量,腹腔注射10%的水合氯醛麻醉,随后胸主动脉取血,放入血清促凝管中。 静止半小时,在4℃,4 000r/min 离心,取上清液保存于-20℃冰箱,待测。 取大鼠海马组织放入冻存管内迅速投入液氮,后放于-80℃冰箱冷冻待测。
1.4 指标检测
1.4.1 血清FBG、INS 含量的测定
血清FBG 采用葡萄糖氧化酶法,测定仪器为紫外分光光度计,试剂盒购买于南京建成生物工程研究所;血清INS 的含量用酶联免疫法测定, 试剂盒购于南京森贝伽生物科技有限公司。 胰岛素抵抗指数(HOMA-IR)=空腹胰岛素(INS)×空腹血糖(FBG)/22.5≥2.69 有胰岛素抵抗。
1.4.2 海马组织Galectin-3、IRS-1、PI3K、Akt、Adiponectin、AMPK、GLUT4mRNA 表达量的测定
采用Real-time PCR 法测定, 使用总RNA 提取试剂盒(Evo M-MLV RT Premix for qPCR),反转录成cDNA(Evo MMLV RT Premix for qPCR 试剂盒), 反应条件为:95℃预变性30s;95℃变性5s;60℃退火34 s;重复40 个循环;添加溶解曲线。程序运行结束后,将目的基因的Ct 值与内参GAPDH 进行标准化,计算出目的基因的相对表达量。PCR 引物序列均由上海生物工程有限公司设计并合成,引物序列见下表1。

表1 RT-PCR 特异性引物序列表
1.5 统计学分析
本研究应用SPSS17.0 软件进行数据统计学处理, 采用SPSS 统计软件进行独立样本方差分析。 p<0.05 为差异具有显著统计学意义,p<0.01 为差异具有非常显著统计学意义。
2 研究结果
2.1 实验大鼠血清FBG、INS、HOMA-IR 的含量
从表2、图1 可知,与NC 组相比,DM 组大鼠血清FBG、HOMA-IR 的含量显著增加(p<0.01),而大鼠血清INS 含量减少,且无显著差异(p>0.05);与DM 组相比,DME 组大鼠血清FBG、HOMA-IR 的含量显著减少(p<0.05)、而大鼠血清INS、含量减少,但无显著差异(p>0.05)。

图1 实验大鼠血清中FBG、INS、HOMA-IR 的含量
2.2 各组实验大鼠海马Galectin-3、IRS-1、PI3K、AktmRNA 表达水平
如表3 及图2 所示,实验8 周后,与NC 组相比,DMC 组大鼠Galectin-3、IRS-1mRNA 表达水平显著升高 (p<0.05;p<0.01),PI3K mRNA 表达水平非常显著降低(p<0.01),AKtmRNA 表达水平无显著性变化,但有明显的下降趋势。与DMC 组相比,DME 组大鼠Galectin-3mRNA 表达水平显著降低 (p<0.05), 而PI3KmRNA 表达水平呈非常显著增加 (p<0.01),IRS-1 及AKt mRNA 表达水平无显著性变化。
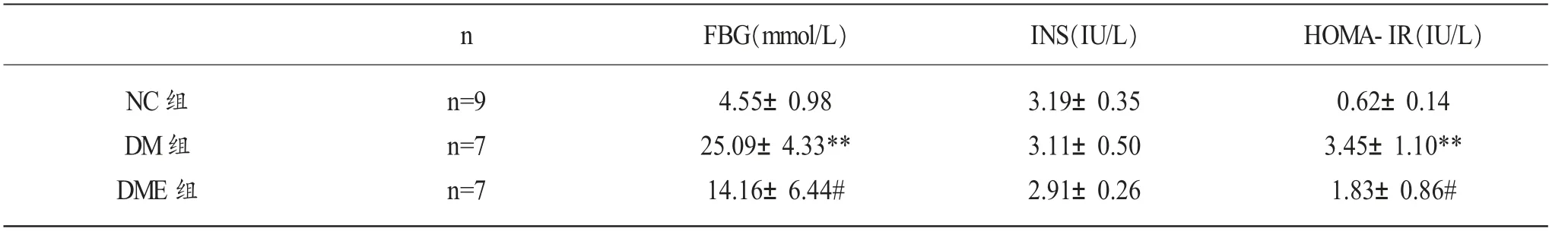
表2 实验大鼠血清FBG、INS、HOMA-IR 含量
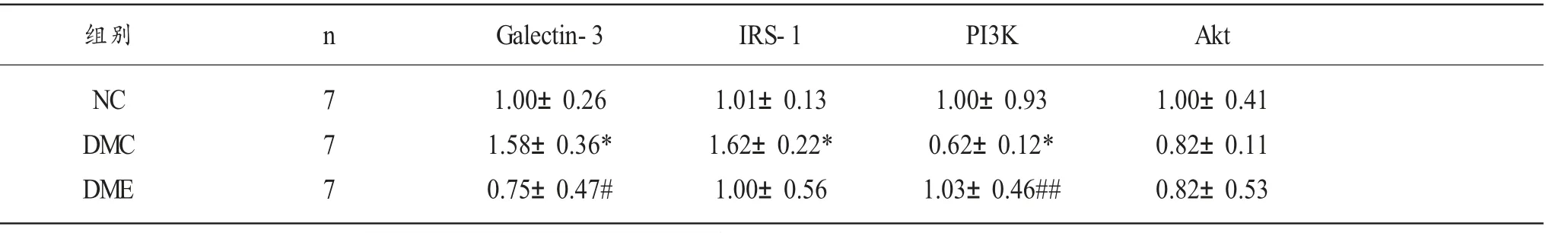
表3 各组实验大鼠海马Galectin-3、IRS-1、PI3K、AktmRNA 表达水平

图2 各组实验大鼠海马Galectin-3、IRS-1、PI3K、AktmRNA 表达水平
2.3 各组实验大鼠海马Adiponectin、AMPK、GLUT4-mRNA 表达水平
如表4 及图3 所示,实验8 周后,较NC 组,DMC 组大鼠海马组织GLUT4 及Adiponectin (脂联素)mRNA 表达水平非常显著降低 (p<0.01),AMPKmRNA 表达水平无显著性变化,但存在有明显的下降趋势。 较DMC 组,DME 组大鼠海马组织、GLUT4 及Adiponectin mRNA 表达水平呈显著增加 (p<0.01;p<0.05),AMPK mRNA 表达水平无显著性变化, 但仍存在改善趋势。

表4 各组实验大鼠海马Adiponectin、AMPK、GLUT4mRNA表达水平
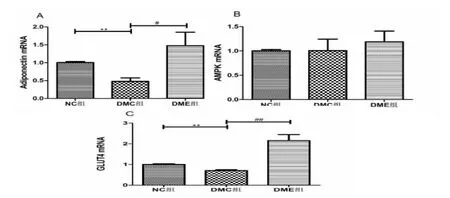
图3 各组实验大鼠海马Adiponectin、AMPK、GLUT4mRNA表达水平
3 分析与讨论
3.1 2 型糖尿病大鼠模型的复制以及海马胰岛素抵抗相关指标的变化
本次模型的建立采用清洁级大鼠, 通过高脂喂养以及药物干预建立模型。 这种方法能够更好地模拟人类2 型糖尿病的发生、发展的过程,以及缩短发病周期。 此模型的特点主要在于:1) 高脂饲料可以诱导实验大鼠发生高血脂症以及胰岛素抵抗,避免了1 型糖尿病的发生。 2)STZ 对于实验动物的胰岛细胞有高选择性毒副作用, 一定剂量的STZ 可以使胰岛β细胞受损,胰岛素合成和分泌能力降低,从而使血糖升高,形成2 型糖尿病。 本实验DMC 组FBG 显著性高于NC 组 (p<0.01), 而DME 组FBG 显著性低于DMC 组 (p<0.05)。 尽管NC、DMC 和DME 组胰岛素 (Ins) 水平无显著性变化, 但是DMC 组和DME 组大鼠HOMA-IR 显著性高于NC 组(p<0.01,p<0.05),同时较DMC 组大鼠,DME 组HOMA-IR 显著性降低(p<0.05)。本实验结果表明,2 型糖尿病造模成功。多数研究支持IRS-1、PI3K、AKt 作为评定组织性胰岛素抵抗的黄金指标。本研究发现, 该实验所建立的2 型糖尿病大鼠大鼠模型海马组织存在胰岛素抵抗,具体表现为,DMC 组较NC 组大鼠海马组织、IRS-1mRNA 表达水平显著性升高(p<0.05),PI3KmRNA表达水平非常显著降低(p<0.01),可见,糖尿病大鼠海马组织存在胰岛素抵抗。
3.2 有氧运动通过半乳糖苷凝集素3(Gal-3)改善2 型糖尿病大鼠海马胰岛素抵抗
多项研究指出半乳糖苷凝集素3(Gal-3)与胰岛素抵抗密切相关。 乳糖苷凝集素3(Galectin-3,Gal-3)属于半乳糖苷凝集素Galectins 家族的一员,该家族是一类可结合β-半乳糖苷的动物凝集素,由巨噬细胞等免疫细胞分泌,在诸如免疫和炎症应答、 肿瘤发生和生长等多种生理和病理过程中都起着重要作用。 研究发现,Gal-3 通过C 端的碳水化合物识别区域与糖基化的胰岛素受体结合,降低其酪氨酸磷酸化,以此干扰胰岛素信号通路,最终导致IR[10]。靶向Gal3 的研究结果发现,无论敲除Gal-3 基因还是给予Gal-3 抑制剂都能明显改善肥胖小鼠的IR。半乳糖苷凝集素-3 在患肥胖和2 型糖尿病的人及鼠类体内高表达;半乳糖苷凝集素-3 在2 型糖尿病患者体内的表达水平显著升高。 半乳糖苷凝集素-3 在肥胖症和2 型糖尿病患者体内表达量显著升高且无性别差异, 并与2 型糖尿病患者体内的糖化血红蛋白(HbA1c)含量呈负相关。 并且在糖尿病患者研究中发现,gal-3 水平与空腹胰岛素(r=-0.56,p<0.01)、胰岛素抵抗稳态模型评价(r=-0.52,p<0.05)和胰岛素敏感性指数(r=0.62,p<0.005)均显著相关。研究发现,Gal-3 在成年大鼠海马中表达,并且在高脂饮食诱导的小鼠海马中gal-3水平上升,同时伴随着海马组织胰岛素抵抗,紫甘薯色素干预可使海马组织中Gal-3 表达下调, 并以此改善海马组织胰岛素抵抗及其认知功能障碍[7]。 上述研究提示:海马胰岛素抵抗的发生可能由海马组织中Gal-3 水平升高诱发的。 本研究结果显示, 较NC 组,DMC 组大鼠Galectin-3、IRS-1mRNA 表达水平显著性升高 (p<0.05); 同时, 较DMC 组,DME 组大鼠Galectin-3mRNA 表达水平显著性降低。
3.3 有氧运动通过脂联素/AMPK/GLUT4 信号通路改善2 型糖尿病大鼠海马胰岛素抵抗
本研究结果显示, 海马胰岛素抵抗不仅与半乳糖苷凝集素3(Gal-3)密切相关,同时脂联素/AMPK/GLUT4 信号通路在海马胰岛素抵抗发生、发展中同样扮演重要角色。 较NC 组,DMC 组大鼠海马组织GLUT4 及Adiponectin mRNA 表达水平呈显著性降低(p<0.05),尽管AMPKmRNA 表达水平无显著性变化,但有明显的下降趋势。 同时,较DMC 组,DME 组大鼠海马组织GLUT4 及Adiponectin mRNA 表达水平呈显著性增加,尽管AMPK mRNA 表达水平无显著性变化, 但仍存在改善趋势。 本实验结果提示:脂联素/AMPK/GLUT4 信号通路在2 型糖尿病大鼠海马组织胰岛素抵抗的发生、 发展以及运动干预改善2 型糖尿病大鼠海马组织胰岛素抵抗扮演重要角色。 同时,近年来,多项研究指出,脂联素/AMPK/GLUT4 信号通路与胰岛素抵抗密切相关。 具体地说,目前,已发现10 余个脂联素基因常见的单核苷酸多态性(SNPs)及一些罕见的错义突变,它们与胰岛素抵抗的发生密切相关。 在2 型糖尿病、肥胖症、动脉粥样硬化和脂代谢紊乱等胰岛素抵抗相关疾病中, 血浆脂联素水平均明显下降, 并且血浆脂联素水平的下降和胰岛素抵抗的发展相平行[11];通过给严重胰岛素抵抗的脂肪萎缩小鼠注射基因重组的脂联素后发现,骨骼肌胰岛素受体和Akt激酶磷酸化以及IRS- 1 酪氨酸磷酸化明显增加。 动物实验也证明,脂联素基因敲除小鼠肌肉中PI3K 活性明显降低,通过腺病毒载体转染的方法提高血浆脂联素水平后可显著提高肌肉中PI3K 的活性,其胰岛素敏感性明显增加[12]。 上述研究结果提示,脂联素与胰岛素抵抗密切相关,同时目前多数研究多集中在脂联素与外周胰岛素抵抗的关系, 本研究结果提示脂联素同样与中枢胰岛素抵抗密切相关,同时,运动干预具有改善中枢脂联素/AMPK/GLUT4 信号通路病理性变化以此达到改善海马胰岛素抵抗的作用。
4 结论
1)2 型糖尿病将导致病理性中枢胰岛素抵抗,同时8 周有氧运动能够有效改善2 型糖尿病海马胰岛素抵抗。
2)8 周有氧运动可能通过降低海马组织Gal-3 水平以及提高脂联素/AMPK/GLUT4 信号通路表达,从而达到改善2 型糖尿病海马胰岛素抵抗, 同时Gal-3 以及脂联素/AMPK/GLUT4 信号通路异常可能也是2 型糖尿病病理性引发中枢胰岛素抵抗的机制之一。

