丙泊酚对滋养细胞增殖、侵袭的影响及相关机制研究
刘佳
滋养细胞来自胚胎外滋养层,具有滋养功能,妊娠早期滋养细胞侵入母体蜕膜间质与血管,使螺旋动脉发生重铸,保证胎盘正常形成与妊娠进展[1]。滋养细胞与恶性肿瘤细胞有诸多相似性,高度增殖、侵袭迁移及逃避免疫系统攻击,在流产、先兆子痫等妊娠病理情况中发挥重要作用[2]。丙泊酚是临床常用麻醉剂,有研究显示,丙泊酚可降低流产率,逆转流产胎盘,蜕膜结构的病理改变,可能对滋养细胞的恶性增殖发挥抑制作用[3,4]。磷脂酰肌醇激酶(phosphatidylinositol kinase,PI3K)是生长因子激活的受体酪氨酸激酶和G蛋白受体重要的下游信号成分。研究显示多种母胎界面的生长因子可激活PI3K/蛋白激酶B(protein kinase B,Akt)通路促进细胞增殖、侵袭过程[5,6],丙泊酚是否通过PI3K/Akt信号通路对滋养细胞增殖、侵袭功能进行调控。本研究通过体外培养滋养细胞系JEG-3,检测丙泊酚对JEG-3细胞增殖、侵袭的影响,并使用PI3K抑制剂LY294002进行实验,旨在探讨丙泊酚对滋养细胞恶性增殖的调控作用,为丙泊酚的合理利用提供理论基础。
1 材料与方法
1.1 材料 细胞株:人细胞外滋养细胞株JEG-3购自中国科学院上海生物研究所。主要试剂及来源:12%胎牛血清、胰酶、DMEM/F12培养基购自上海语纯生物科技有限公司;CCK8相关试剂购自上海翊圣生物有限公司;蛋白提取试剂盒、BCA试剂盒购自美国sigma公司;鼠抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、金属基质蛋白酶2(metallopro-teinase 2,MMP-2)、金属基质蛋白酶9(metalloproteinase 9,MMP-9)、p-PI3K、PI3K、p-Akt、Akt、GAPDH一抗及辣根过氧化物酶标记羊抗鼠免疫球蛋白购自上海强耀生物科技有限公司;Transwell相关试剂购自美国BD公司;ECL化学发光剂试剂盒购自北京鼎国昌盛生物技术有限责任公司;核酸蛋白测定仪及凝胶成像仪购自德国Eppendorf公司;CO2培养箱购自上海丙林电子科技有限公司。
1.2 方法
1.2.1 细胞培养:以5×105/cm2密度接种于培养瓶中,使用含有12%胎牛血清的DMEM/F12培养基中培养,待细胞融合胰酶消化,PBS洗涤传代。以5×105/cm2接种于6孔板,使用无血清培养基培养细胞。
1.2.2 细胞分组:加入不同浓度的丙泊酚(1 μg/ml、4 μg/ml、7 μg/ml),以未加丙泊酚处理细胞作为对照组,于37℃、5% CO2条件下培养。
1.2.3 CCK-8法检测细胞增殖能力:收集1.2.2中各组培养细胞,分别接种至96孔板中,常规培养24、48、72 h后,加入CCK-8试剂,4 h后在酶标仪上测定450 mn 处的吸光度值。每组均6个复孔。
1.2.4 Transwell法检测细胞侵袭能力:Transwell侵袭实验:将基质胶与不含血清的RPMI-1640培养基按1∶8的比例混合稀释后包被在上层小室并风干过夜,在上室中接种1.2.2中各组重悬细胞(细胞密度2×106/ml),下室加入600 μl RPMI-1640培养基(含10%的FBS)。培养24 h后去除小室,棉签擦除上室基质胶与细胞,甲醛固定15 min后0.1%结晶紫染色,用倒置显微镜随机选取5个视野并拍照,取平均值。Transwell迁移试验:除不加入基质胶外,其他步骤与侵袭试验完全相同。
1.2.5 免疫印迹法(western blotting,WB)检测细胞增殖、侵袭相关蛋白表达:收集1.2.2中各组细胞,经蛋白提取试剂盒提取细胞总蛋白,通过BCA蛋白试剂盒检测细胞总蛋白含量,取蛋白样品10~20 μl,经凝胶分离后,转移至PVDF膜上,封闭1 h,加入一抗,均为1∶1 000稀释,4℃过夜;TBST洗涤后,加入二抗(1∶500稀释),室温孵育1~2 h,经ECL底物化学发光显色后曝光显影,Tanon 600图像分析系统拍照并进行定量分析。实验重复6次,取平均值。
1.2.6 PI3K/Akt信号抑制剂对细胞增殖、侵袭迁移的影响:收集1.2.2中对照组细胞及丙泊酚7 μg/ml组细胞,各自分成2份,其中1份不做处理,另1份加入终浓度为30 μmol/L的PI3K/Akt信号通路特异性抑制剂LY294002共培养,按照1.2.3与1.2.4中方法检测各组细胞增殖、侵袭迁移能力,按照1.2.5中方法检测细胞PCNA、MMP-2、MMP-9、p-PI3K、PI3K、p-Akt、Akt蛋白表达。

2 结果
2.1 滋养细胞增殖能力测定 与对照组比较,同一时间内丙泊酚1 μg/ml组、丙泊酚4 μg/ml组、丙泊酚7 μg/ml组增殖抑制率依次升高,差异有统计学意义(P<0.05);与24 h相比,48 h与72 h细胞增殖抑制率显著升高,差异有统计学意义(P<0.05),同一浓度下48 h与72 h间比较差异无统计学意义(P>0.05)。见表1。

表1 不同浓度丙泊酚对JEG-3细胞增殖抑制率的影响
2.2 不同浓度丙泊酚对滋养细胞侵袭、迁移的影响 与对照组比较,丙泊酚1 μg/ml组、丙泊酚4 μg/ml组、丙泊酚 7 μg/ml组侵袭、迁移细胞数显著下降,差异有统计学意义(P<0.05);与丙泊酚1 μg/ml组比较,丙泊酚4 μg/ml组、丙泊酚7 μg/ml组侵袭迁移细胞数显著下降(P<0.05);与丙泊酚4 μg/ml组比较,丙泊酚7 μg/ml组侵袭迁移细胞数显著下降,差异有统计学意义(P<0.05)。见图1,表2。

对照组 丙泊酚1 μg/ml组 丙泊酚4 μg/ml组 丙泊酚7 μg/ml组

表2 Transwell实验检测丙泊酚对细胞侵袭、迁移能力的影响 n=6,个,
2.3 不同浓度丙泊酚对增殖、侵袭迁移相关蛋白表达影响 与对照组比较,丙泊酚处理各组PCNA、MMP-2、MMP-9、p-PI3K/PI3K、p-Akt/Akt表达均显著降低,差异有统计学意义(P<0.05);与丙泊酚1 μg/ml处理组比较,丙泊酚4 μg/ml、丙泊酚7 μg/ml处理组的PCNA、MMP-2、MMP-9、p-PI3K/PI3K、p-Akt/Akt蛋白表达显著降低,差异均有统计学意义(P<0.05);与丙泊酚4 μg/ml处理组比较,丙泊酚7 μg/ml处理组的PCNA、MMP-2、MMP-9、p-PI3K/PI3K、p-Akt/Akt表达显著降低,差异均有统计学意义(P<0.05)。见图2,表3。
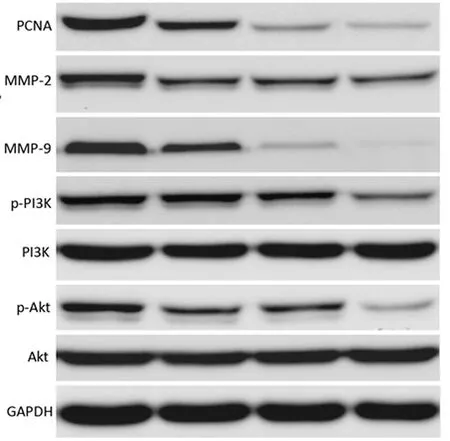
对照组 丙泊酚1 μg/ml组 丙泊酚4 μg/ml组 丙泊酚7 μg/ml组

表3 丙泊酚对PCNA、MMP-2、MMP-9及p-PI3K/PI3K、p-Akt/Akt表达影响
2.4 PI3K/Akt通路抑制剂对JEG-3细胞增殖、侵袭迁移的影响 与对照组比较,抑制剂组、丙泊酚组、丙泊酚+抑制剂组细胞增殖抑制率均显著增加,差异有统计学意义(P<0.05),侵袭、迁移细胞数均显著减低,差异有统计学意义(P<0.05);与抑制剂组比较,丙泊酚组细胞抑制率、侵袭细胞数、迁移细胞数差异无统计学意义(P>0.05),丙泊酚+抑制剂组细胞增殖抑制率显著增加(P<0.05),侵袭、迁移细胞数显著降低,差异有统计学意义(P<0.05);与丙泊酚组比较,丙泊酚+抑制剂组细胞增殖抑制率显著增加,差异有统计学意义(P<0.05),侵袭、迁移细胞数显著降低,差异有统计学意义(P<0.05)。见图3,表4。

对照组 抑制剂组 丙泊酚7 μg/ml组 丙泊酚+抑制剂组

表4 PI3K/Akt通路抑制剂对A431细胞增殖、侵袭迁移的影响
2.5 PI3K/Akt通路抑制剂对JEG-3细胞增殖、侵袭迁移及PI3K/Akt通路相关蛋白表达影响 与对照组比较,抑制剂组、丙泊酚组、丙泊酚+抑制剂组PCNA、MMP-2、MMP-9、p-PI3K/PI3K、p-Akt/Akt蛋白表达显著降低,差异有统计学意义(P<0.05);与抑制剂组比较,丙泊酚组PCNA、MMP-2、MMP-9、p-PI3K/PI3K、p-Akt/Akt蛋白表达差异无统计学意义(P>0.05),丙泊酚+抑制剂PCNA、MMP-2、MMP-9、p-PI3K/PI3K、p-Akt/Akt蛋白表达显著降低,差异有统计学意义(P<0.05);与丙泊酚组比较,丙泊酚+抑制剂组PCNA、MMP-2、MMP-9、p-PI3K/PI3K、p-Akt/Akt蛋白表达显著降低,差异有统计学意义(P<0.05)。见图4,表5。

对照组 抑制剂组 丙泊酚7 μg/ml组 丙泊酚+抑制剂组

表5 PI3K/Akt通路抑制剂对JEG-3细胞增殖、侵袭迁移及PI3K/Akt通路相关蛋白表达影响
3 讨论
滋养细胞可向母体子宫壁内浸润,当其生长的精确时空调控被打破,可形成滋养细胞肿瘤,促使胚胎由良性葡萄胎向侵蚀性葡萄胎、绒癌转化,早期可经血运传播转移,严重威胁女性健康。丙泊酚为烷基酸类短效静脉麻醉药物,在临床中常用。研究显示,丙泊酚对肝癌、胃癌等恶性肿瘤有抗肿瘤作用,但在滋养细胞肿瘤中研究较少,本研究通过探讨丙泊酚对滋养细胞JEG-3增殖、侵袭迁移作用并探讨可能机制,为滋养细胞肿瘤的治疗提供理论基础。
临床中,丙泊酚作为麻醉剂血浆浓度为3~8 μg/ml,根据文献及预试验结果[7],本研究选取丙泊酚浓度分别为1、4、7 μg/ml。研究显示,丙泊酚对多种恶性肿瘤细胞增殖具有明显抑制作用,如胰腺癌、宫颈癌等[8,9]。本研究发现丙泊酚作用JEG-3细胞48 h、72 h时,细胞增殖抑制率显著升高,且随丙泊酚剂量的增加(1、4、7 μg/ml)增殖抑制率升高,提示丙泊酚对抑制JEG-3细胞增殖具有一定抑制作用,同一浓度下处理48 h与72 h差异无统计学意义(P>0.05),因此,后续试验选取丙泊酚处理48 h。PCNA与细胞DNA合成密切相关,在细胞增殖启动上发挥重要作用,其异常高表达是肿瘤恶性增殖的标志之一[10]。本研究中丙泊酚处理后,JEG-3细胞中PCNA蛋白表达随丙泊酚浓度升高依次降低,提示丙泊酚可抑制滋养细胞恶性增殖。
有研究指出,临床相关浓度的丙泊酚可减少人肺癌、前列腺癌细胞侵袭能力[11,12]。Xu等[13]研究显示,丙泊酚处理可通过抑制细胞外调节蛋白激酶1/2(ERK1/2)通路激活,降低MMP-2/MMP-9蛋白表达,发挥抑制食管鳞状细胞癌细胞ECA-109侵袭能力。本研究Transwell小室试验显示,随丙泊酚剂量增加,侵袭、迁移细胞数依次降低,提示丙泊酚可抑制JEG-3细胞侵袭与迁移,且呈剂量依赖效应。研究表明,MMP-2、MMP-9可降解细胞外基质,促进肿瘤细胞迁移、侵袭,是癌细胞重要侵袭转移调控因子[14-16]。研究发现在恶性葡萄胎组织中MMP-2、MMP-9阳性表达显著高于良性葡萄胎患者,推测其可作为滋养细胞浸润早期的诊断标志物[17]。本研究结果显示JEG-3细胞中MMP-2、MMP-9蛋白表达随丙泊酚浓度升高而降低,提示丙泊酚可能通过影响MMP-2、MMP-9蛋白表达抑制细胞侵袭、迁移过程。
PI3K/Akt信号通路参与细胞增殖、分化、凋亡等多种细胞功能调节,在许多恶性肿瘤中PI3K持续激活,促进恶性肿瘤的恶性转化[18,19]。研究显示,阻断PI3K/Akt信号通路传导可抑制滋养细胞肿瘤增殖与转移[20]。本研究中,经丙泊酚处理后,JEG-3细胞中PI3K及Akt蛋白磷酸化水平呈剂量依赖性降低,提示丙泊酚可能抑制PI3K/Akt通路活化。添加PI3K/Akt通路特异性抑制剂LY294002后,结果发现与丙泊酚组相比增殖、侵袭迁移及相关蛋白表达差异无统计学意义(P>0.05),提示丙泊酚处理与添加通路抑制剂效果相当,丙泊酚+抑制剂组JEG-3细胞增殖抑制率进一步升高、侵袭迁移细胞数进一步降低,PCNA、MMP-2、MMP-9、p-PI3K/PI3K、p-Akt/Akt蛋白表达显著下降,进一步提示丙泊酚可能通过抑制PI3K/Akt信号通路活化发挥抑制JEG-3细胞增殖与侵袭迁移作用。
综上所述,丙泊酚可能通过抑制PI3K/Akt信号通路活化,抑制滋养细胞JEG-3细胞增殖、侵袭迁移,为滋养细胞肿瘤的治疗提供新的依据。但本研究也存在一定不足,滋养细胞恶性增殖过程十分复杂,PI3K/Akt可能仅为发挥作用的其中一个通路,有关丙泊酚抑制滋养细胞恶性增殖、侵袭相关机制有待进一步研究。

