奥曲肽联合乌司他丁治疗急性重症胰腺炎疗效及安全性分析
俞薇 刘超
急性重症胰腺炎(severe acute pancreatitis,SAP)是一种严重急腹症,由胰腺内胰液被激活,消化自身胰腺组织,导致局部胰腺水肿、出血、坏死,严重者胰酶入血损伤全身酶系统和机体远处脏器,产生细胞因子及炎性介质,引发全身炎性反应,甚至多器官功能障碍,有较高的致死率[1]。本病病情严重,进展迅速,并发症发生率高,临床治疗的关键在于早期阻断胰酶活性和防止机体发生全身炎性反应[2]。奥曲肽为SAP治疗的常用药,能够抑制胰液分泌,减少胰酶的产生,降低胰腺自身消化,但对机体炎性反应无明显控制作用。乌司他丁为精制酸性糖蛋白,能抑制炎性因子的释放,保护器官功能[3]。本研究进一步分析奥曲肽联合乌司他丁治疗SAP的临床疗效及安全性,汇报如下。
1 资料与方法
1.1 一般资料 将90例SAP患者随机分为2组。观察组45例,男27例,女18例;年龄34~72岁,平均年龄(52.5±11.9)岁;对照组45例,男27例,女18例;年龄34~72岁,平均年龄(52.5±11.9)岁。2组年龄、性别比等资料差异无统计学意义(P>0.05)。
1.2 纳入标准 所有患者符合中华医学会外科学分会胰腺外科学组制定的《急性胰腺炎诊治指南(2014版)》[4]中SAP诊断标准,发病时间<72 h,急性生理和慢性健康状况Ⅱ(APACHEⅡ)评分≤16分;存在明显的上腹疼痛伴腹胀、腹部反跳痛、腹膜刺激征、呕吐、发热,血尿淀粉酶明显升高,CT检查显示胰腺有不同程度的水肿、坏死;本研究经我院伦理委员会批准,患者及家属均签署知情同意书,自愿加入研究。
1.3 排除标准 创伤、手术、糖尿病等引起继发性重症胰腺炎,合并胰腺或其他部位感染,严重心肝肾疾病,合并自身免疫系统疾病,药物过敏者。
1.4 方法 (1)所有患者给予常规内科治疗,严格禁食、胃肠减压、营养支持、抗感染、抑酸、解痉、改善微循环、补充循环血量、维持水和电解质平衡、镇痛镇静等对症治疗。(2)在此基础上,对照组使用醋酸奥曲肽注射液(北京百奥药业有限责任公司生产,1 ml∶0.1 mg),首诊时静脉推注10 μg,之后将0.6 g加入0.9%氯化钠溶液20 ml,以25 μg/h的速度持续静脉泵注24 h,1次/d,连续使用2周[5]。(3)观察组在对照组基础上使用注射用乌司他丁(广东天普生化医药股份有限公司生产,1 ml:5万单位),将20万U位加入5%葡萄糖注射液500 ml中静脉滴注,2 h内滴完,1次/d,连续使用2周[6]。均治疗2周后评价疗效。
1.5 疗效判断标准 治愈:治疗7 d内各症状及体征完全消失,血尿淀粉酶恢复正常,影像学检查胰腺恢复正常;显效:治疗7 d内各症状及体征明显改善,血尿淀粉酶明显下降,影像学检查胰腺大部分恢复正常;有效:治疗7 d内各症状及体征有所缓解,血尿淀粉酶有所下降,影像学检查胰腺小部分恢复正常;无效:治疗7 d内各症状及体征无明显改善,血尿淀粉酶及影像学检查均无好转[7]。
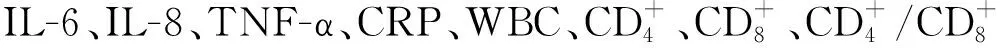

2 结果
2.1 2组患者临床疗效比较 观察组治疗有效率为91.11%,明显高于对照组的73.33%(P<0.05)。见表1。

表1 2组患者临床疗效比较 n=45,例(%)
2.2 2组患者症状体征消失时间及血淀粉酶恢复正常时间比较 观察组腹痛腹胀消失时间、恶心呕吐消失时间、腹膜刺激征消失时间、胃肠减压时间、血淀粉酶恢复正常时间、治愈时间均明显短于对照组,差异有统计学意义(P<0.05)。见表2。
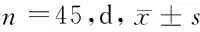
表2 2组患者症状体征消失时间及血淀粉酶恢复正常时间比较
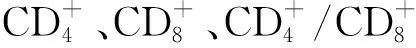
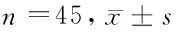
表3 2组患者治疗前后各项血清炎症及免疫指标变化
2.4 2组患者并发症发生率比较 观察组45例中,菌血症1例、腹腔严重感染1例、脓毒血症2例、MODS 1例、肝功能衰竭0例、休克0例,共5例,并发症发生率为11.11%;对照组45例中,菌血症4例、腹腔严重感染4例、脓毒血症6例、MODS 3例、肝功能衰竭1例、休克1例,共19例,发生率为42.22%;观察组菌血症、脓毒血症、腹腔严重感染、MODS、肝功能衰竭、休克等并发症发生率明显低于对照组(P<0.05)。
2.5 2组患者不良反应比较 观察组45例中,发生头痛1例、皮肤过敏1例、恶心呕吐1例、嗜酸粒细胞增多1例,共4例,不良反应发生率为8.89%;对照组45例中,发生恶心呕吐1例、嗜酸粒细胞增多1例、皮肤过敏1例,共3例,不良反应发生率为6.67%;2组在头痛、恶心呕吐、皮肤过敏、嗜酸粒细胞增多等不良反应发生率上无明显差异(P>0.05)。
3 讨论
SAP的发病机制至今尚未明确,多数研究认为与多种原因引起的体内酶异常激活,正常胰腺组织被胰液消化,导致胰腺细胞泡遭到破坏,病情累及胰腺及周围组织,随着病情进展,病变部位释放大量炎性因子,引起炎性反应的联级反应,引发全身炎性反应[8]。临床表现为急剧的上腹部疼痛、恶心呕吐等消化道症状,血尿淀粉酶明显升高,发生菌血症、脓毒血症、腹腔重度感染、MODS等严重并发症,病情凶险,病死率较高[9]。

临床治疗SAP的关键在于快速阻断胰酶对胰腺的自身消化、抑制炎症联级反应,预防并发症。奥曲肽是与天然内源性生长抑素有相似作用的人工合成的八肽环状化合物,作用较强且持续时间久,与天然内源性生长抑素相比,半衰期是其的30倍[17]。奥曲肽能够持续抑制胰消化酶及胰液的分泌,降低碳酸氢盐、胰液量和消化酶的分泌量,并能胃肠道及胰腺的内分泌激素病理性分泌,使得胃泌素、胰高血糖素、胰促胰泌素等胃肠胰内分泌激素含量明显下降,保护胰腺组织,降低胰腺损害,保护胰腺功能[18]。同时,抑制磷脂酶A2的活性和胰酶的活性,促进坏死性毒素的消除和吸收,减轻胰管内压力,松弛Oddi括约肌,促进肠道电解质和水的吸收,刺激单核巨噬细胞系统,减轻内毒素血症[19]。但单纯使用奥曲肽无法有效控制因胰酶异常激活诱发的炎性反应[20]。
乌司他丁为外源性蛋白酶抑制剂,具有广谱酶抑制性作用,能抑制胰蛋白酶作用,降低胰蛋白酶、溶酶体酶、弹性硬蛋白酶等多种蛋白酶释放,减少内毒素吸收,清除氧自由基,保护胰腺组织功能,并减轻其他组织受损,可用于急性循环衰竭的抢救治疗[21];增加胰腺血流量,防止微血栓形成,改善机体微循环[22];有效稳定机体溶酶体膜,抑制细胞因子的流动性,干扰效应体结合受体,抑制炎性介质及内源性休克因子的释放,减轻机体炎性反应,减少远处脏器功能损伤[23];还可可纠正血液淀粉酶水平,促进患者症状缓解,改善患者腹痛、腹胀等临床症状,缩短治疗时间[24]。
本研究结果显示,观察组疗效、症状消失时间、炎性因子及免疫功能指标均优于对照组(P<0.05);观察组菌血症、脓毒血症、腹腔严重感染、MODS、肝功能衰竭、休克等并发症发生率明显低于对照组(P<0.05);2组在头痛、恶心呕吐、皮肤过敏、嗜酸粒细胞增多等不良反应发生率上无明显差异(P>0.05)。充分证明奥曲肽联合乌司他丁治疗SAP效果确切,能从不同作用途径发挥疗效,一方面增强了抑制胰液和消化酶分泌作用,减轻胰腺的自身消化;另一方面抑制胰酶及细胞因子释放,改善胰腺微循环,抑制机体炎性反应,增强保护胰腺及远处脏器功能。
综上所述,奥曲肽联合乌司他丁治疗SAP效果良好,治愈率高,症状缓解快,炎症抑制力强,并能增强机体免疫力,降低并发症发生率,值得在临床推广使用。

