乌司他丁在缺血再灌注损伤中的研究进展
赵书馨,张雄,苏晨林,李霁,于锋(中国药科大学基础医学与临床药学学院,南京 211198)
组织短暂缺血,恢复血液灌注后,组织损伤不仅没有得到有效的缓解甚至进一步加重的现象,称为缺血再灌注损伤[1]。缺血再灌注损伤几乎发生在每个器官中,自从1960年心肌缺血再灌注损伤的定义被提及之后,陆续发现了在脑、肾、肺、肠道等器官中的缺血再灌注损伤[2]。缺血再灌注损伤涉及局部和全身作用的病理生理机制,主要是通过两个阶段发展:在局部缺血期间,主要发生的是缺氧损伤,能量的消耗,由于能量缺乏直接或间接地导致细胞内某些状态的改变,例如细胞离子稳态紊乱、水解酶激活和细胞膜通透性增加等。随后在再灌注过程中,主要发生炎症因子的释放和细胞凋亡等生理反应[3]。近年来研究发现,缺血再灌注损伤涉及多种生物学过程,主要由自由基产生的增加,细胞内钙离子(Ca2+)超载和炎症因子的过度激活等原因造成[4]。
丝氨酸蛋白酶抑制剂是蛋白酶家族的重要成员,主要参与蛋白的合成和降解过程,并且参与炎症和肿瘤的抑制等。抑肽酶、rhKD/APP、乌司他丁等丝氨酸蛋白酶抑制剂具有保护器官缺血再灌注损伤的能力[5]。尤其是近几年对于乌司他丁在缺血再灌注损伤中的研究更为深入,已证实其在心脏、肾脏和肺等器官的缺血再灌注损伤中具有良好的保护作用。器官的缺血再灌注损伤有望成为乌司他丁新的临床适应证。
乌司他丁由143 个氨基酸残基组成,相对分子量约为67 000,其序列包括两个Kunitz 型结构域,在血浆中主要以中间α-抑制剂和前α-抑制剂两种前体形式存在[6]。中间α-抑制剂和前α-抑制剂的主要合成部位是肝脏,在肾脏、胰腺、肠和胃中虽然也会产生,但浓度要低得多[7]。乌司他丁作为广谱蛋白水解酶,可在体内外抑制多种丝氨酸蛋白酶[8]。临床治疗方面,乌司他丁已被广泛用于治疗急性胰腺炎、败血性休克、器官衰竭等疾病。乌司他丁通过抑制炎症反应、抗氧化应激、抗凋亡、调节酶活性、抗血液凝固等来预防和治疗疾病[9]。本文针对乌司他丁通过不同的信号通路缓解不同器官的缺血再灌注进行系统性的汇总分析,以期望为临床用药提供参考。
1 乌司他丁与缺血再灌注损伤
1.1 乌司他丁与肺缺血再灌注损伤
肺移植等手术和术后环境中常常伴随着肺缺血再灌注损伤的发生,急性肺损伤、肺部切除和创伤性休克也可以诱发肺缺血再灌注损伤形成[10]。肺缺血再灌注损伤的主要原因之一是氧自由基过剩,而其根本原因是氧化和抗氧化系统的不平衡致使大量活性氧和脂质过氧化物产生的增加。实验研究表明,与肺缺血再灌注损伤模型组相比,乌司他丁(1.2×104U·kg-1)能够通过调节丙二醛(MDA)的表达来缓解氧化损伤,进而对肺组织起到保护作用[11]。此外,乌司他丁(1×104U·kg-1)能显著降低肿瘤坏死因子-α(TNF-α),白介素-6(IL-6)的表达[12],表明其通过抑制炎症因子的释放,保护肺组织免受缺血再灌注的损伤。另有研究表明,乌司他丁(1×104U·kg-1)能通过抑制p38 丝裂原活化蛋白激酶(MAPK)缓解肺缺血再灌注损伤,使肺血气屏障的通透性降低,肺部组织形态和显微结构明显好转,相应的肺部检测指标也得到了改善[13]。用于肺移植的肺保存液中的成分被认为是在缺血期间使肺损伤最小化的关键,合理保存肺器官从而降低肺组织缺血再灌注损伤的发展也是近几年来探索的热点[14]。研究表明,往保存液中的添加乌司他丁能够缓解肺缺血再灌注损伤的发生,实验对兔子进行原位肺缺血再灌注损伤的造模处理,使用乌司他丁处理的保存液中用于肺保护,肺部组织的髓过氧化物酶(MPO)、MDA 水平明显降低,且实验兔血清中TNF-α水平降低,炎症因子的释放和中性粒细胞的迁移得到了有效的抑制[15]。以上研究表明,乌司他丁在肺缺血再灌注损伤中能够通过降低氧化损伤,抑制炎症反应发挥保护作用。
1.2 乌司他丁与肝脏缺血再灌注损伤
造成肝脏缺血再灌注损伤的原因有很多,如钙稳态失衡,产生过量的活性氧(ROS)和线粒体功能出现障碍等[16]。乌司他丁对于肝脏缺血再灌注损伤的保护目前已有较多的研究。有研究发现,在乳酸林格保存液中补充乌司他丁(1×103U·mL-1)可有效降低肝酶释放,其机制是通过增加抗凋亡基因B 淋巴细胞瘤-2 基因(Bcl-2),降低促凋亡基因半胱氨酸蛋白酶-3(Caspase-3)和BAX(Bcl-2 assaciated X protein)的表达来发挥保护作用,乌司他丁可使肝脏免受肝脏缺血再灌注损伤的影响,且呈现剂量依赖性,并能显著延长肝移植中肝供体的存活时间[17]。自噬的发生通常是由于蛋白质和细胞器的过度降解继而引发细胞死亡[18]。与常见的缺血再灌注损伤保护机制不同,乌司他丁通过激活张氏肝细胞的自噬功能,进而起到保护作用。实验通过对张氏肝细胞进行缺氧复氧处理,发现乌司他丁在体外以剂量依赖形式抑制缺氧复氧损伤,同时抑制细胞凋亡和诱导自噬,上调丝氨酸/苏氨酸蛋白激酶(ULK1)、自噬蛋白1 和微管相关蛋白1 轻链3(LC-3)的表达;然而,一旦自噬被抑制,缺氧复氧损伤将会加重。表明乌司他丁诱导的缺氧复氧损伤细胞自噬是保护性代偿反应[19]。
乌司他丁除单独用于肝脏缺血再灌注损伤治疗,也常与其他药物联用来治疗该疾病,有研究表明乌司他丁联合粉防己碱、维拉帕米等药物可以对肝脏缺血再灌注损伤起到较好的保护作用,且联合用药的作用效果较单用更好[20-21]。以上研究说明,乌司他丁单独及联合用药具有治疗肝脏缺血再灌注损伤的作用。
1.3 乌司他丁与脑缺血再灌注损伤
大脑是最容易缺氧的器官,脑组织的缺血再灌注会加剧神经细胞坏死和脑组织水肿。细胞内Ca2+超载、自由基产生、兴奋性氨基酸毒性和炎症反应与脑缺血再灌注损伤密切相关,以上因素都可能引发细胞凋亡和坏死,进而导致疾病的发生[22]。Toll 样受体4(TLR4)介导的核因子-κB(NF-κB)参与触发中枢神经系统疾病的炎症反应[23]。乌司他丁(3×103U/100 g)治疗后脑水肿和梗死体积显著减少,并抑制TLR4 和NF-κB 的表达,说明乌司他丁可以通过抑制TLR4/NF-κB信号通路来发挥稳定有效的神经保护作用[24]。此外,乌司他丁(3×105U·kg-1)可以重新激活Nrf2/血红素加氧酶1(HO-1)的表达;从分子途径可发现,Nrf2 抑制剂的治疗可阻断乌司他丁对氧化应激、细胞凋亡和炎症的抑制作用,更加深入地论证了乌司他丁对于氧化应激的治疗作用;另外,高表达的ROS、MDA 也被显著抑制[25]。然而,乌司他丁对缺血再灌注损伤的改善并不能归因于单一的分子途径,其还可以通过抑制凋亡相关信号通路的表达,进而缓解缺血再灌注损伤诱导的细胞凋亡。实验研究表明,对沙鼠进行缺血诱导后,乌司他丁的治疗能抑制海马神经元细胞的凋亡,从而改善缺血诱导的短期记忆障碍[26]。另外,乌司他丁还可以下调脑组织c-Jun氨基末端激酶(JNK)的表达,抑制细胞凋亡,这与抑制JNK 的传导路径有关[27]。
基质金属蛋白酶-9(MMP-9)作为MMPs 的主要成员之一,其过表达可诱导血脑屏障被破坏,进而导致脑缺血恶化。脑缺血再灌注损伤会激活MMPs 水平,特别表现为MMP-9 水平升高[28]。研究发现乌司他丁(3×103U/100 g)可以显著地逆转缺血再灌注损伤诱导的MMP-9 的过度表达,减轻紧密连接蛋白-1 和occludin 的降解,表明乌司他丁可促进缺血性脑组织中血脑屏障完整性的恢复[29]。研究发现,脑缺血再灌注模型组大鼠通过伊文思蓝(EB)染色呈现明显可见的蓝色,再灌注6 h 可发现EB 含量显著升高,并且在24 h 达到峰值;给予乌司他丁后脑组织中EB 染色面积明显减小,说明乌司他丁显著降低了大鼠脑缺血再灌注损伤中血脑屏障的通透性[30]。综上,乌司他丁可以通过抑制细胞凋亡、降低炎症反应、减轻氧化应激以及改善血脑屏障的通透性来发挥脑缺血再灌注损伤的保护作用。
1.4 乌司他丁与心肌缺血再灌注损伤
心肌缺血再灌注损伤是由再灌注治疗导致的急性心肌梗死。与其他类型的缺血再灌注损伤类似,氧自由基的损伤、炎症因子的活化释放及细胞凋亡损伤等机制皆会导致心肌缺血再灌注损伤的发生[31]。研究表明,ERK 信号传导途径在心肌缺血再灌注引起的损伤中表现出保护性作用,其主要机制包括激活抗凋亡信号传导途径和抑制促凋亡信号传导途径。乌司他丁(2.5×103U·kg-1)通过降低炎症因子的表达,激活p-ERK 的表达并抑制心肌细胞凋亡,从而有效地缓解心肌缺血再灌注损伤[32]。同为MAPK 家族的p38/JNK,在乌司他丁治疗心肌缺血再灌注损伤中也起着重要的作用。乌司他丁(1×104U·kg-1)可通过下调p38 和JNK 导致凋亡细胞数量减少,进而提高Bcl-2 水平,并且使Bax和caspase-3 水平下降[33]。因此,上述途径的下调可能有助于抑制心肌缺血再灌注损伤中细胞的凋亡。另有实验结果证明乌司他丁改善了区域缺血再灌注损伤后的心功能和降低梗死面积大小可能是通过抑制MPO 活性和降低TNF-α的表达有关[34]。自噬在心肌缺血再灌注损伤中也较为重要。乌司他丁的预处理可以使小鼠心肌梗死面积减少,LC3-Ⅱ蛋白表达降低,此外,乌司他丁(1×104U·kg-1)上调了p-Akt、p-mTOR 和p-P70S6K 蛋白表达。进一步研究发现,与模型组相比,在乌司他丁治疗前30 min使用mTOR 抑制剂雷帕霉素处理细胞,可使细胞活力增加,乳酸脱氢酶表达降低[35]。由此可以发现乌司他丁通过mTOR 激活调节自噬,对心肌缺血再灌注损伤发挥保护作用。
1.5 乌司他丁与肾脏缺血再灌注损伤
肾脏缺血再灌注损伤通常会引起急性肾损伤、肾衰竭等多种肾脏相关疾病,因此治疗肾脏缺血再灌注损伤是减少肾脏疾病的重要举措。在肾脏缺血再灌注损伤期间,乌司他丁可以显著降低尿素氮和肌酐水平,且TNF-α、IL-6 mRNA 表达降低等[36]。细胞黏附分子的活化,可以通过激活多种信号传导途径来启动加剧细胞炎症的发生[37]。研究发现,缺血再灌注损伤大鼠基础肾脏功能损伤指标皆有所上升,且对体内细胞间黏附分子-1(ICAM-1)表达的检测能够发现,随着对大鼠再灌注时间的延长,ICAM-1 表达也逐渐增加。证明了ICAM-1 在肾缺血再灌注损伤中至关重要,乌司他丁(1.25×104U·kg-1)可显著抑制缺血再灌注损伤后各个阶段ICAM-1 表达的升高,对肾缺血再灌注损伤有一定程度的保护作用[38-39]。实验监测造模组和给药组大鼠体内ATP,细胞内pH(pHi)和细胞内钠(Nai)的动态变化,发现造模组的pHi 值呈现出严重的酸中毒,给予乌司他丁(5×104U·kg-1)后能较快地恢复ATP 的供应,且Nai 的恢复比对照组更早[40]。另外,观察肾小管超微结构发现,乌司他丁给药后能显著减轻线粒体膜和嵴的肿胀程度,且跨细胞钠梯度得以恢复[41],表明乌司他丁可能在缺血期间保护线粒体构象,并促进再灌注后离子泵的功能恢复。研究通过对缺血再灌注期间肾皮质和髓质组织氧分压的测定来验证乌司他丁是否对肾脏缺血再灌注有保护作用,结果表明与对照组相比,乌司他丁低剂量组和高剂量组的值完全恢复到缺血前的值,且各组之间的心肺参数没有差异[42]。说明乌司他丁改善了再灌注后的肾脏氧合而没有改变心肺参数,从而起到对肾脏的保护作用。因此,乌司他丁能够对肾脏缺血再灌注损伤起到保护作用,但其确切机制还需要进一步的论证。
2 总结与展望
缺血再灌注损伤作为严重的生理疾病,其发病机制较为复杂。乌司他丁能够通过多种调控途径治疗器官的缺血再灌注损伤,总结如表1所示。
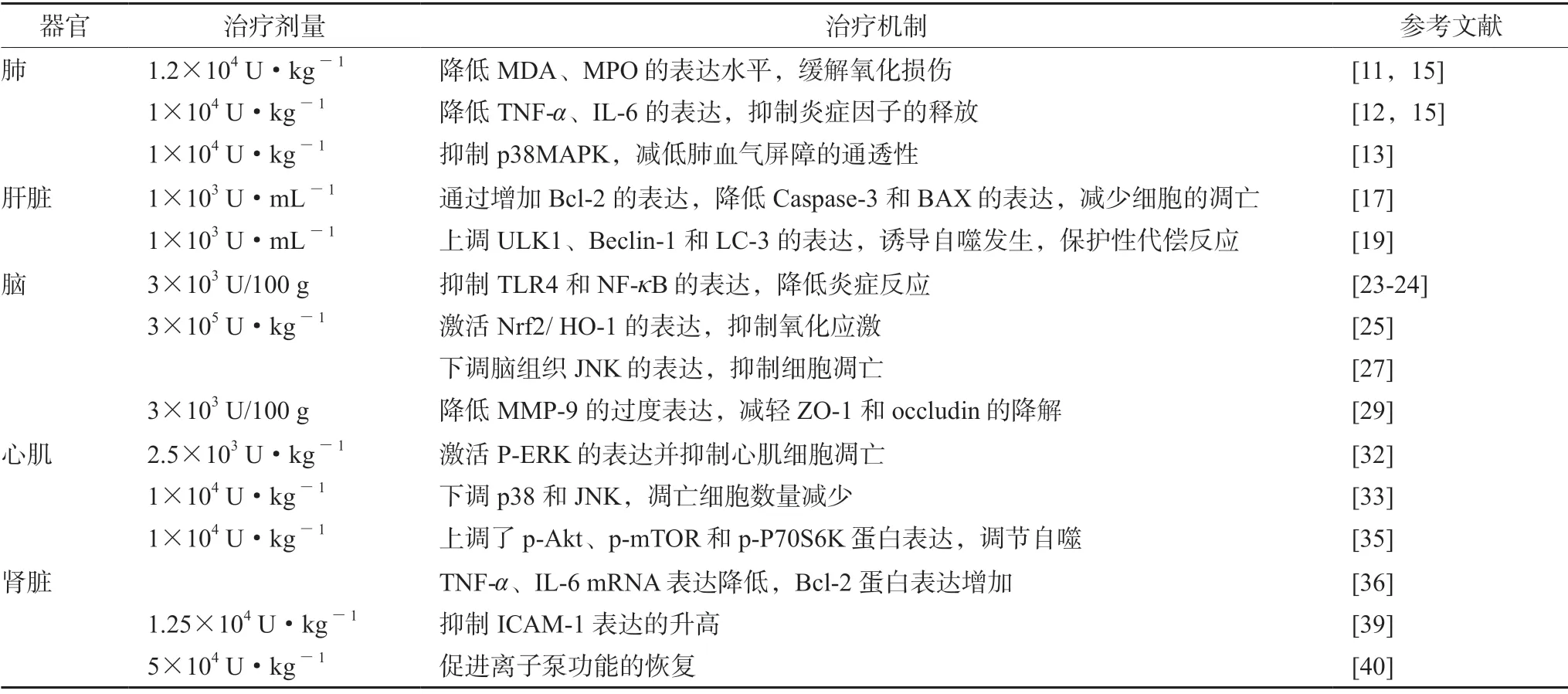
表1 乌司他丁治疗器官缺血再灌注损伤的剂量及调控机制汇总Tab 1 Dose and regulation mechanism of ulinastatin for organ ischemia-reperfusion injury
根据目前的研究可知,TNF-α和IL-6 等促炎细胞因子水平升高导致缺血再灌注损伤的产生,MAPK和NF-κB 等分子信号通路介导了缺血再灌注损伤过程中的炎症和氧化应激,细胞的凋亡和自噬的发生在缺血再灌注损伤中亦较为常见。乌司他丁通过降低TNF-α、IL-6、IL-1β等细胞因子而抑制炎症反应。在减轻炎症的信号通路机制方面,乌司他丁通过抑制TLR4、NF-κB、HMGB1 等分子通路发挥保护作用。另外,乌司他丁通过上调Bcl-2、下调caspase 和Bax 抑制缺血再灌注损伤后的细胞凋亡,下调p38 和JNK 信号通路的表达发挥保护作用。本文系统性地汇总了乌司他丁对于缺血再灌注损伤的不同保护机制,如抑制炎症反应,降低氧化应激,抑制细胞的凋亡等。每一种作用机制都可以通过多个信号通路来介导,形成一个巨大的药理学机制网络。在基础实验研究中,我们发现不同剂量下乌司他丁对器官缺血再灌注损伤的作用机制不同,这对临床中不同器官的损伤治疗提供了剂量的参考,用药时应酌情考虑剂量因素的影响。另外,研究也多涉及乌司他丁的联合用药对于缺血再灌注损伤的治疗,这为缺血再灌注损伤提供了新的治疗思路。尽管目前乌司他丁对器官缺血再灌注损伤的研究已经有了一定的进展,但仍存在一些问题需进一步的思考和解决。从目前的研究资料来看,乌司他丁对于肾、肺等器官的研究尚不深入,相关机制研究较少。而且,目前大部分研究仍处于动物实验阶段,临床研究较为缺乏。另外,已有研究表明丝氨酸蛋白酶抑制剂可以通过抑制中性粒细胞释放出来的丝氨酸蛋白酶来降低炎症反应,而乌司他丁作为丝氨酸蛋白酶抑制剂,通过维持酶的平衡来缓解缺血再灌注损伤的报道较为缺乏,这也为以后乌司他丁更为深入的研究提供了思路和方向。因此,乌司他丁对缺血再灌注损伤的治疗保护的机制研究还有很长的路要走,需要更多科学严谨的实验来进一步探索和证明。然而,不可否认的是,乌司他丁是一种非常有前景的药物,有望在器官缺血再灌注损伤的临床治疗方面发挥重大作用。