槲皮素通过抑制TGF-β/TAK1/JNK和TGF-β/Smad2信号通路发挥抗肝纤维化的作用
王绍展,王媛媛,顾妍秋,陈春,李胜男,王蓉,原永芳(上海交通大学医学院附属第九人民医院药剂科,上海 201999)
肝纤维化是各种慢性刺激或病因所致肝组织中细胞外基质(ECM)的过度增生和沉积,是一种可逆性的肝损伤修复反应,继续发展可导致肝硬化甚至肝癌。大量研究表明,肝星状细胞的活化是肝纤维化发生的中心环节[1-2],在促纤维化因子作用下,激活的肝星状细胞急剧增殖并分泌大量ECM,胶原纤维的合成和分解失衡,导致肝组织ECM 过度沉积。目前尚无美国食品药品监督管理局(FDA)批准的特效的抗肝纤维化的化学或生物药物进入临床应用。槲皮素是一种黄酮类化合物(结构式见图1),广泛存在于蔬菜、水果、茶等植物的花、叶、果实中,具有抗氧化、抗炎、免疫调节、抑制新生血管生成等作用[3]。研究证实槲皮素对多种实验性肝纤维化模型具有很好的保护作用[4-7],对其抗肝纤维化作用机制NF-κB/IκBα、Wnt 等信号传导通路方面进行了有益的探讨[4-8],但仍然不够全面。研究发现TGF-β介导的TGF-β/Smad 通路和非Smad依赖通路(如TGF-β/TAK1/JNK 信号传导通路)在肝星状细胞的活化、增殖以及胶原合成的过程中发挥了非常重要的调控作用[9-12]。为探讨槲皮素抗纤维化的作用机制与TGF-β/TAK1/JNK 和TGF-β/Smad2 信号通路之间的关联,本研究构建了二甲基亚硝胺(DMN)诱导大鼠肝纤维化模型和TGF-β诱导HSC-T6 细胞活化模型,从体内和体外两个方面,着重考察槲皮素对TGF-β/TAK1/JNK 和TGF-β/Smad2 信号通路的影响。

图1 槲皮素的结构式Fig 1 Chemical structure of quercetin
1 材料
槲皮素(CAS:117-39-5,上海诗丹德生物技术有限公司,纯度≥98%),DMN(Sigma),TAK1、Phospho-TAK1、JNK、Phospho-SAPK/JNK(美国Cell signaling Technology),Smad2、Phospho-Smad2 单克隆抗体、α-平滑肌肌动蛋白(α-SMA)(美国Santa Cruz Biotechnology),转化生长因子β1(TGF-β1)(美国R&D Systems),免疫组化试剂盒(武汉博士德生物工程有限公司),大鼠肝功能检测试剂盒(南京建成生物工程研究所),血清肝纤维化指标检测试剂盒(郑州安图生物工程股份有限公司)。引物序列由上海生工工程技术服务有限公司合成;其他主要试剂均购自碧云天生物技术公司。
全自动生化分析仪(美国Beckman LX-2);Nanodrop 2000 分光光度计(Thermo Fisher Scientific);LightCycler 480仪器(Hoffman-La Roche);奥德赛红外探测及图像成像分析系统(LI-COR Biotechnology,Nebraska)。
SPF 级雄性SD 大鼠40 只[6 周龄,180 ~220 g,上海西普尔-必凯实验动物有限公司,许可证号:SCXK(沪) 2013-0016],饲养条件为标准动物实验室:温度25℃,湿度(55±10)%,12 h/12 h 明暗循环,给予标准的食物和水。
2 方法
2.1 大鼠分组及给药
SPF 级雄性SD 大鼠40 只适应性饲养2 周后,将大鼠随机分为正常组,DMN 模型组,槲皮素12.5 mg·kg-1组、25 mg·kg-1组和50 mg·kg-1组,每组8 只。除正常组腹腔注射相同剂量生理盐水外,其余大鼠均腹腔注射1% DMN(10 mg·kg-1),每周3 次(每周前3日每日一次,连续注射3 次,后4日不给予注射),共4 周[13]。造模第3 周开始灌胃给予槲皮素治疗,每日一次,治疗2 周。在第4 周结束时,再次称量大鼠体质量(空腹),并用5%水合氯醛麻醉,然后,从腹主动脉快速获取新鲜血液样本,3000 r·min-1、4℃离心10 min,-80℃下储存。所有肝脏样本获取后迅速称重,部分用4%多聚甲醛固定,进行组织病理学和免疫组化检测。剩余的肝脏样本液氮速冻后,在-80℃下冷冻保存。
2.2 肝功能、肝纤维化指标检测
采用全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)。采用肝纤维化系列检测试剂盒测定透明质酸(HA)、血清Ⅲ型前胶原氨基末端前肽(PⅢNP)、Ⅳ型胶原(Ⅳ-C)和层粘连蛋白(LN)的水平。采用羟脯氨酸检测试剂盒检测肝组织中羟脯氨酸的含量。
2.3 肝脏组织病理学观察和免疫组化检测
将4%多聚甲醛固定24 h 的肝组织标本,经脱水,石蜡包埋后,制成5 μm 厚的切片,再经脱蜡冲洗,用苏木精伊红(HE)染色、天狼星红(Sirius)和Masson 三色染色方法进行切片染色,光学显微镜下观察肝脏病理情况和胶原沉积的变化,并用Image pro-Plus 6.0 软件计算肝组织中的胶原形成面积(胶原形成面积=阳性染色面积/总面积×100%)。用抗α-SMA、p-TAK1、p-JNK、Smad2 的抗体进行免疫组化染色,黄色或棕褐色染色显示阳性信号,根据阳性染色的程度和位置进行评估[14]。
2.4 肝组织mRNA 定量PCR 检测
按QIAGEN 总RNA 提取试剂盒说明书,称取约30 mg 肝组织,用TRIzol 试剂均质离心提取mRNA,Nanodrop 2000 分光光度计测定浓度。按照TaKaRa 逆转录及PCR 试剂盒说明书,在LightCycler 480 仪器上进行逆转录合成cDNA 并扩增。以β-actin为内参,用2-ΔΔCT公式对目的基因进行定量分析。引物序列及扩增产物长度如表1所示。

表1 mRNA 扩增的基因引物序列Tab 1 Geneprimer sequences for mRNA amplification
2.5 MTT 法检测槲皮素对HSC-T6 细胞增殖的影响
对数生长期HSC-T6 细胞消化离心后,用10%血清的DMEM 培养基调成5×104个·mL-1的混悬液接种于96 孔板中,每孔100 μL,使细胞数为5000 个/孔,将细胞分为正常组、槲皮素6 个质量浓度梯度(2.5、5、10、20、40、80 μmol·L-1),每组3 个复孔,置于37℃、5%CO2培养箱培养24 h。待细胞贴壁后,正常对照组加100 μL 培养基,其余各组加相应的药物100 μL,继续培养24 h 后,每孔加入10 μL MTT 溶液(5 mg·mL-1),4 h 后弃去上清液,加入150 μL DMSO,振荡10 min,用酶标仪在490 nm 处测各孔吸光度值(OD),将正常对照组的细胞活性设为100%,计算槲皮素各浓度处理组细胞活性,细胞活性(%)=(实验组平均OD值/对照组平均OD值)×100%。
2.6 定量PCR 检测HSC-T6 细胞活化相关基因转录情况
对数生长期HSC-T6 细胞消化离心后,用无血清的DMEM 培养基调成5×104个·mL-1混悬液,接种于6 孔板中,每孔2 mL,置于37℃、5%CO2培养箱培养过夜;将细胞分为正常组、TGF-β1(2 ng·mL-1)组、TGF-β1+槲皮素(10、20、40 μmol·L-1)处理组;在TGF-β1 和槲皮素共同处理24 h 后,提取总RNA,按照TaKaRa 逆转录及PCR 试剂盒说明书,在LightCycler 480 仪器上进行逆转录合成cDNA 并扩增。以β-actin 为内参,用2-ΔΔCT公式对目的基因(α-SMA、CollagenⅠ、MMP-I、TIMP-1)进行定量分析。
2.7 Western blot 法检测 HSC-T6 蛋白表达
取对数生长期 HSC-T6 细胞,按“2.6”项下方法处理并分组。槲皮素预处理24 h 后,加入TGF-β1 刺激30 min;提取总蛋白,BCA 试剂盒测定蛋白浓度,加入5×上样缓冲液,沸水浴变性15 min,取30 μg 蛋白上样,待SDS-PAGE电泳分离后,转移至PVDF 膜,用5% BSA 溶液4 ℃封闭3 h,加入一抗(1∶1000),4 ℃过夜;TBST 洗涤3 次,5 min/次,加入二抗(驴抗鼠Alexa Fluor 546 IgG 或驴抗兔Alexa Fluor 488 IgG),室温孵育2 h。采用奥德赛红外探测及图像成像分析系统进行检测,以GAPDH 为内参,计算目的条带的灰度值[15]。
2.8 统计分析
使用SPSS 21.0 对数据进行分析,数据以平均值±标准差(SD)表示,统计分析方法采用单因素方差分析,P<0.05 表示差异具有统计学意义。
3 结果
3.1 槲皮素对DMN 诱导的大鼠肝脏总体形态及肝质量的影响
DMN 造模期间大鼠体质量增长情况如图2A所示,与正常组相比,DMN 模型组大鼠体质量增长显著下降(P<0.05),而槲皮素各给药组的体质量增长情况好于DMN 模型组,尤其是25 和50 mg·kg-1治疗组(P<0.05)。造模结束时各组大鼠体质量如图2B 所示,DMN 模型组大鼠体质量显著低于正常组(P<0.05);而同模型组相比,槲皮素25 和50 mg·kg-1治疗组能剂量依赖性地提高大鼠体质量(P<0.05)。
图2B 显示,DMN 模型组大鼠的肝质量同正常组相比亦显著下降(P<0.05),而槲皮素25和50 mg·kg-1治疗组大鼠的肝质量显著高于模型组(P<0.05),其中槲皮素50 mg·kg-1组的治疗效果最优(P<0.05)。

图2 大鼠体质量和肝质量Fig 2 Body mass and liver mass
3.2 肝功能及血清肝纤维化的影响
槲皮素对肝功能指标TBIL、ALT 和AST 的影响如图3A 所示。与正常组相比,DMN 模型组的ALT、AST 和TBIL 水平显著升高(P<0.05)。与模型组相比,槲皮素组TBIL、AST 和ALT 的水平显著降低(P<0.05),且呈剂量依赖性,说明槲皮素能显著改善DMN 诱导的大鼠肝功能。
血清肝纤维化指标HA、PⅢNP、Ⅳ-C 和LN的水平如图3B 所示。DMN 模型组这四项指标明显高于正常组(P<0.05),说明DMN 造模后,肝组织中胶原合成增加,发生了显著的肝损伤和肝纤维化。而槲皮素各给药组与模型组比较,四项指标含量均下降(P<0.05),50 mg·kg-1下调效果最显著(P<0.05),25 mg·kg-1的治疗效果也优于12.5 mg·kg-1(P<0.05)。
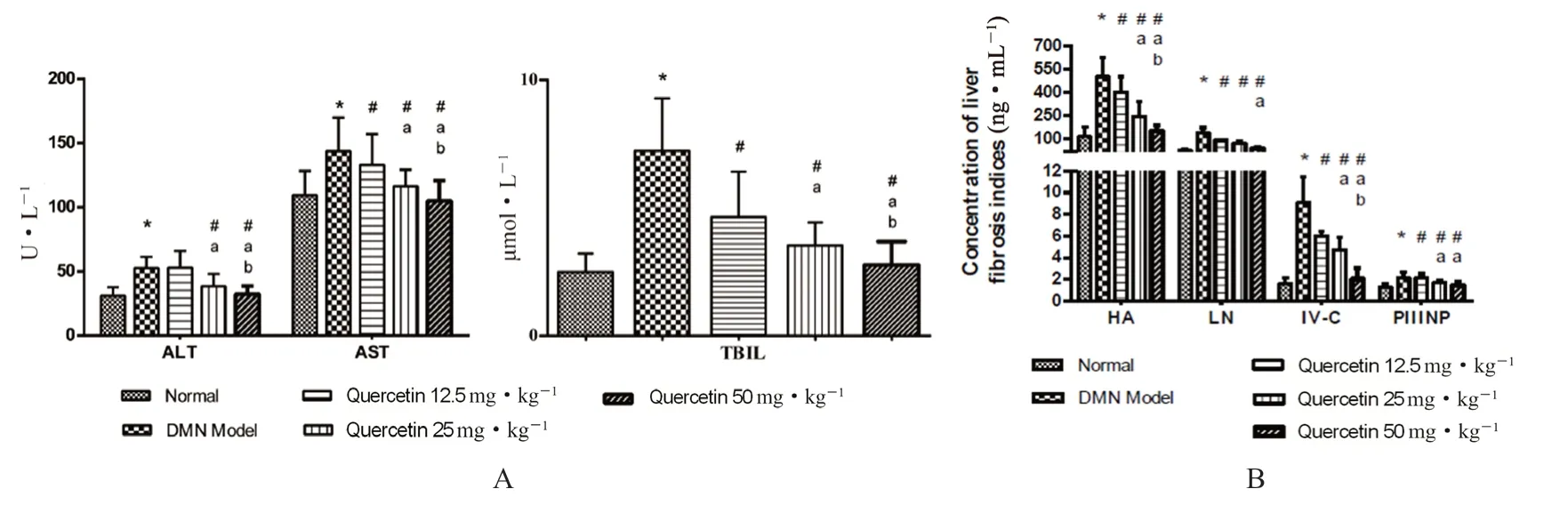
图3 槲皮素对大鼠肝功能(A)及血清肝纤维化(B)的影响Fig 3 Effect of quercetin on the liver function (A) and serum hepatic fibrosis (B)in rats
上述结果表明,槲皮素可有效减轻DMN诱导的大鼠肝损伤和肝纤维化,在12.5 ~50 mg·kg-1给药剂量内,随着给药剂量增加,治疗效果逐步提升。
3.3 槲皮素对DMN 诱导的大鼠肝脏组织病理学变化的影响
采用HE 染色观察肝组织病理变化,采用Sirius 和Masson 染色观察胶原沉积的情况,结果如图4A 所示。从图中可见,正常组肝组织中,肝细胞围绕中央静脉呈放射状整齐排列,肝小叶结构完整,没有变性或坏死的肝细胞以及其他病理特征。DMN 模型组肝细胞周围紊乱,胶原明显沉积,形成宽窄不一的纤维间隔,包绕、分割肝小叶,小叶结构紊乱,汇管区扩大,小叶内出现坏死,出现大量炎性细胞浸润。槲皮素各给药组能不同程度地改善肝组织损伤,减少胶原生成,降低肝小叶被破坏的程度,尤其在50 mg·kg-1组,肝脏病变和炎性细胞浸润明显减少。
如图4B 所示,与正常组相比,DMN 模型组胶原面积急剧扩大,羟脯氨酸含量显著升高(P<0.05),槲皮素25 和50 mg·kg-1治疗2周后,能显著抑制胶原的生成,降低羟脯氨酸的含量,且50 mg·kg-1的槲皮素治疗效果优于25 mg·kg-1(P<0.05)。

图4 槲皮素对DMN 诱导大鼠肝组织的病理学变化及胶原合成的影响Fig 4 Effect of quercetin on the pathological changes and collagen synthesis of liver tissues in rats induced by DMN
3.4 槲皮素对纤维化肝组织中纤维化相关基因转录水平的影响
采用Real-time PCR 检测肝组织中星状细胞活化相关基因(α-SMA、E-cadherin、Snail),胶原合成相关基因(CollagenⅠ和CollagenⅢ),以及胶原降解相关基因(TIMP-1和MMP-1)的mRNA水平,结果如图5所示。与正常组相比,DMN模型组大鼠肝组织中α-SMA、Snail、CollagenⅠ、CollagenⅢ和TIMP-1的mRNA 水平显著升高(P<0.05), 而MMP-1和E-cadherin的mRNA水平显著下调(P<0.05);与DMN 模型组相比,槲皮素给药组能显著上调MMP-1和E-cadherin的mRNA 水平,并显著抑制α-SMA、Snail、CollagenⅠ、CollagenⅢ和TIMP-1 的mRNA 水平,且效果呈剂量依赖性,50 mg·kg-1效果最显著(P<0.05)。

图5 槲皮素抑制DMN 诱导大鼠肝组织的纤维化相关基因转录Fig 5 Quercetin inhibits the transcription of fibrosis related genes in rat liver induced by DMN
3.5 槲皮素对纤维化肝组织中α-SMA、p-TAK1、p-JNK、Smad2 蛋白表达的影响
免疫组织化学检测结果如图6所示。与正常组相比,DMN 模型组大鼠肝组织中α-SMA、p-TAK1、p-JNK、Smad2 蛋白表达水平明显升高;槲皮素各给药组肝组织中这些蛋白表达显著降低,并且槲皮素25 和50 mg·kg-1组降低较明显。
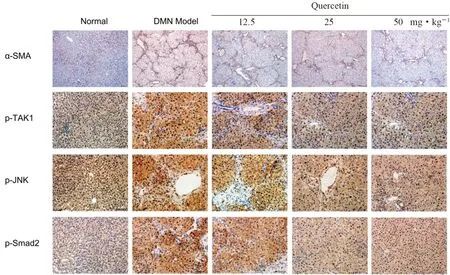
图6 槲皮素对DMN 诱导的纤维化肝组织表达纤维化相关蛋白的调控作用Fig 6 Effect of quercetin on the expression of fibrosis related proteins in DMN induced fibrotic liver tissues
3.6 槲皮素对肝星状细胞HSC-T6 增殖活性的影响
通过MTT 法检测槲皮素对HSC-T6 细胞增殖活性的影响,结果如图7所示。低于10 μmol·L-1的槲皮素处理24 h,对HSC-T6 细胞的增殖基本没有影响;当槲皮素浓度升至20 μmol·L-1时,显示出一定的抑制作用,细胞活性为84.07%(P<0.05);随着浓度继续上升,槲皮素对HSC-T6 细胞的增殖抑制作用越来越强,当浓度达到80 μmol·L-1时,细胞活性为70.5%(P<0.01)。

图7 槲皮素对HSC-T6 细胞增殖活性的抑制作用Fig 7 Inhibitory effect of quercetin on the proliferation of HSC-T6 cells
3.7 槲皮素对TGF-β1 刺激下HSC-T6 细胞肝纤维化相关基因转录水平的影响
通过Real-time PCR 评估槲皮素对HSC 活化标志物α-SMA基因,胶原合成与降解相关基因(CollagenⅠ、MMP-1、TIMP-1)的转录水平的影响,如图8所示。与正常组比较,TGF-β1(2 ng·mL-1)刺激24 h,除MMP-1降低外,α-SMA、CollagenⅠ、TIMP-1的mRNA 水平均显著升高(P<0.05);与TGF-β1 刺激组相比,槲皮素(10 ~40 μmol·L-1)处理24 h,能剂量依赖性地抑制这些基因的转录变化(P<0.05)。

图8 槲皮素对HSC-T6 细胞肝纤维化相关基因mRNA 水平的影响Fig 8 Effect of quercetin on the mRNA levels of fibrosis-related factors in HSC-T6 cells
3.8 槲皮素对TGF-β/TAK1/JNK 和TGF-β/Smad2信号传导通路相关蛋白表达水平的影响
采用Western blot 法检测TGF-β/TAK1/JNK 和TGF-β/Smad2 信号传导通路相关蛋白在HSC-T6 细胞中的变化情况,结果如图9所示。与正常组相比,TGF-β1(2 ng·mL-1)刺激30 min,能显著地升高p-TAK1、p-JNK 和p-Smad2 水平(P<0.05);槲皮素(20、40 μmol·L-1)预处理24 h 能剂量依赖性地下调p-TAK1、p-JNK 和p-Smad2水平(P<0.05)。

图9 槲皮素对HSC-T6 细胞TGF-β/TAK1/JNK 和TGF-β/Smad2 信号通路的调控作用Fig 9 Regulation of quercetin on TGF-β/TAK1/JNK and TGF-β/Smad2 signal pathways in HSC-T6 cells
4 讨论
肝纤维化是各种慢性肝损伤因素诱发的肝组织损伤修复反应,是各种慢性肝病向肝硬化进展的共同病理过程,由于肝纤维化具有可逆性特点,因此防治肝纤维化对于防治肝硬化具有重要的临床意义[16]。
DMN 诱导的大鼠肝纤维化模型,是常用的实验性肝纤维化动物模型[13,15]。本研究中发现槲皮素治疗2 周,能剂量依赖性地下调DMN 诱导肝纤维化大鼠血清ALT、AST 和TBIL 水平,改善大鼠肝功能;同时有效抑制血清肝纤维化指标上升,降低肝组织中羟脯氨酸的含量;对肝组织切片进行HE、Sirius 和Masson 染色,结果同样表明槲皮素可以有效抑制胶原生成,保护肝小叶的正常结构。这些结果说明槲皮素能有效缓解DMN诱导的大鼠肝损伤,降低胶原的沉积,阻遏肝纤维化的进程。
肝星状细胞的活化并大量合成胶原蛋白是肝纤维化发生发展的中心环节[17]。活化的星状细胞其特征性表现为:高表达α-SMA、Snail和TIMP-1[18-20],低表达E-cadherin和MMP-1[21-22],并且大量合成Ⅰ、Ⅲ型胶原等[23]。本研究结果发现,槲皮素能剂量依赖性地下调肝星状细胞中α-SMA、Snail、TIMP-1以及CollagenⅠ、CollagenⅢ的mRNA 水平,同时上调E-cadherin和MMP-1的mRNA 水平。这表明槲皮素能有效抑制肝星状细胞的活化及合成胶原蛋白。
肝星状细胞的活化机制与TGF-β介导的信号通路密切相关[24]。TGF-β首先在细胞表面与TGF-βⅡ型受体(TβRⅡ)结合后,募集并激活TGF-βⅠ型受体(TβRⅠ);活化的TβRⅠ进而招募并磷酸化激活受体Smad2 和Smad3;然后激活的p-Smad2/3 与胞浆中的共同通路型 Smad4形成异源复合体,转入胞核,调控肝星状细胞活化相关靶基因的转录,此为典型的TGF-β信号通路[25-26]。同样活化的TβRⅠ也可以激活非Smad 依赖的TAK1/JNK 信号传导通路。TAKl 属于MAPKKK 家族成员,活化后可以通过激活MAPKK4/7 而磷酸化JNK(p-JNK)[27];JNK 是MAPK 家族的成员,活化的JNK(p-JNK)进一步激活其底物(包括c-Jun、ATF2、Elk1、p53、NFAT4 等),从而调控肝星状细胞的活化和增殖,参与肝纤维化形成[28]。本研究发现槲皮素能显著下调DMN 诱导肝纤维化模型大鼠肝组织中p-TAK1、p-JNK 以及Smad2 的水平;能剂量依赖性地下调p-TAK1、p-JNK 和p-Smad2 水平。这些结果充分说明,槲皮素能通过抑制TGF-β/Smad和TGF-β/TAK1/JNK 信号通路活化,从而抑制星状细胞活化。
综上,本研究证实槲皮素具有显著的抗DMN诱导大鼠肝纤维化作用,通过抑制TGF-β/Smad和TGF-β/TAK1/JNK 信号通路的激活与传导,来抑制肝星状细胞的活化和增殖,最终逆转肝纤维化进程。