CLIC4对胃癌细胞SGC-7901增殖与迁移的影响
李 瑶,冯 成,程晓敏,李 超,耿慧武,刘晓颖,王 华
中国是胃癌发病率和病死率较高的国家之一,亟需更有效的生物标志物或药物靶标。CLIC4作为胞内氯离子通道(chloride intracellular channel, CLICs)蛋白家族成员之一,在某些肿瘤类型和基质细胞中异常高表达,且其定位和功能的改变,在肿瘤发生发展中发挥重要作用。有研究表明,子宫平滑肌瘤、神经胶质瘤和黑色素瘤等肿瘤形成过程中CLIC4的表达显著上调;而人原发性肺癌和肺癌细胞系中CLIC4的表达减少,表明其抑制肺癌细胞生长;siRNA介导的CLIC4下调促进小鼠肝癌Hca-F和Hca-P细胞的凋亡。目前CLIC4对胃癌作用的研究鲜有报道,该研究从胃癌细胞系SGC-7901着手,研究CLIC4对细胞增殖与迁移的影响,为进一步探索CLIC4在胃癌恶性进展中的作用提供重要线索。
1 材料与方法
1.1 主要试剂与仪器
1.1.1
主要试剂 胎牛血清购于以色列Biological Industries公司;RPMI-1640和Opti-MEM培养基购于美国GE公司;胰酶细胞消化液、青霉素-链霉素混合液、Western细胞裂解液、苯甲基磺酰氟(PMSF)、Western一抗稀释液购于上海碧云天生物技术有限公司;Lipofectamine RNAi MAX试剂购于美国Thermo-Fisher公司;PVDF膜购于加拿大Bio Basic公司;β-actin、CLIC4、E-cadherin、N-cadherin、Vimentin、β-catenin抗体购于武汉Proteintech公司;辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记兔抗山羊IgG、DAB显色试剂盒购于北京中杉金桥生物技术有限公司。1.1.2
主要仪器 CO恒温培养箱(VIOS 160i,美国 Thermo-Fischer公司);BSC-2级生物安全柜(1300,美国Thermo-Fischer公司);倒置光学显微镜(TS-100,日本株式会社尼康);高速冷冻离心机(Microfuge 20R,美国Beckman Coulter公司);恒压电泳仪(PowerPacBasic,美国BIO-RAD公司)。1.1.3
shRNA和siRNA CLIC4 shRNA、siRNA和阴性对照shRNA、siRNA合成于上海吉玛生物科技有限公司,序列为见表1、2。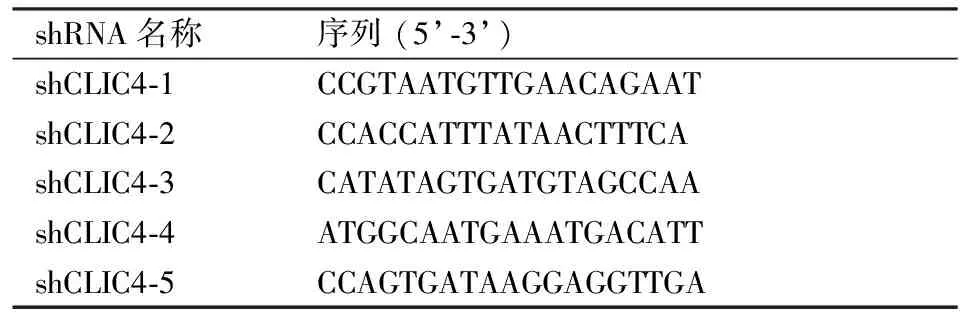
表1 shRNA序列
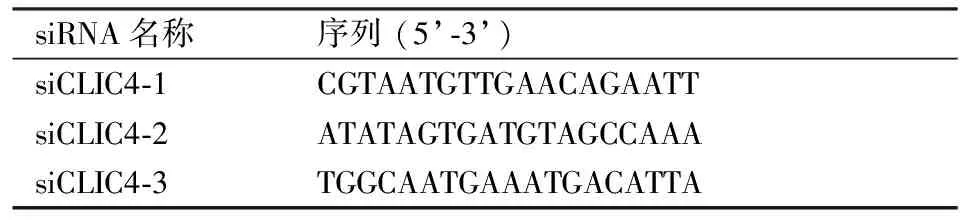
表2 siRNA序列
1.1.4
质粒、细胞株 慢病毒包装所用pLKO.1、REV、GAG、VSVG质粒由中国科学技术大学吴缅教授课题组惠赠;HEK 293T、GES-1、 SGC-7901、BGC-823、MGC-803、MKN-45、N87、AEG-1细胞为本实验室保存;其中GES-1,为正常腺上皮细胞,作为对照组,SGC-7901、BGC-823、MGC-803、MKN-45、N87、AEG-1均为胃癌细胞系。1.2 实验方法
1.2.1
细胞培养和传代 HEK 293T细胞系使用DMEM高糖培养基;GES-1、SGC-7901、BGC-823、MGC-803、MKN-45、N87和AEG-1细胞系使用RPMI-1640培养基,置于37 ℃、5 % CO、95 %湿度的培养箱中分别培养,细胞培养所用器具均经高压蒸汽灭菌;培养的细胞每1~2 d换液1次,显微镜下观察细胞密度和细胞状态,当细胞密度大于90 %时可进行传代,使用胰酶对目的细胞进行消化,以培养基终止消化反应并计数,接种适量细胞悬液到培养瓶中,于37 ℃恒温培养箱中继续培养。1.2.2
慢病毒包装 以1.5×10个/孔的数量接种HEK 293T细胞于6孔板;次日观察细胞贴壁生长至70%~80%后,使用Lipofectamine2000将混合质粒转染至细胞中;转染时质粒所用的比例为pLKO.1(或含相应shRNA的质粒):GAG∶REV∶VSVG(后3者在细胞内共同形成慢病毒)=2∶2∶2∶1;在转染6~8 h后更换新鲜的无抗生素培养基;在转染30 h后收集培养液上清液中的病毒以进行后续实验。1.2.3
shRNA敲低实验 感染前1 d,将SGC-7901细胞以2.0×10个/孔接种于6孔板,次日观察贴壁后,加入上述包装得到的病毒悬液和适当的polybrene(终浓度:6~8 μg/ml)以感染SGC-7901;在6 h后换新鲜培养基;在48 h后使用嘌呤霉素筛选阳性细胞,并收集细胞进行验证。1.2.4
siRNA敲低实验 转染前1 d,将待转染细胞以1.5×10个/孔的数量接种于6孔板;次日观察贴壁后,使用Lipofectamine RNAi MAX转染siRNA;转染6 h后更换新鲜培养液。1.2.5
细胞总蛋白提取 收集细胞沉淀,加入适当体积的细胞裂解液,冰上裂解30 min左右,每5 min涡旋1次;4 ℃,14 000 r/min离心25 min,将上清液转移至新的EP管中,Bradford法测蛋白浓度。1.2.6
Western blot实验 各取30 μg总蛋白样品,于金属浴上100 ℃加热8~10 min变性,SDS-PAGE电泳分离目的蛋白,转移蛋白于PVDF膜;5 %脱脂牛奶于室温封闭1.5 h,TBST洗膜3次,每次10 min;一抗孵育4 ℃过夜,TBST洗膜3次;室温孵育二抗1.5 h,TBST洗膜3次;ECL显影。使用Image J软件进行条带的吸光度分析,并以β-actin为内参计算CLIC4的相对表达水平。
2 结果
2.1 CLIC4在胃癌细胞系中的表达
Western blot检测胃癌细胞系中CLIC4的表达情况。结果显示,与对照组(GES-1)相比,胃癌细胞系中CLIC4均高表达。对条带的灰度值进行测定,以β-actin作为内参,进行半定量分析,对3次重复实验的结果进行汇总,同时以GES-1组的数据为基准,制作胃癌细胞系中CLIC4蛋白相对含量的直方图(见图1)。与对照组相比,胃癌细胞系中CLIC4高表达,且差异有统计学意义,见表3。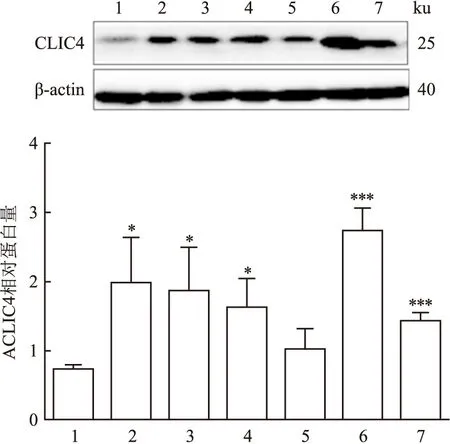
图1 Western blot检测胃癌细胞系中CLIC4的表达
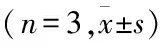
表3 各组中CLIC4的统计结果
2.2 CLIC4敲低对SGC-7901的细胞增殖的影响
为了进一步研究CLIC4在胃癌发生发展过程中发挥的生物学作用,使用CLIC4 shRNA慢病毒感染胃癌细胞SGC-7901,并通过嘌呤霉素筛选及Western blot验证目的蛋白的表达,构建CLIC4敲低的稳转细胞株,同时使用空白慢病毒载体pLKO.1(NC)做阴性对照。结果如图2所示,与NC相比,各shRNA组的CLIC4表达量均降低,选择1、2和3序列进行后续研究;经三代验证,SGC-7901稳定低表达CLIC4的细胞株构建成功(图2)。为避免嘌呤霉素药筛对细胞凋亡检测的影响,同时使用CLIC4 siRNA转染SGC-7901,转染72 h后收集细胞沉淀,进行Western blot验证。结果显示,与NC相比,CLIC4的两条siRNA序列均有敲低效果。在确认了siRNA及shRNA对CLIC4的敲低效果后,利用克隆形成实验以及CCK-8实验检测CLIC4敲低对胃癌细胞SGC-7901增殖的影响,结果见图3。克隆形成实验结果表明,与NC组相比,SGC-7901 细胞中CLIC4 sh1、2和3三条敲低序列的克隆数差异无统计学意义,且CCK-8结果进一步验证,CLIC4敲低对胃癌细胞的增殖没有影响。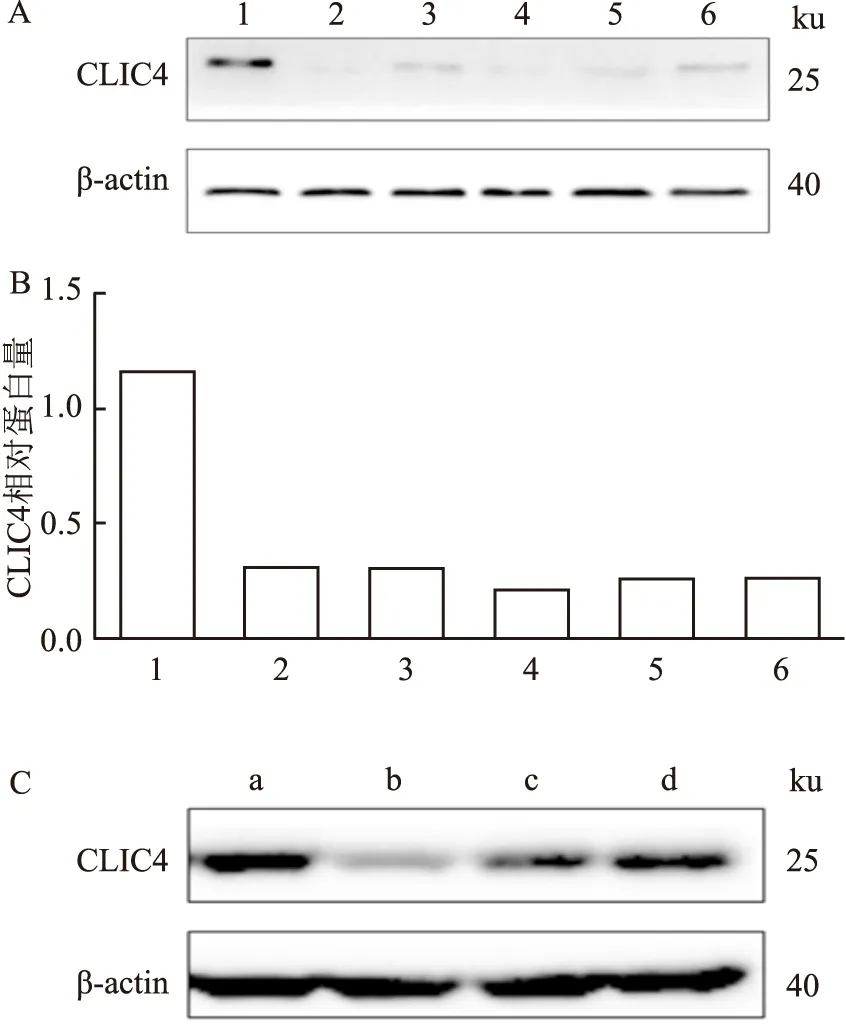
图2 Western blot检测SGC-7901细胞中CLIC4敲低效果
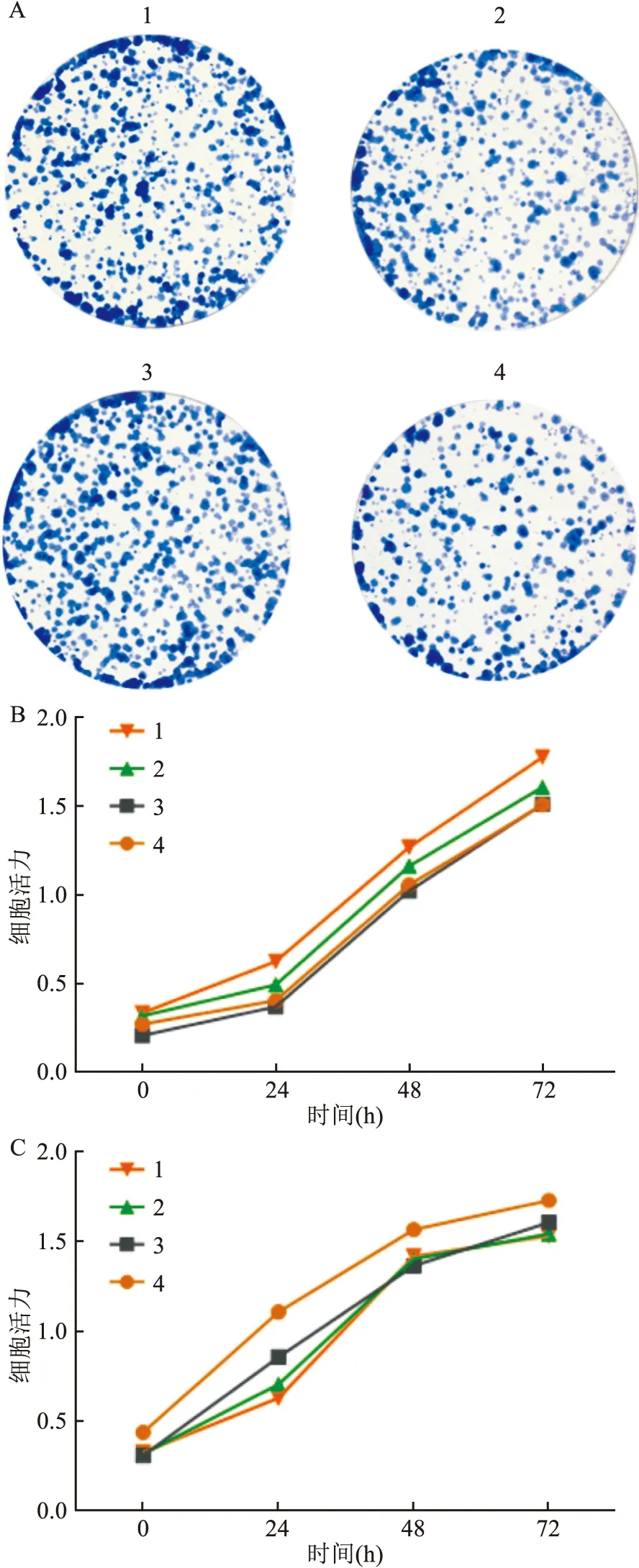
图3 CLIC4敲低后SGC-7901细胞的增殖情况
2.3 CLIC4敲低对SGC-7901细胞的上皮-间质转化EMT(epithelial-mesenchymal transition, EMT)的影响
为了探究CLIC4敲低对胃癌细胞迁移的影响,利用Western blot检测EMT相关蛋白的表达。结果显示,与NC相比,在SGC-7901细胞CLIC4 shRNA的1和2序列组中,E-钙黏蛋白(E-cadherin)的表达水平增加,β-连环蛋白(β-catenin)和N-钙黏蛋白(N-cadherin)的表达无明显变化,波形蛋白(Vimentin)表达减少(图4)。该结果表明CLIC4敲低后,细胞上皮表型增强,间质表型减弱,说明细胞发生了EMT,相应的EMT过程受到抑制,结果见表4、5。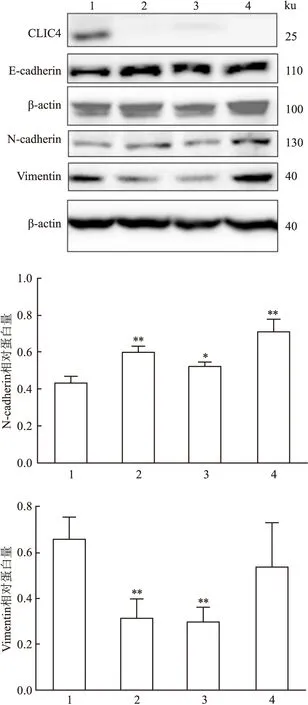
图4 Western blot检测SGC-7901细胞中CLIC4
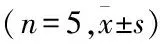
表4 各组中N-cadherin的统计结果
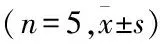
表5 各组中vimentin的统计结果
3 讨论
CLICs家族成员具有不同功能,可参与调节肿瘤细胞的增殖、迁移及其对非肿瘤组织的侵袭。特别是CLIC4,可以靶向肿瘤细胞而不影响正常细胞的生理功能,具有成为肿瘤治疗新靶点的潜能。
CLIC4在细胞中定位于细胞膜、线粒体内膜,高尔基体和内质网。在特定组织中表达水平高,在一些肿瘤中过表达。细胞质中的CLIC4响应p53、DNA损伤和代谢应激而入核,使细胞生长停滞或凋亡。CLIC4表达水平和核易位在细胞应激/凋亡信号转导中起重要作用。还有研究表明,肿瘤中的CLIC4的细胞定位可能发生改变。
有研究表明,CLIC4参与调节多种肿瘤细胞的增殖、迁移与侵袭。结直肠癌肿瘤干细胞中高表达CLIC4,特别是转移能力强的肿瘤转移干细胞(metastatic cancer stem cell, MCSC)与转移能力弱的结肠癌细胞相比,CLIC4的表达水平更高,提示CLIC4参与调节结直肠癌MCSC的分化及其侵袭、转移行为。CLIC1和CLIC4沉默时,可以抑制默克尔细胞多瘤病毒小肿瘤抗原(MCPyVST)诱导的运动性和侵袭性,抑制默克尔细胞癌的进展。Suh et al利用CLIC4反义mRNA抑制CLIC4的表达,结果发现CLIC4下调促进肿瘤细胞凋亡,抑制肿瘤细胞增殖,在体外和体内抑制人骨肉瘤细胞的生长。且CLIC4调节肿瘤间质成纤维细胞转化为肌成纤维细胞,并且与肿瘤的进展有关,提示CLIC4还通过调节肿瘤微环境促进肿瘤的侵袭和转移。
本研究通过构建CLIC4稳定低表达胃癌细胞株,探究CLIC4在胃癌中的生物学功能。结果表明,CLIC4在胃癌细胞系中均高表达,不影响胃癌细胞SGC-7901的增殖。EMT是促进肿瘤侵袭、迁移的主要机制之一,E-cadherin、N-cadherin和Vimentin等是EMT的重要标志物,当E-cadherin的表达下降,N-cadherin和Vimentin表达增高时,肿瘤细胞骨架系统排列发生变化,细胞生物学性状改变,黏附功能下降,脱离原发灶,向周围组织侵袭和迁移。CLIC4敲低后E-cadherin的蛋白表达水平增加,Vimentin蛋白表达减少,从而抑制SGC-7901细胞的迁移,但具体分子机制仍需进一步探讨。
但也有研究表明,不同细胞类型CLIC4对其增殖的作用及机制也不同,如小鼠和人皮肤鳞状细胞癌中,过表达CLIC4抑制肿瘤生长并且促进TGF-β信号传导。在肺癌细胞中,敲除CLIC4促进细胞增殖与克隆形成能力。且CLIC4可能对同一肿瘤类型的不同分化程度也具有不同的作用。Wang et al的研究结果显示,在高分化胃癌细胞系NCI-N87中敲除CLIC4后,促进了EMT进而促进细胞迁移,细胞在裸鼠中成瘤能力增强;在低分化细胞系MKN-45中过表达CLIC4后,EMT被抑制,细胞干性表型减弱,细胞增殖被抑制。而本研究结果显示,在中分化的胃癌细胞系SGC-7901中敲低CLIC4后,细胞增殖无显著性变化,EMT被抑制,细胞迁移减弱。由此可以推测,在癌症的不同进程阶段,CLIC4可能发挥着不同的作用,也需要进一步的临床样本进行分析和验证。
综上所述,在胃癌细胞SGC-7901中,CLIC4通过促进胃癌细胞的迁移发挥促癌作用,但不影响其增殖。该研究为进一步探索CLIC4在胃癌恶性进展中的作用提供了重要线索,CLIC4可能作为临床上治疗胃癌的潜在靶点。

