GASP-1基因干扰对非小细胞肺癌细胞恶性侵袭和上皮间质转化以及微管形成的影响
韩贵良,石 岩,焦 婷,贾友超,任冠颖
肺癌是当前世界上造成癌症相关死亡的重要原因,非小细胞肺癌(non-small cell lung carcinoma,NSCLC)为肺癌中的一大类。NSCLC是一种异质性肿瘤,约占全世界所有肺癌病例的85%。当前,手术切除仍是治愈的最有效的选择。尽管如此,在诊断时仍有近70%的患者发展为局部晚期或转移性疾病。因此,有必要寻找新的治疗策略和药物。G蛋白偶联受体相关分选蛋白1(G-protein coupled receptor-associated sorting protein 1,GASP-1),主要在肿瘤上皮和脑肿瘤转化的胶质细胞中表达。研究发现脑癌、肝癌、乳腺癌和肺癌患者血清中GASP-1的表达比正常健康人的多4~7倍。类似研究将GASP-1鉴定为潜在的几种癌症血清和肿瘤生物标志物,并推测GASP-1可能是癌症治疗药物开发的新靶标。但是GASP-1在肺癌中的研究鲜有报道。该文研究了GASP-1基因干扰对NSCLC细胞侵袭和上皮间质转化(epithelial-mesenchymal transition,EMT)以及微管形成的影响,希望能为NSCLC的治疗提供新策略。
1 材料与方法
1.1 材料
肺癌A549细胞购自中国科学院的细胞库,并用含10%胎牛血清的Dulbecco改良的Eagle培养基(Dulbecco's Modified Eagle Medium,DMEM)于37 ℃进行培养生长。将sh-RNA及其相应的阴性对照克隆到pGPU6 / Neo质粒(上海GenePharma公司)中以靶向GASP-1。将前期筛选的GASP-1-shRNA1用于后续试验。GASP-1抗体购自美国Abcam公司;TRIzol、RT-PCR试剂盒及SYBRGreen RT-PCR试剂盒购自日本TaKaRa公司;RPMI-1640培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;E-cadherin、N-cadherin、vimentin和GAPDH抗体及二抗来自美国CST 公司。1.2 方法
1.2.1
慢病毒感染 肺癌细胞以5×10个/孔接种6孔板,置培养箱内培养至融合度为40%时,以MOI=20分别添加慢病毒,再加入适量的polybrene (终浓度为5 mg/L);12 h后添加新鲜培养液;培养72 h后荧光显微镜下观察荧光表达情况,以1 mg/L的嘌呤霉素筛选稳定转染的细胞系。细胞分组:对照组不感染慢病毒的细胞;shRNA组感染阴性对照慢病毒;GASP-1-shRNA1组感染重组慢病毒的细胞。1.2.2
Western blot实验 3组待测细胞分别用PBS洗涤2次,再加入含有PMSF的RIPA裂解溶液,于冰上孵育30 min。以BCA法测定蛋白样品浓度,每孔30 μg蛋白样品,设置120 V的电压电泳2 h后从玻璃板中间取出凝胶。将PVDF膜置于新配置的含体积分数0.05牛血清蛋白溶液中,在室温结合2 h。把E-cadherin、N-cadherin、Fibronectin和VEGF一抗按1∶800倍稀释,PVDF膜置于一抗反应液中孵育过夜。再将二抗按1∶2 000倍稀释后,把PVDF膜置于二抗反应液内孵育2 h。使用ECL发光。采用Image J分析内参Actin和目标条带的灰度值,目标条带蛋白水平=目标条带的灰度值/Actin的灰度值。每组实验重复3次,每次设3个复孔。1.2.3
Transwell检测细胞侵袭 3组细胞以不含血清的培养液悬浮,细胞密度调整为7×10/ml,分别添加到Transwell小室的上室内进行侵袭实验。每组添加200 μl细胞悬浮液,下室内添加500 μl的含血清培养液。24 h后,将小室取出,把没有穿膜的细胞擦掉并以PBS洗涤后,分别添加多聚甲醛溶液固定30 min,添加0.1%结晶紫染色后,在光镜下选取5个视野,计数细胞侵袭数目。每组实验重复3次,每次设3个复孔。1.2.4
GASP-1诱导细胞上皮间质化 3组细胞连续48 h在倒置显微镜下观察细胞形态的动态变化至发现细胞由原有上皮细胞的鹅卵石状变为梭形并继续变细长,部分细胞可见轴突样结构,完全演变为间质细胞形态,提示细胞发生了上皮间质化。1.2.5
细胞划痕实验 感染后各组A549细胞以3×10个/孔接种到6孔板中,放置在37 ℃培养箱继续培养,待细胞生长汇合达90%以上时,将培养液更换成低浓度(0.5%)胎牛血清的培养液,使用划痕仪对细胞进行划痕,以PBS洗涤划掉的细胞,加入0.5%胎牛血清的培养液,放置在37 ℃培养箱继续培养24 h,分别在划痕0、24 h观察细胞划痕宽度,计算细胞迁移率=(0 h划痕宽度-24 h划痕宽度)/ 0 h划痕宽度×100%。实验重复3次,取均值。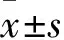
2 结果
2.1 GASP-1基因沉默对A549细胞侵袭的影响
Transwell实验结果显示,与对照组相比,shRNA组侵袭细胞数目无明显变化,GASP-1-shRNA1组侵袭细胞数目减少(F
=13.13,P
<0.05)。见图1。2.2 GASP-1基因沉默对A549细胞迁移的影响
划痕实验结果如图2所示,与对照组相比,shRNA组细胞迁移率无明显变化,GASP-1-shRNA1组细胞迁移率降低(F
=54.17,P
<0.05)。2.3 GASP-1基因沉默对A549细胞EMT的影响
EMT情况如图3A所示,与对照组相比,shRNA组细胞无明显变化,GASP-1-shRNA1组细胞EMT现象被抑制。Western blot检测了EMT标志物E-cadherin、N-cadherin和Fibronectin的蛋白表达。检测结果如图3B、C所示,与对照组比较,shRNA组细胞中E-cadherin、N-cadherin和Fibronectin的蛋白表达水平无明显变化,GASP-1-shRNA1组细胞中E-cadherin蛋白表达水平上升,而N-cadherin和Fibronectin的蛋白表达水平下降,差异均有统计学意义(F
=95.40,P
<0.05;F
=24.82,P
<0.05;F
=6.67,P
<0.05)。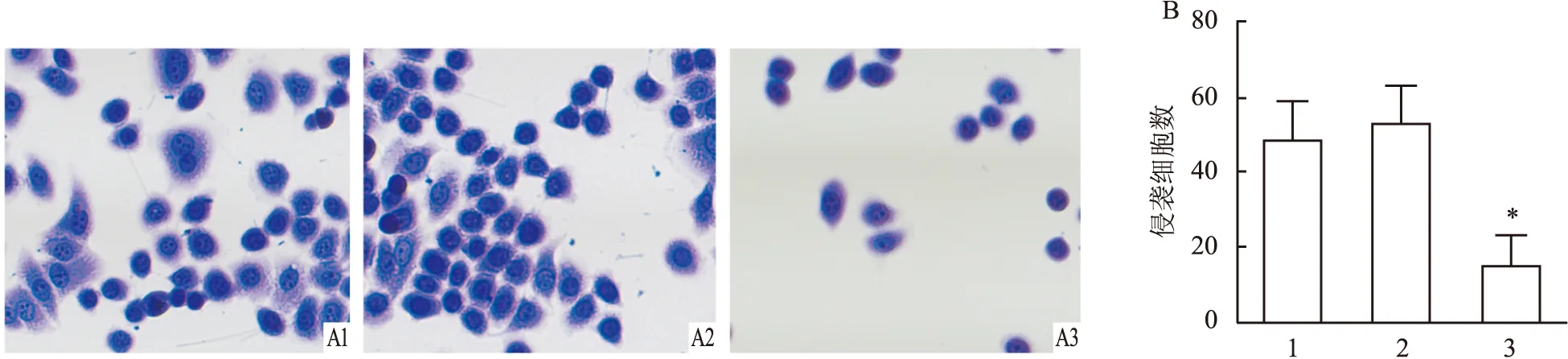
图1 不同处理组细胞侵袭实验结果
图2 不同处理组细胞迁移实验结果
2.4 GASP-1基因沉默对A549细胞微管形成的影响
微管形成实验结果如图4A、B所示,与对照组相比,shRNA组细胞中微管结节数目变化不明显,GASP-1-shRNA1组细胞中微管结节数目减少,差异有统计学意义(F
=16.33,P
<0.05)。Western blot检测结果显示(如图4C、D),与对照组相比,shRNA组细胞中VEGF蛋白表达水平无变化,GASP-1-shRNA1组细胞中VEGF蛋白表达水平降低,差异有统计学意义(F
=32.43,P
<0.05)。3 讨论
随着工业化发展和城市现代化的进程加快,环境污染和空气污染影响日益显著,肺癌已经成为严重威胁人类生命健康的常见恶性肿瘤。当前常用的治疗手段以切除、放射和化疗为主,但由于这些手段的局限性,生物疗法成为医学工作者研究的热点。研究发现miR-30a-5p与miR-210-3p结合可区分癌组织与非癌组织,因而成为NSCLC潜在的诊断性生物标志物。程宇 等发现PEDF可抑制肺癌细胞增殖和转移,因此PEDF可成为治疗肺癌的新途径。GASP-1存在于人体的许多组织中,并且在多种癌症组织(乳腺癌、胰腺癌)中的含量比正常组织增加了约10倍,而在乳腺癌和肺癌患者的血清中的含量高于正常人约4~7倍, 被作为癌症诊断生物标志物。本文前期研究显示GASP-1基因的下调能抑制肺癌细胞增殖并促进细胞凋亡,抑制肿瘤形成。为进一步研究GASP-1基因干扰在肺癌治疗中的潜在可能,本文研究了GASP-1基因干扰对NSCLC细胞恶性侵袭、EMT及微管形成的影响。
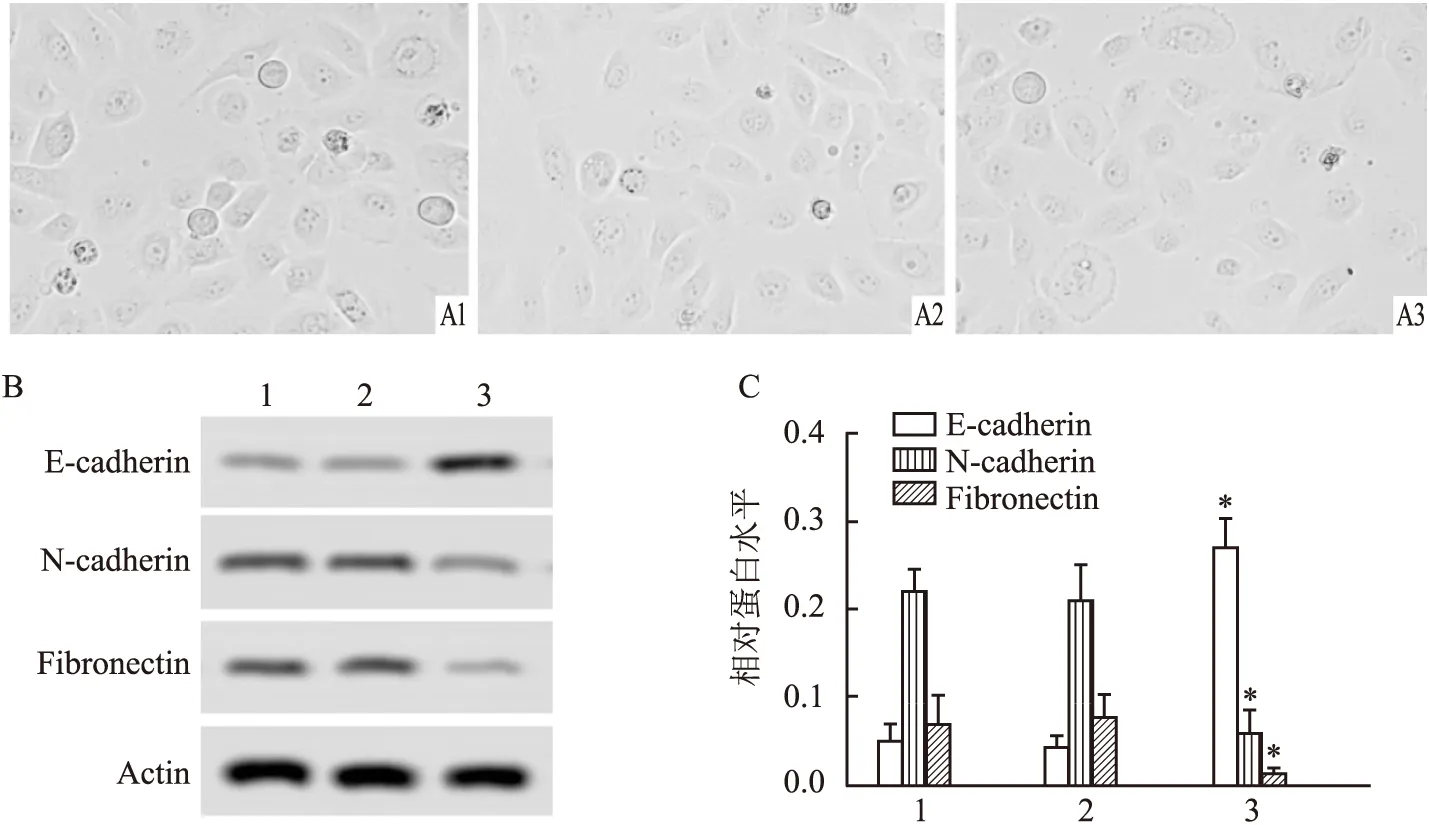
图3 不同处理组细胞EMT情况
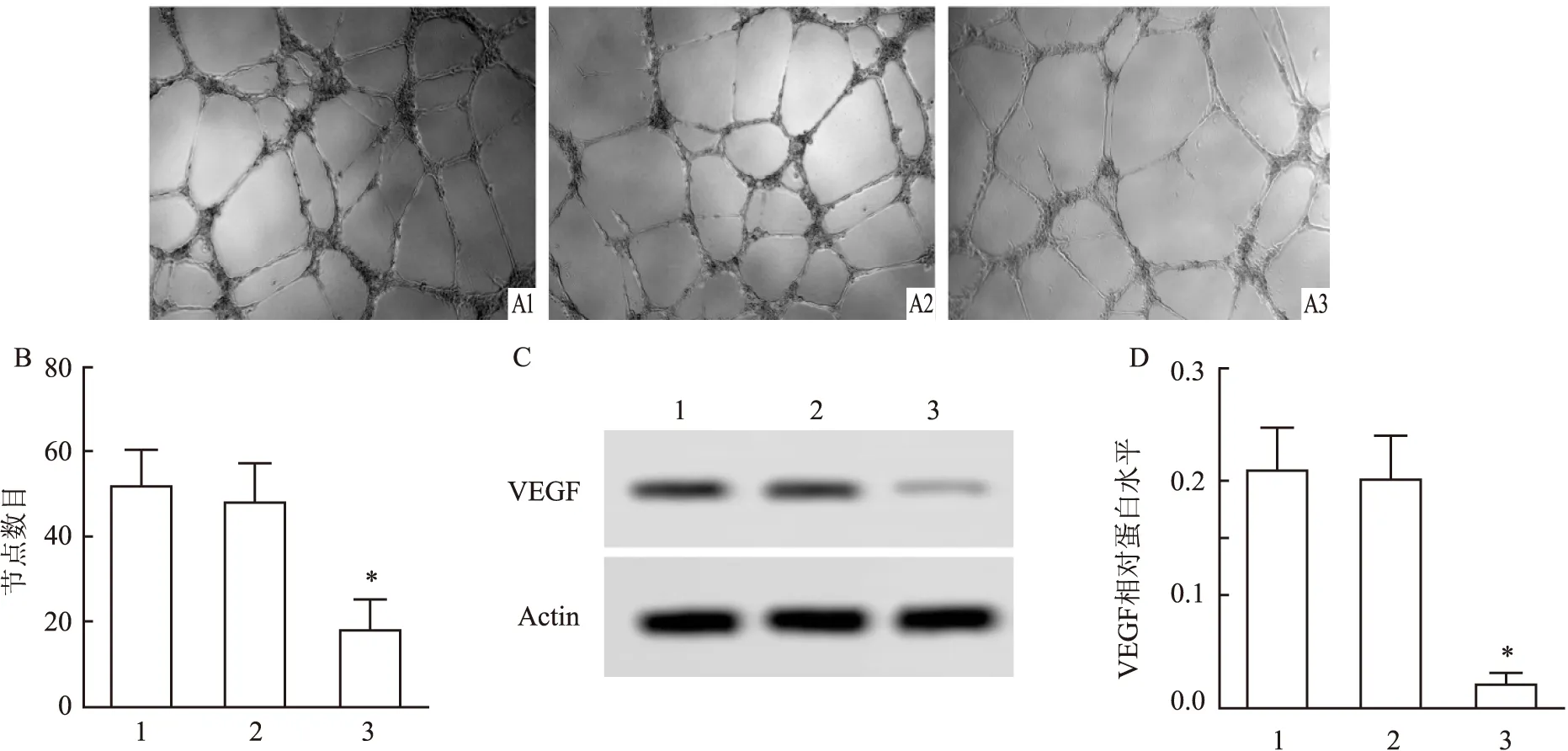
图4 不同处理组细胞微管形成情况
本研究显示,G蛋白偶联受体(G protein-coupled receptors,GPCRs)参与多种生理过程,其下游信号靶点在癌症的生长和发展中起着重要的作用。GASP-1是常见的与GPCRs相互作用的蛋白。Tuszynski et al发现乳腺患者血清中存在GASP-1,而正常人群血清中则没有,并且GASP-1可调节神经细胞中各种GPCRs的溶酶体分选和功能。将GASP-1鉴定为潜在的乳腺癌新血清和肿瘤生物标志物,并表明GASP-1可能是乳腺癌治疗药物开发的新靶标。
研究发现下调肿瘤标志物是癌症预防和治疗的一条有力途径。Zhou et al研究表明肺癌患者血清miR-520f表达下调,并且miR-520f与肺癌TNM stage和肺癌转移有显著相关性,被作为肺癌早期诊断生物标志物。在本研究中,Transwell实验结果显示,GASP-1-shRNA1组中侵袭细胞数目显著减少,细胞伤口愈合率显著下降。表明沉默GASP-1基因可显著抑制A549细胞侵袭和迁移。
EMT被认为是肿瘤细胞侵袭和转移的关键和初始环节之一,是肿瘤恶化过程中的重要组成部分。在EMT进展过程中,细胞会失去上皮特性,包括细胞黏附和极性,并获得间质形态和迁移能力。从生化角度看,细胞会关闭上皮标志物(如黏附连接蛋白E-cadherin)的表达,并打开包括波形蛋白和纤连蛋白的间质标志物。本研究表明,GASP-1-shRNA1组中细胞EMT现象较对照组有所好转。Western blot检测结果显示GASP-1基因干扰可显著提升细胞中E-cadherin蛋白表达水平并降低N-cadherin和Fibronectin的蛋白表达水平。表明沉默GASP-1基因可显著抑制A549细胞EMT。
血管生成对于癌症的发展和生长至关重要:在肿瘤长到1~2 mm之前,它需要血管来吸收营养和氧气。肿瘤产生的VEGF和其他生长因子导致“血管生成转换”,在肿瘤内和周围形成新的脉管系统,使其呈指数增长。VEGF是高度特异性的促血管内皮生长因子,是癌症中血管生成的关键介质。本研究检测了GASP-1基因干扰对A549细胞微管形成的影响,结果显示,GASP-1基因干扰可显著减少微管结节数目,同时下调VEGF蛋白表达水平。这一结果提示沉默GASP-1基因可抑制A549细胞微管形成。
肺癌是全球公认的恶性肿瘤疾病,因其病症出现晚、治疗难度大、预后结果差等原因成为医学难题。本研究证明GASP-1基因干扰对NSCLC细胞恶性侵袭、EMT及微管形成都有显著的抑制作用,有望为肺癌的治疗提供一定思路。

