肾动脉去交感神经术对大鼠急性心肌梗死后室性心律失常的影响及相关机制的研究
肖蓉雪,郜俊清,汪 谞,刘宗军,
急性心肌梗死(acute myocardial infarction,AMI) 大多是在冠脉病变的基础上,发生冠状动脉急性或持续性缺血缺氧所引起的心肌坏死,可并发心律失常、休克或心力衰竭,严重可危及生命。其中在AMI后发生的持续性室性快速性心律失常引起的心脏猝死占心血管死亡率的50%以上。既往研究表明心肌梗死后,心律失常的发生与交感神经兴奋过度及心肌细胞电生理特性改变密切相关。肾动脉去交感神经消融术(renal denervation,RDN)是近年来一种通过降低交感神经活性,抑制肾素血管紧张素醛固酮系统(renin angiotensin aldosterone system,RASS)激活治疗难治性高血压的新兴微创介入技术。已有研究证实RDN可减少心脏交感神经活动,并有效抑制房颤的发生,缩短房颤的持续时间。因此,RDN有望通过降低交感神经活性,抑制电重构等途径抑制心律失常的发生。该研究旨在探讨RDN对AMI后室性心律失常的影响,并进一步探究其作用机制。
1 材料与方法
1.1 实验动物
24只清洁型SD雄性大鼠,体重230 g左右,均购于上海斯莱克实验动物有限公司,常规饲养,所有的实验程序均经上海市医学伦理委员会批准。将24只SD大鼠随机分成4组:Control组、AMI组、RDN-1d+AMI组、RDN-2w+AMI组,每组6只,建立模型作相应处理。1.2 RDN手术模型建立
用2.5%的戊巴比妥钠溶液对SD大鼠进行腹腔注射麻醉,麻醉后大鼠平躺,固定于手术台上,备皮,用75%的酒精棉球消毒,于腹部中线做一个手术切口,用盐水浸过的无菌纱布覆盖肠子,分离双侧肾动脉,然后用溶于95%乙醇的10%苯酚溶液的无菌纱条轻轻缠绕双侧肾血管1周,尽量避免苯酚与周围脏器组织接触,1 min后取出纱布。术毕,逐层缝合切口,青霉素连续注射3 d预防感染,按照分组情况进行饲养;1 d和2周后进行心梗造模,处死大鼠后取肾动脉进行病理检测,各组大鼠没有炎症渗出,感染不严重。1.3 AMI模型的建立
对不同分组的SD大鼠用2.5%的戊巴比妥钠溶液进行腹腔注射麻醉,麻醉后将大鼠用橡皮筋固定在手术台上,气管插管成功后连接呼吸机。给大鼠接上电极,采用上海然哲PowerLab多导生理记录仪采集信号,打开心电图采集软件,设置好测量参数,然后在胸骨左侧第3肋间处开胸,显露左冠状动脉前降支,于其中远段1/3交点处进行结扎,心电监护提示ST段持续弓背样抬高,提示心梗造模成功,连续记录1 h后处死,并留取大鼠心脏组织。1.4 组织病理学检测
取出的心脏组织标本,清洗后,一部分用4%的多聚甲醛溶液固定,包埋在石蜡中,用于酪氨酸羟化酶(tyrosine hydroxylase,TH)染色,剩余样本于-80 ℃下保存。1.5 Western blot
提取心肌组织蛋白,通过Western blot检测心肌梗死区各种离子通道Nav1.5、Cav1.2和Kir2.1的蛋白表达水平。1.6 肾脏交感神经活性(renal sympathetic never activity,RSNA)检测
用2.5%的戊巴比妥钠溶液对 SD大鼠进行腹腔注射麻醉,麻醉后将大鼠右侧卧位,备皮,剪开背部皮肤,剪开皮下筋膜组织,用湿棉签钝性分离,暴露出左侧肾血管和腹主动脉,在解剖显微镜下找到左侧肾动脉和肾神经,分离肾交感神经,将游离好的肾交感神经轻放于双极银丝记录电极上,经前置放大器将记录到的放电信号放大1 000倍后,通过美国Tektronix oscilloscope示波器和澳大利亚Pty.Ltd.Castle Hill生物信息采样系统Power Lab/8SP仪器记录信号,并分析。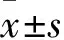
2 结果
2.1 RDN对大鼠AMI后室性心律失常发生的影响
通过PowerLab多导生理记录仪记录模型建立的过程,并观察1 h,结果显示,与AMI组(331.2±74.8)次/h相比,RDN-1d+AMI组[(112±59.2)次/h,F
=0.615,P
<0.001]和RDN-2w+AMI组[(151±87.9)次/h,F
=0.260,P
=0.003]室性心动过速(ventricular tachycardia,VT)发生次数减少,其中RDN-1d组较RDN-2w组减少次数更明显。其中AMI组有1只大鼠发生室颤死亡,其他两组大鼠没有因室颤死亡。2.2 肾脏交感神经活动检测
通过Power Lab/ 8SP仪器检测记录肾交感神经放电信号,与Control组比较,RDN-1d组肾交感神经放电减少(F
=6.989,P
<0.001),差异有统计学意义,与Control组比较,RDN-2w组肾交感神经放电也减少(F
=20.216,P
=0.033),其中RDN-1d组放电减少更明显。见图1。
图1 RDN对肾脏交感神经活动的影响
2.3 RDN对大鼠AMI后心脏神经活性的影响
酪氨酸氢化酶是儿茶酚胺合成的关键酶,分布在肾上腺素能轴突的胞质中,阳性表达可代表心脏局部交感神经的活性。通过TH染色法检测心脏局部交感神经活性,结果显示,AMI组TH阳性表达水平高,RDN-1d组和RDN-2w组TH阳性表达水平低。见图2。2.4 Western blot检测各组大鼠心肌梗死区各离子通道蛋白水平的表达结果
通过Western blot检测离子通道蛋白Nav1.5、Cav1.2和Kir2.1蛋白表达水平,与Control组Nav1.5、Cav1.2和Kir2.1水平对比,AMI组Nav1.5(F
=6.086,P
=0.030)、Cav1.2(F
=3.769,P
=0.011)和Kir2.1(F
=0.324,P
=0.007)水平下调;与AMI组比较,RDN-1d组Nav1.5(F
=3.933,P
=0.136)、Cav1.2(F
=0.144,P
=0.296)和Kir2.1(F
=2.067,P
=0.133)水平有上调趋势,差异无统计学意义。与AMI组比较,RDN-2w组Nav1.5(F
=1.397,P
=0.004)、Cav1.2(F
=6.464,P
=0.027)和Kir2.1(F
=1.093,P
=0.005)水平上调,表明RDN能抑制Nav1.5、Cav1.2和Kir2.1蛋白表达水平的下调,并与RDN治疗时间有密切关系。见图3。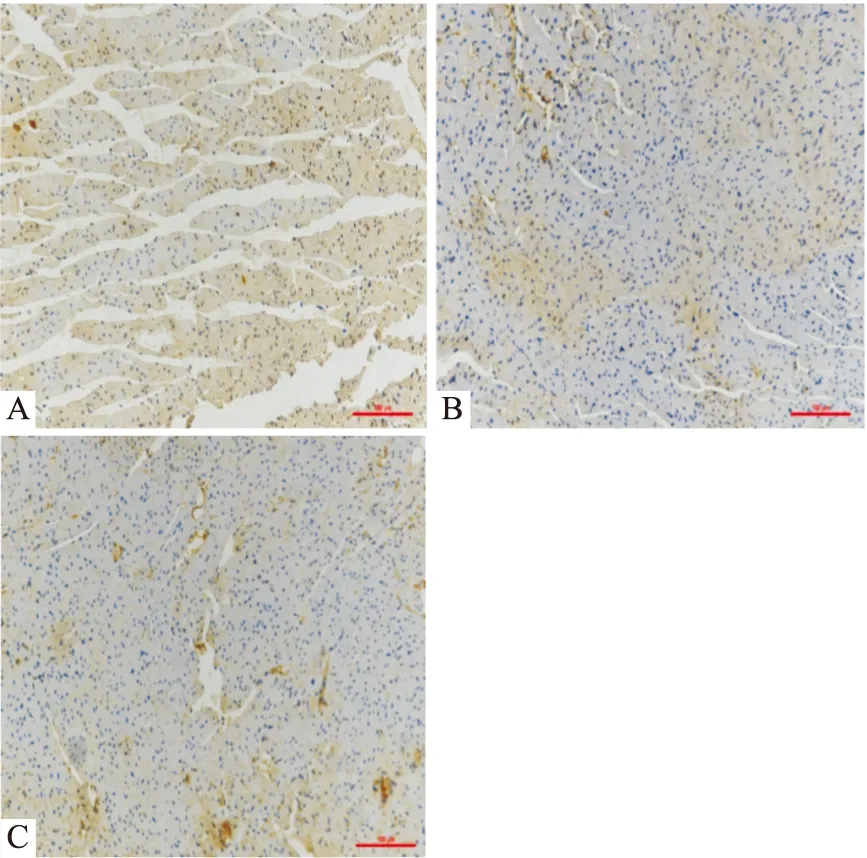
图2 RDN对大鼠AMI后心脏神经活性的影响 TH染色 ×200
3 讨论
AMI患者大多数并发不同程度的心律失常,其中持续性室性心律失常是最常见的并发症,尽管目前有多种方法可以降低心肌梗死后室性心律失常的发生,但室性心律失常引起的心脏猝死仍占心血管病死亡率的50%以上。肾动脉去交感神经术是近年来可以通过降低交感神经活性,抑制RASS系统激活治疗难治性高血压的一种微创介入技术。目前有研究显示RDN能减少心肌梗死后室性心律失常的发生,但相关作用机制仍不明确。在本研究中,在大鼠发生AMI前进行了RDN术,研究表明RDN组室性心动过速的发生次数明显减少,其中RDN术后1 d组效果更显著,实验过程中AMI组有1只大鼠发生室颤死亡,其他2组大鼠没有因室颤死亡,说明RDN能够抑制急性心梗后室性心律失常的发生,从而降低死亡率。
有研究显示心肌梗死区心肌交感神经支配不均衡,儿茶酚胺类物质的分布出现不均衡,引起跨室壁复极离散度增加,最终引起室性心律失常发生。该研究中,通过肾交感神经活性检测和心脏TH染色法检测交感神经活性,结果显示,与正常组比较,RDN组肾交感神经放电都减少,其中RDN-1d组放电减少更明显。与AMI组比较,RDN组TH阳性表达都有减少,而TH在很多研究中被用来标记心脏神经纤维分布,该研究中,心肌梗死1 h后心脏交感神经纤维尚未形成,但TH阳性表达增加说明AMI组心脏局部交感神经活性增强,而RDN组心脏局部交感神经活性减弱。综上可得,RDN通过阻断肾交感传入神经,抑制中枢反馈机制,从而抑制TH表达,降低心脏局部交感神经活性,最终减少室性心律失常的发生,其中RDN术后早期抑制效果较后期可能更明显。
AMI后心律失常的发生与静息膜电位的去极化、动作电位的延长以及内向整流钾离子(IK1/Kir2.1)通道减少有关,其中Ca和Na通道参与动作电位的形成。Yamada et al在探讨RDN对心衰大鼠发生房颤的机制中发现4组大鼠CaV1.2、NaV1.5、Kir2.1 SERCA2和NCX离子通道蛋白表达相似,没有差异性。随后在心衰缺血模型兔中发现RDN可以通过抑制Cav1.2、Nav1.5、Kir2.1和KvLQT1的mRNA表达显着下调,抑制心肌梗死后心衰家兔模型的电重构并缩短有效不应期和动作电位时程。本研究结果提示RDN术后2w能够抑制Nav1.5、Cav1.2和Kir2.1蛋白表达水平的下调,而术后1d蛋白表达没有下调,说明RDN术后后期能够通过抑制离子通道蛋白的表达,逆转电重构,缩短有效不应期和动作电位时程,从而抑制心梗后室性心律失常的发生。
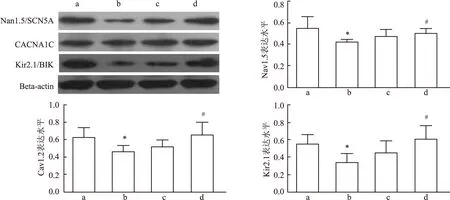
图3 RDN对大鼠心肌梗死区各离子通道蛋白表达水平的影响
综上,RDN能够有效地降低AMI后室性心动过速的发生,该机制可能与肾脏交感神经放电活动减少及离子通道蛋白表达的调节有关,其中RDN术后1 d肾脏交感神经放电活动减少,蛋白表达调节变化不明显,而RDN术后2w肾脏交感神经放电活动和蛋白表达水平调节都有改变,说明RDN早期主要通过抑制肾脏交感传入神经这一途径起作用,后期通过交感神经兴奋和离子通道蛋白两个途径同时起到抑制作用,最终抑制AMI后室性心律失常的发生。

