长链非编码RNA PVT1对宫颈癌细胞增殖、迁移及侵袭的影响
李 力,郭祥翠,王倩青,李 君,郜智慧
宫颈癌是女性生殖系统常见的恶性肿瘤,发病率仅次于乳腺癌。在诊断时,大多数患者已经处于疾病的中晚期,近几年来,年轻患者的发病率逐年上升。因此,研究肿瘤的发生发展过程,寻找新的治疗靶点,已成为宫颈癌研究的重点。近年来,随着治疗手段的进步,提高了患者的生存率和生活质量。然而,肿瘤复发和转移仍然是宫颈癌患者死亡的主要原因。
生物信息学分析已确定浆细胞瘤变异易位1基因(plasmacytoma variant translocation 1, PVT1)是胃癌、肺癌、胰腺癌和宫颈癌等多种癌症类型中少数关键功能性lncRNA之一。PVT1对宫颈癌的发生发展具有调节作用,但是,潜在的机制尚未完全清楚。miR-484位于chr6上,最初被发现与癌症对化疗药物的耐药性有关。有研究表明miR-484在肝细胞癌的癌前病变中过表达,并且可以在促进肝细胞的转化和肝癌的发展。因此,该研究通过探究长链非编码RNA PVT1与miR-484靶向关系对宫颈癌细胞的影响,以期对宫颈癌的治疗和预后提供理论依据。
1 材料与方法
1.1 试剂与仪器
PVT1 shRNA (sh-PVT1)(上海生工生物公司设计合成);miR-484 inhibitor、Matrigel基质胶、Lipfectamine 3000转染试剂盒(美国Invitrogen公司);顺铂、胎牛血清、0.25%胰酶和DMEM细胞培养液、RIPA裂解液(美国Sigma公司);BCA试剂(上海碧云天生物科技公司);TRIzol试剂盒、反转录试剂盒和荧光定量试剂盒(美国ThermoFisher公司);Transwell小室及人工基底膜(美国BD公司);Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)、基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)、、E-cadherin和N-cadherin抗体(美国NEB公司);HRP标记的山羊抗小鼠二抗(美国Santa Cruz公司);Invitrogen E-Gel Imager凝胶成像仪(美国赛默飞公司);Olympus CK30显微镜(日本奥林巴斯光学有限公司)。1.2 肿瘤组织与细胞培养
癌组织与癌旁组织取自人子宫颈鳞癌组织及其周围正常组织。宫颈癌细胞系在补充有10%胎牛血清的RPMI-1640培养基中生长。所有细胞均培养于37 ℃、5% CO的培养箱中。细胞汇合率达到85%以上时用0.25%胰酶进行消化传代。1.3 实验方法
1.3.1
细胞转染 将SiHa和MG63细胞传代培养于6孔板中。24 h后,根据转染试剂盒说明书用Lipofectamine 3000分别或同时转染sh-PVT1和miR-484 inhibitor,48 h后进行相应检测。1.3.2
RT-PCR 用TRIzol试剂盒提取各组细胞总RNA。按照逆转录试剂盒说明书合成cDNA,用PCR仪对cDNA进行扩增后用荧光定量试剂盒对进行定量分析。以GAPDH作为内参。反应条件为:95 ℃ 反应15 s,总共40个循环,最后60 ℃反应30 s,70 ℃反应30 s。用于该反应的引物信息见表1。1.3.3
细胞增殖实验 细胞增殖测定采用细胞增殖ELISA BrdU(比色)试剂盒(Hoffmann-La Roche, Nutley, NJ)根据制造商的协议。转染48 h后,1.0×10个细胞被镀在96孔的培养皿中,并让其附着一夜。细胞用BrdU标记2 h,固定,用抗BrdU-pod孵育。通过洗涤去除未结合的过氧化物酶偶联物。然后加入底物,15 min后测量吸光度值(370~492 nm)。根据试剂盒说明,还使用了PrestoBlue1细胞存活率测定法。转染48 h后,将细胞接种到96孔板(1.0×10细胞/孔)上,并以10~200 μmol/L的浓度范围暴露于顺铂4 h。移除顺铂培养基并在暴露4 h后用生长培养基替换,然后在37 ℃下孵育过夜。第2天,用PrestoBlue1试剂将细胞在37 ℃孵育1 h后测量荧光值。
表1 实时定量PCR目的基因的引物
1.3.4
Western blot法 使用裂解缓冲液裂解细胞样品。然后,使用BCA蛋白质测定试剂盒定量蛋白质浓度。含有20 mg蛋白质的样品在10%SDS-PAGE中分离,然后转移到聚偏二氟乙烯膜上。用5%脱脂牛奶室温封闭蛋白2 h,随后加入一抗 (PCVA, 1∶1 000; Ki67, 1∶1 000; VEGF, 1∶1 000; MMP-9, 1∶1 000; E-cadherin, 1∶1 000; N-cadherin, 1∶1 000) 于4 ℃封闭过夜,第2天加入对应二抗室温封闭1 h,最后滴加电化学发光溶液,设置曝光参数,检测目的条带对应化学发光强弱。1.3.5
荧光素酶报告实验 对于荧光素酶测定,将SiHa和MG63(5×10细胞/孔)接种在24孔板中。 野生型pGL3-PVT1-WT和突变型pGL3- PVT1-Mut载体购自Genechem(中国上海)。使用Lipofectamine 2000(Invitrogen)将细胞用miR-484转染48 h,然后与PVT1-WT或PVT1-Mut共转染。根据荧光素酶检测试剂盒说明书,在转染后48 h内,通过双重荧光素酶报告基因分析系统(Promega,Madison,WI)检测细胞的荧光素酶活性。海肾荧光素酶活性用作内部对照。1.3.6
Transwell 用胰蛋白酶消化宫颈癌细胞,并重悬于含10%FBS的DMEM中。将4×10细胞轻轻地添加到Transwell的上层隔室。 将具有10% FBS或EGF的DMEM添加到Transwell的下部隔室。 将细胞置于37 ℃、5% CO的培养箱中培养指定时间。用棉球轻轻去除上面残留的细胞。通过过滤器从上侧迁移到下侧的细胞用5%戊二醛固定10 min,然后用1%的结晶紫在2%乙醇中染色20 min。在显微镜下从5个不同的随机选择的视图中计数下侧的染色细胞。将5个显微镜视野的平均细胞数用作侵袭细胞数。1.3.7
划痕实验 用划痕法检测癌细胞的迁移能力。细胞在培养皿中汇合后,用p1000塑料微吸管尖在细胞单层上划出水平和垂直交叉线。用培养基轻轻清洗细胞表面,去除细胞碎片后,将原培养基吸出,用配制好的药物和对照培养基代替。用Olympus CK30显微镜在同一框架和同一视野下,于0、24 h拍摄划痕区域的快照图像。图像用ImageJ软件进行分析,比较各组24 h/0 h划痕宽度比。1.3.8
免疫荧光检测p38的细胞核转位 将宫颈癌细胞接种到涂有纤连蛋白的玻璃盖玻片上。培养24 h后,PBS冲洗细胞,固定于预冷甲醇中,0.2% Triton X-100渗透。固定细胞在1.5%的正常山羊血清中预孵育,4 ℃下用一抗p38 (1∶100) 孵育过夜。荧光素标记山羊抗兔IgG抗体37 ℃孵育后,将盖玻片用PermaFluor Aqueous固定在载玻片上。使用Zeiss Axioplan Universal显微镜观察荧光。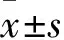
2 结果
2.1 qRT-PCR检测PVT1和miR-484在癌组织和癌旁组织的表达
PVT1在宫颈癌组织中的表达是癌旁组织的2.5倍左右(F
=2.375,P
<0.05),见图1A。与相比,miR-484在癌旁组织中的表达是宫颈癌组织的2倍左右(F
=1.163,P
<0.05),见图1B。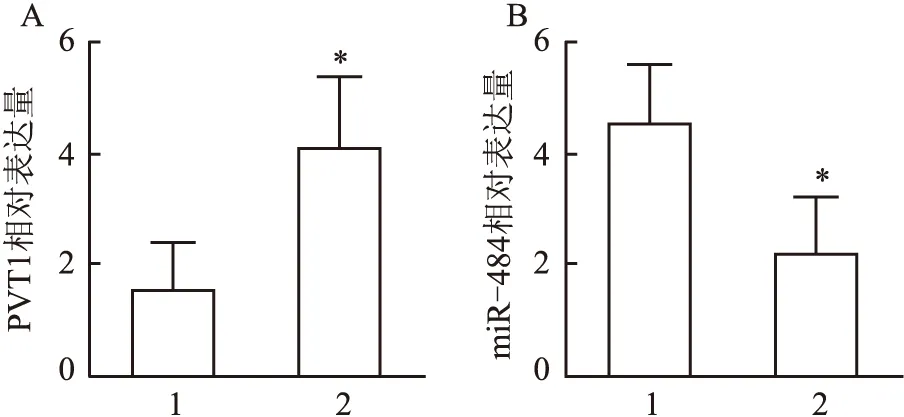
图1 PVT1和miR-484在癌组织和癌旁组织的表达
2.2 PVT1与miR-484的靶向关系
通过进行生物信息学分析,观察到PVT1与miR-484存在结合位点,见图2A。与对照组比较,sh-PVT1组PVT1表达水平显著下降,而miR-484 inhibitor组PVT1表达水平显著升高(F
=522.5,P
<0.05);与miR-484 inhibitor组比较,sh-PVT1+inhibitor组细胞PVT1表达水平显著降低,见图2B。与对照组比较,sh-PVT1组miR-484表达水平(2.91±0.05)显著升高,而miR-484 inhibitor组miR-484表达水平(0.19±0.04)显著下降(F
=8 801,P
<0.05);与miR-484 inhibitor组比较,sh-PVT1+inhibitor组细胞miR-484表达水平(0.13±0.17)显著升高(P
<0.05) ,见图2C。荧光素酶报告实验结果表明,与对照组比较,miR-484能显著抑制PVT1野生质粒的荧光素酶活性 (P
<0.05);通过改变PVT1片段中假定的结合位点完全消除了抑制作用,见图2D。结果表明PVT1与miR-484存在靶向关系。2.3 干扰PVT1对宫颈癌生长的影响
与对照组比较,sh-PVT1组阳性细胞数显著减少,miR-484 inhibitor组阳性细胞数显著升高 (F
=266.1,P
<0.05);与miR-484 inhibitor组比较:sh-PVT1+inhibitor组阳性细胞数显著减少 (P
<0.05),见图3A。与对照组比较,sh-PVT1组细胞增殖蛋白Ki67、PCNA表达水平均显著降低(P
<0.05),而miR-484 inhibitor组Ki67、PCNA表达水平均显著升高 (F
=87.45,P
<0.05;F
=72.10,P
<0.05) ;与miR-484 inhibitor组比较:sh-PVT1+inhibitor组Ki67、PCNA表达水平均显著降低 (P
<0.05),见图3B。结果表明干扰PVT1能抑制宫颈癌细胞的生长。2.4 干扰PVT1对宫颈癌侵袭能力的影响
与对照组比较,sh-PVT1组侵袭细胞数显著降低 (P
<0.05),而miR-484 inhibitor组侵袭细胞数显著升高(F
=18.17,P
<0.05);与miR-484 inhibitor组比较,sh-PVT1+inhibitor组侵袭细胞数显著降低 (P
<0.05) ,见图4A。此外,如图4B所示,与对照组比较,sh-PVT1组VEGF、MMP-9的表达水平显著降低(P
<0.05);而miR-484 inhibitor组VEGF、MMP-9表达水平均显著升高(F
=9.33,P
<0.05;F
=42.47,P
<0.05) ;与miR-484 inhibitor组比较,sh-PVT1+inhibitor组VEGF、MMP-9表达水平均显著降低(P
<0.05)。结果表明干扰PVT1能够抑制宫颈癌细胞侵袭能力。2.5 干扰PVT1对宫颈癌迁移能力的影响
与对照组比较,sh-PVT1组的24 h/0 h划痕宽度比升高 (P
<0.05),而miR-484 inhibitor组的24 h/0 h划痕宽度比降低 (F
=35.48,P
<0.05);与miR-484 inhibitor组比较,sh-PVT1+inhibitor组的24 h/0 h划痕宽度比升高(P
<0.05),见图5。结果表明干扰PVT1能够抑制宫颈癌细胞迁移能力。2.6 干扰PVT1对上皮-间质转化的影响
干扰PVT1使细胞发生表皮间质转化,导致了细胞形态的改变,见图6A。与对照组比较,sh-PVT1组E-cadherin的表达水平升高 (P
<0.05);miR-484 inhibitor 组E-cadherin表达水平均降低(F
=125.7,P
<0.05);与miR-484 inhibitor组比较,sh-PVT1+inhibitor组E-cadherin表达水平均升高(P
<0.05) ,见图6B。相反,与对照组比较,sh-PVT1组N-cadherin的表达水平下降(P
<0.05);miR-484 inhibitor组N-cadherin表达水平均升高(F
=67.19,P
<0.05) ;与miR-484 inhibitor组比较,sh-PVT1+inhibitor组N-cadherin表达水平均下降(P
<0.05),见图6B。结果表明干扰PVT1 能够影响上皮-间质转化相关分子的蛋白水平变化,介导宫颈癌细胞发生上皮间质转化,抑制了宫颈癌细胞侵袭和迁移能力的增加。
图2 PVT1与 miR-484的靶向关系
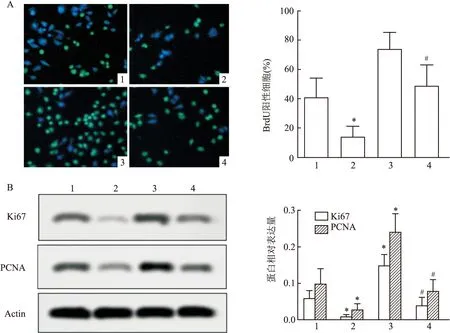
图3 干扰PVT1对细胞增殖及相关蛋白表达的影响
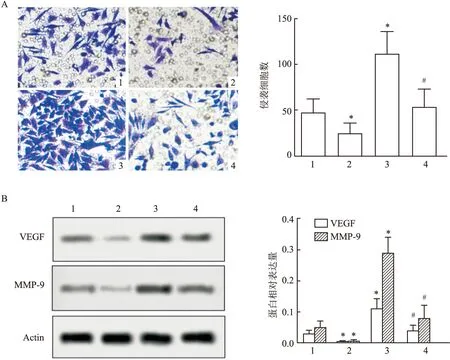
图4 干扰PVT1对细胞侵袭能力及相关蛋白表达的影响

图5 细胞划痕实验×200
2.7 干扰PVT1对p38MAPK活化的影响
与对照组比较,sh-PVT1组p38磷酸化水平降低 (P
<0.05),miR-484 inhibitor组p38磷酸化水平增加(F
=39.81,P
<0.05) ;与miR-484 inhibitor组比较,sh-PVT1+inhibitor组p38磷酸化水平降低(P
<0.05),见图7A。免疫荧光染色法实验表明,对照组细胞的细胞质中有p38激酶蛋白荧光弱荧光表达,p38蛋白荧光变弱,细胞核中没有明显显现;miR-484 inhibitor组的p38蛋白荧光变强,区域几乎分布于整个细胞,细胞核中亦有明显显现,见图7B。结果表明干扰PVT1能够抑制P38MAPK的活化。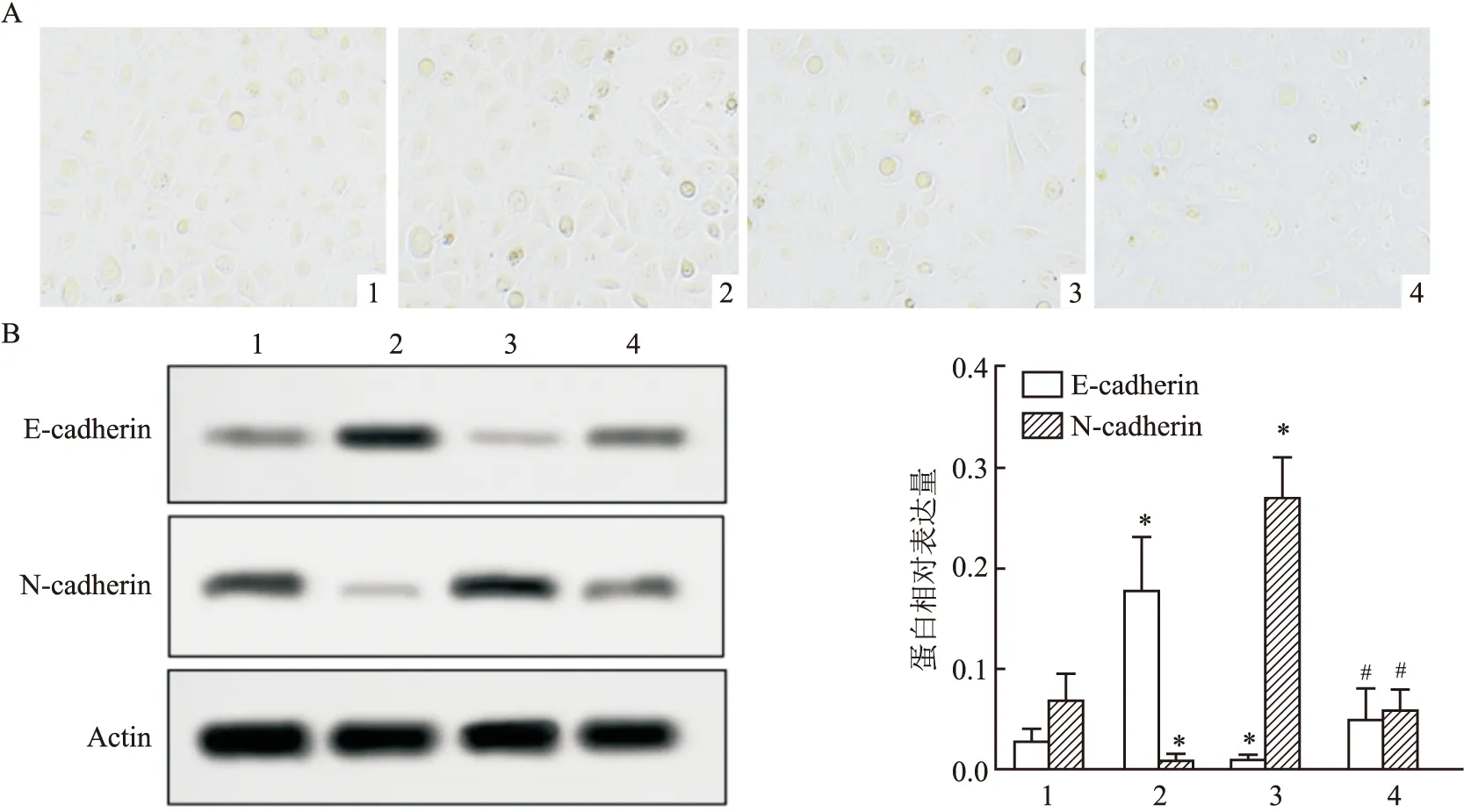
图6 干扰PVT1对细胞迁移能力及相关蛋白表达的影响
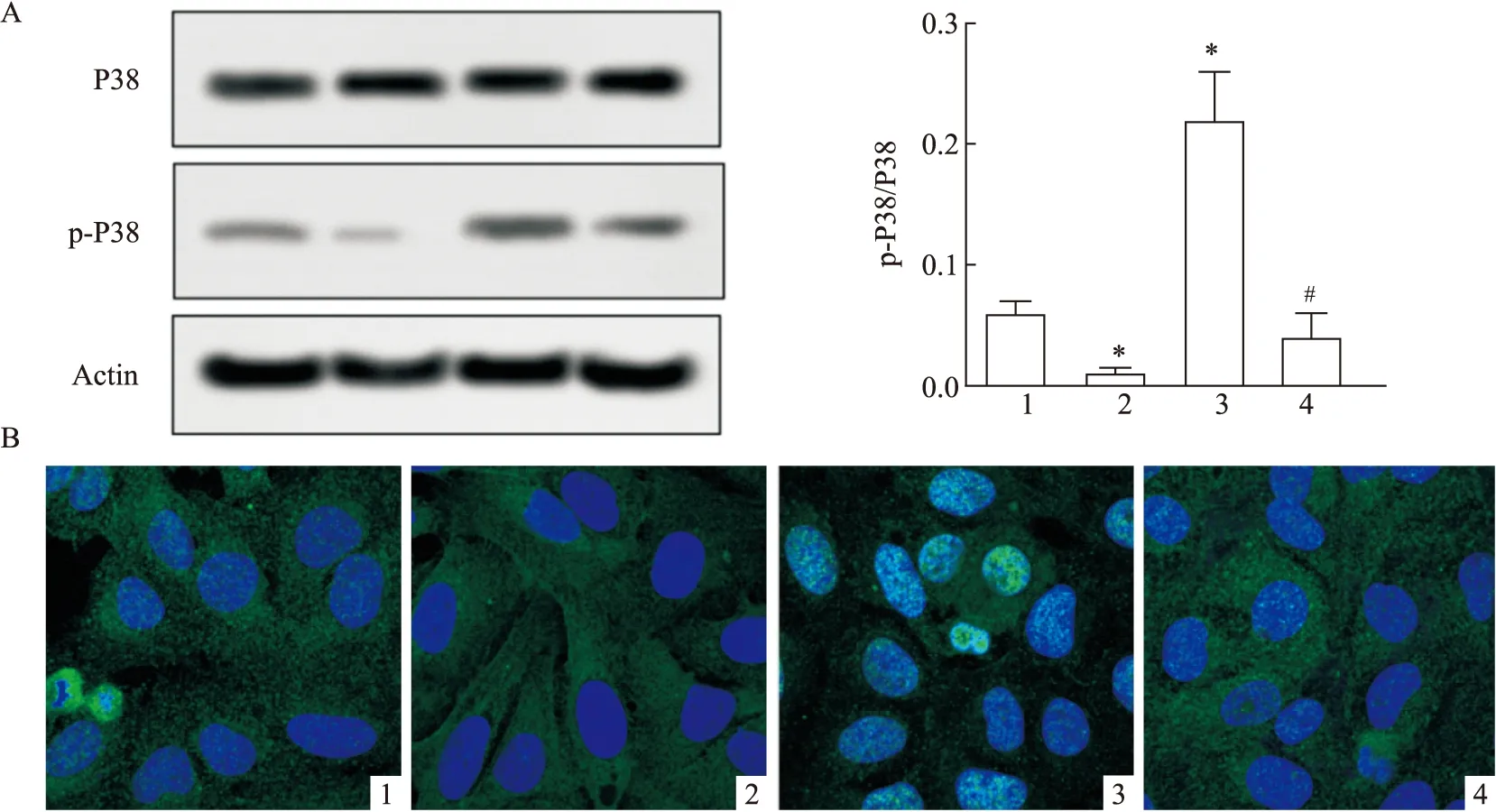
图7 干扰PVT1对P38MAPK磷酸化及细胞核转位的影响
3 讨论
宫颈癌的发病率在全球女性恶性肿瘤中排名第四,而超过85%的病例发生在发展中国家,每年估计有275 000人死亡。宫颈癌也是我国女性生殖系统最常见的恶性肿瘤,威胁着我国女性生殖系统的健康。淋巴结转移、器官转移和肿瘤复发是诱导宫颈癌引起死亡的主要原因,宫颈癌治疗对医疗健康事业是一个重大考验。
PVT1是宫颈癌中的一种致癌lncRNA,可通过调控miRNA表达发挥致癌作用。lncRNA PVT1确切的生物起源尚不清楚,但其与细胞分化、转移性疾病、总生存率和肿瘤分期等因素的关系已被广泛研究。研究表明miRNA是多种生物学过程的重要调控因子,其异常表达与癌症的发生和发展有关。有研究显示miR-484与癌症中对化疗药物的耐药性有关。本研究结果显示,PVT1在宫颈癌组织中表达上调,在宫颈癌中发挥了促癌作用;与癌旁组织相比,宫颈癌癌组织中miR-484表达下调。这些差异可能是由于不同类型的癌症和癌的分期,但其机制还有待进一步阐明。
lncRNA和miRNA之间能进行相互调节。从机制上讲,lncRNA可以作为miRNA的竞争性内源RNA,而miRNA可以通过Argonaute 2(Ago2)介导的途径抑制lncRNA的表达。PVT1可通过调控多种miRNA的表达影响癌症的发展,但目前尚未有研究证实PVT1能否通过靶向调控抑癌基因miR-484的表达影响宫颈癌的发生发展。本研究结果显示miR-484在宫颈癌细胞中表达明显降低,这与Hu et al的研究一致。解除PVT1对miR-484的抑制作用,恢复了其正常表达。用miR-484 inhibitor抑制miR-484表达后,sh-PVT1对miR-484表达的促进作用明显减弱,提示PVT1和miR-484之间可能存在靶向调控关系。生物信息预测结果表明PVT1上存在miR-484的结合位点,荧光素酶报告实验发现,miR-484过表达可明显减弱PVT1野生质粒的荧光素酶活性,进一步表明miR-484可与PVT1结合,PVT1与miR-484之间存在靶向调控关系。
癌细胞无限增殖是癌症发生发展的重要机制。已有研究表明PVT1高表达促进宫颈癌细胞增殖,miR-484过表达显著抑制细胞增殖。Zhang et al研究表明PVT1高表达使EdU阳性细胞百分率升高,而低PVT1表达使EdU阳性细胞百分率降低。本研究表明干扰PVT1使Brdu阳性细胞数降低,而抑制miR-484使Brdu阳性细胞数升高。干扰PVT1表达后,宫颈癌细胞增殖受到明显抑制,Ki67和PCNA的蛋白表达水平降低,而通过抑制miR-484表达可部分恢复PVT1沉默引起的宫颈癌细胞的增殖受抑,说明干扰PVT1抑制宫颈癌细胞增殖与miR-484的过表达有关。
肿瘤侵袭和迁移是复杂的多步转移过程的重要组成部分。目前许多研究表明,干扰PVT1均减少细胞的迁移和侵袭,而过表达PVT1则增加迁移和侵袭,而miR-484高表达抑制宫颈癌细胞迁移、侵袭。本研究表明干扰PVT1能明显降低宫颈癌细胞的侵袭数量,减少宫颈癌细胞的迁移,并能抑制VEGF、MMP9蛋白表达水平,同时,抑制miR-484表达使得sh-PVT1对宫颈癌细胞侵袭、迁移的抑制作用明显减弱,表明干扰PVT1抑制宫颈癌细胞的侵袭和迁移与高表达的miR-484有关。
EMT是一种与迁移和侵袭相关的重要机制。在转化过程中,增强细胞与细胞接触的上皮标志物的表达减少,而间充质标志物表达减少。Hu et al研究表明miR-484过表达显著下调E-cadherin表达水平,抑制宫颈癌细胞EMT过程。本研究表明干扰PVT1能明显抑制E-cadherin 的蛋白表达水平,而显著增强了N-cadherin的蛋白表达水平。同时抑制miR-484表达明显减弱sh-PVT1对宫颈癌细胞EMT过程的抑制作用,提示干扰PVT1抑制宫颈癌细胞EMT过程与其上调miR-484的表达有关。
P38MAPK信号转导通路是细胞内介导细胞外刺激的重要信号系统,在细胞恶变和肿瘤侵袭起着关键作用。p38MAPK信号通路作为MAPK家族的重要通路,对包括乳腺癌、卵巢癌、宫颈癌在内的癌细胞的侵袭和迁移具有重要影响。研究发现抑制p38MAPK通路可限制乳腺癌转移,影响卵巢癌大鼠肿瘤的生长。Gan et al研究表明抑制ZEB1-AS1可阻断p38MAPK信号通路,最终抑制EMT,抑制宫颈癌细胞迁移和侵袭。本研究表明干扰PVT1可显著下调p-p38的表达,p38的核染色强度明显减弱;抑制miR-484上调了p-p38的表达,p38的核染色强度明显增强,这与Gan et al的研究结果一致,说明干扰PVT1能抑制p38MAPK的活化。

