长效稳定表达杆状病毒基因传递载体的构建及表达效率研究
王志昇,李梦婷,姬勇敢,杨 文,杨 丽,杨萌萌
近年来,杆状病毒作为基因传递载体吸引了众多研究者的关注。然而,由于其介导的外源基因无法整合到宿主染色体中,随着传代次数的增多,外源基因逐渐降解,导致无法长效表达目的蛋白,限制了其作为基因传递载体的广泛应用。研究表明,睡美人(sleeping beauty, SB)转座子系统,通过以经典的DNA“剪切-粘贴”模式,能够将外源基因整合到宿主基因组中特异性的位点中。基于以上分析,为了克服杆状病毒瞬时表达的缺陷,该研究拟构建SB转座子-杆状病毒嵌合载体系统,以绿色荧光蛋白基因EGFP作为靶基因,以此来评价SB转座系统介导的杆状病毒作为基因传递载体在哺乳动物体内外的表达效率。
1 材料与方法
1.1 质粒、菌株和细胞
pFastBac DUAL表达质粒购自美国Thermo公司;pT2/HB、pCMV(CAT)T7-SB100质粒购自美国Addgene公司;人胶质瘤U87细胞和昆虫Sf-9细胞购自中科院细胞库。Sf-9细胞在Grace昆虫培养基(包含10% FBS、3.3 g/L酵母提取物和水解乳蛋白),27 ℃培养箱中培养;U87细胞在DMEM培养基(10% FBS、1%青链霉素),37 ℃、5% CO潮湿培养箱中培养。1.2 实验动物
SPF级BALB/c裸小鼠,4~6周龄,雄性,体质量18~22 g,购自宁夏医科大学实验动物中心,生产许可证号:SCXK(宁)2020-0001。动物饲养于温度(22±1)℃、湿度(50±5)%、12 h/12 h昼夜交替的SPF级屏障实验室中。1.3 主要试剂
Taq 酶、限制核酸内切酶和T4连接酶购自美国Thermo公司;CloneExpressUltra One Step Cloning Kit购自南京诺唯赞生物公司;质粒小提试剂盒与凝胶回收试剂盒购自北京天根公司;丁酸钠购自美国Sigma公司;MTT试剂盒购自江苏凯基生物;DMEM培养基、Grace培养基、FBS及脂质体购自美国Gibco公司;兔抗EGFP多克隆抗体、Cy3-山羊抗兔荧光二抗、DAPI染液、抗荧光淬灭封片剂和EDTA(pH8.0)抗原修复液购自武汉谷歌生物。1.4 主要仪器
T100型PCR仪购自美国BIORAD公司;Multiskan FC型全波长酶标仪和Forma 311型CO培养箱购自美国Thermo公司;Axio Vert.A1型倒置荧光显微镜购自德国蔡司公司;CI-L型正置荧光显微镜购自日本尼康公司;5430R型高速冷冻离心机购自美国Eppendorf公司;CytoFLEX FCM型流式细胞仪购自美国贝克曼公司;石蜡切片系统购自德国徕卡公司。1.5 引物设计
构建长效稳定表达杆状病毒基因传递载体所需的引物、序列、扩增片段以及每条引物引入的酶切位点(下划线所示)如表1所示。1.6 载体构建
1.6.1
pBac-CE质粒的构建 在pFastBac DUAL质粒pPh启动子下游插入pCMV-IE-EGFP表达原件;pCMV-IE-EGFP融合基因通过引物CE-F/CE-R,从pEGFP-C1质粒中扩增获得,预期扩增的pCMV-IE-EGFP大小为1 300 bp。经PCR和测序鉴定正确的重组质粒命名为pBac-CE。具体引物序列、酶切位点及扩增的片段如表1所示。1.6.2
pBacSB-CE质粒的构建 CMV-SB100X-SV40 PA表达原件通过引物CMV-SB-SV-F/CMV-SB-SV-R从质粒pCMV(CAT)T7-SB100中扩增,然后将扩增产物与经同样位点酶切后的pFastBac Dual根据CloneExpressUltra One Step Cloning Kit手册同源重组,获得的质粒命名为pBac-SB100X,预期扩增的CMV-SB100X-SV40 PA融合基因大小约为2.1 kb;CMV-EGFP-SV40 PA表达原件通过引物CE-SV-F/CE-SV-R从质粒pBac-CE中扩增,然后与经Eco
RV和Bgl
Ⅱ双酶切后的pT2/HB按照同样的方法进行同源重组,获得的质粒命名为pT2/HB-CE,预期扩增的CMV-EGFP-SV40 PA融合基因大小约为1.6 kb;IR/DR-CMV-EGFP-SV40 PA-IR/DR表达原件通过引物IR/DR-CE-F和IR/DR-CE-R从质粒pT2/HB-CE中扩增,然后与Not Ⅰ和Avr Ⅱ双酶切后的pBac-SB100X经同源重组获得重组质粒pBacSB-CE,预期扩增的IR/DR-CMV-EGFP-SV40 PA-IR/DR融合基因大小约为2.3 kb。1.7 重组病毒粒子的获得
依据Bac-to-Bac(invitrogen)说明书方法将pBac-CE和pBacSB-CE转化DH10Bac,提取经蓝白斑筛选后的阳性菌落DNA,即Bacmid DNA,然后将Bacmid DNA用脂质体法转染Sf-9昆虫细胞(9×10个/ml),27 ℃培养,待细胞出现大量绿色荧光时收集细胞培养上清液,作为原毒种P1代毒,以感染复数(multiplicity of infection, MOI)为1继续接种Sf-9细胞,收集上清液作为P2代毒,继续接种获得P3代毒,-80 ℃冻存备用。获得的病毒分别命名为Bac-CE和BacSB-CE,病毒的滴度通过终点稀释法测定。1.8 重组杆状病毒对U87细胞活力的影响
杆状病毒转导哺乳动物细胞的方法参照文献。简述如下,将U87细胞悬液按4×10/ml的细胞密度,每孔100 μl接种于96孔板中,待细胞贴壁后,将Bac-CE和BacSB-CE分别以MOI 100、200、400 转导U87细胞,对照组为不含病毒的空转导组,72 h后,每孔加入50 μl 1×MTT继续培养4 h,吸弃上清液,加入150 μl DMSO终止反应,然后通过酶标仪在490 nm波长下测定吸光度(optical density, OD)。细胞存活率(%)=OD/OD×100%1.9 重组杆状病毒在U87细胞中的表达效率
将100 MOI Bac-CE和BacSB-CE按照上述的方法分别转导U87细胞,每隔3 d在倒置荧光显微镜下记录发荧光细胞比例,并收集细胞,一部分细胞继续传代培养,另一部分细胞用于流式细胞仪检测EGFP总荧光强度(total fluorescence intensity, TFI),每个样本检测10 000个细胞。TFI=细胞总数×阳性细胞百分比×平均荧光强度。1.10 重组杆状病毒在体内的转导效率
取200 μl生长状态良好的U87细胞悬液(1×10个/ml)接种在BALB/c裸小鼠背部左侧皮下,当肿瘤体积长至100 mm时,随机分为两组,每组9只,分别瘤内注射200 μl Bac-CE和BacSB-CE(1×10pfu/ml),于注射后第1、5和10天每组分别处死3只,分离肿瘤组织,制作石蜡切片,经脱蜡水化处理后,加入兔抗EGFP多克隆抗体4 ℃过夜孵育,然后加入Cy3-山羊抗兔荧光二抗室温孵育1 h后,PBS清洗3次,DAPI染液室温避光复染10 min,用抗荧光淬灭封片剂封片,于正置荧光显微镜下观察并采集图像。
表1 扩增片段引物序列
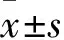
2 结果
2.1 杆状病毒基因传递载体构建模式图
以pFastBac-DUAL质粒为骨架,在pPh启动子下游插入pCMV-IE-EGFP表达原件,获得的重组质粒命名为pBac-CE;将pPh启动子替换为pCMV-SB100X-PA-IR/DR-pCMV-IE-EGFP-PA-IR/DR表达原件,获得的重组质粒命名为pBacSB-CE,载体构建模式图如图1所示。2.2 重组质粒PCR鉴定
重组质粒pBac-CE和pBacSB-CE分别用相应的引物进行PCR扩增,然后经1.0 %琼脂糖凝胶电泳在预期的位置处均出现了特异性条带(图2),与预期结果一致,证明已成功构建了重组质粒pBac-CE和pBacSB-CE。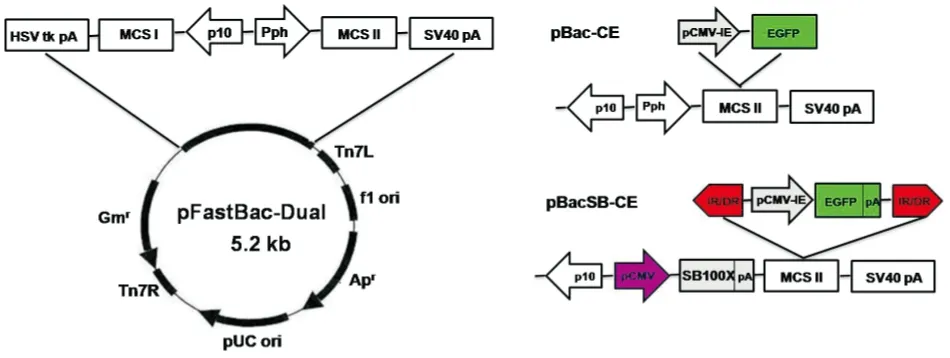
图1 以质粒pFastBac Dual为骨架构建的重组杆状病毒基因传递载体模式图
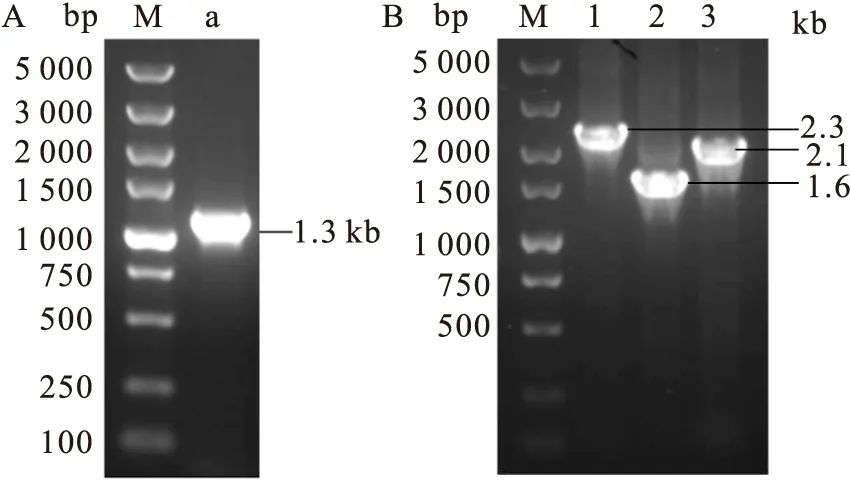
图2 重组质粒PCR鉴定
2.3 重组Bacmid PCR鉴定
将pBac-CE和pBacSB-CE转化感受态细胞DH10Bac,然后从阳性菌落中提取病毒DNA,经PCR和核酸琼脂糖凝胶电泳鉴定,均在预期位置处出现了插入的片段(图3),证明目的片段已成功插入病毒基因组中。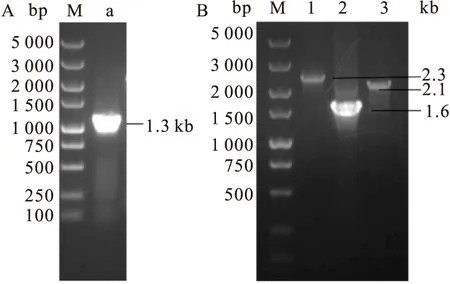
图3 重组Bacmid PCR鉴定
2.4 重组杆状病毒对U87细胞活力的影响
为了证实重组病毒在哺乳动物细胞中的安全性,将不同滴度的BacSB-CE和Bac-CE分别转导U87细胞,3 d后通过MTT法测定细胞的存活率。结果如图4所示,病毒感染复数是100、200、400 MOI时,BacSB-CE和Bac-CE组的细胞存活率与对照组相比差异无统计学意义,表明重组杆状病毒对细胞的生长无影响。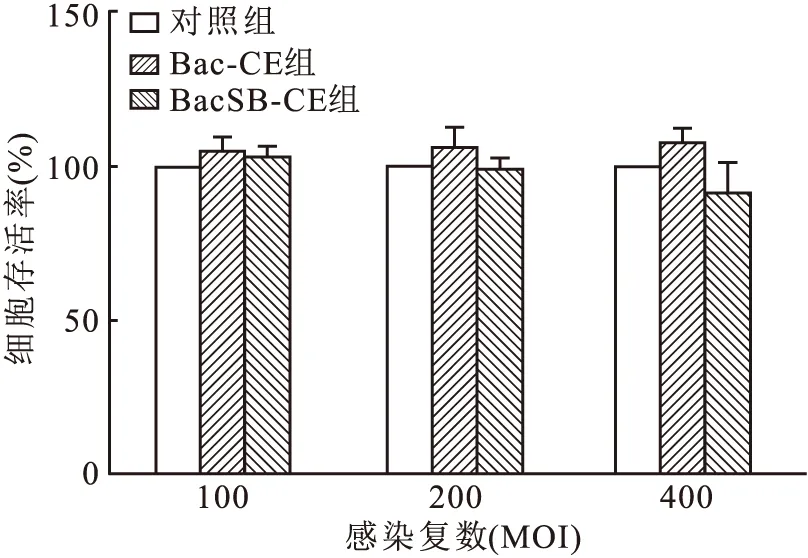
图4 重组杆状病毒对U87细胞活力的影响
2.5 重组杆状病毒在U87细胞中的表达效率
为了验证重组病毒BacSB-CE在哺乳动物细胞中的表达效率,将100 MOI重组病毒BacSB-CE和Bac-CE分别转导U87细胞,转导后每隔3 d在倒置荧光显微镜下观察细胞的荧光状态。结果如图5A所示,随着时间的增加,荧光细胞的数目逐渐减少,到第15天的时候,Bac-CE组已基本上看不到荧光细胞,而BacSB-CE组则仍可看到荧光直至实验期结束(60 d)。进一步通过流式细胞仪检测EGFP TFI,结果如图5B所示,BacSB-CE组能持续检测到荧光信号(约10a.u.)直至实验期结束(60 d),而Bac-CE组在15 d之后下降到低于检测限(10~10)a.u.,结果表明SB转座子介导的杆状病毒能够有效延长外源基因在哺乳动物细胞中持续稳定表达。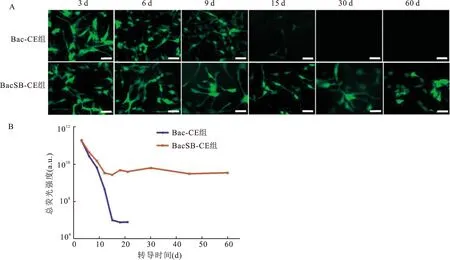
图5 重组杆状病毒在U87细胞中的表达效率
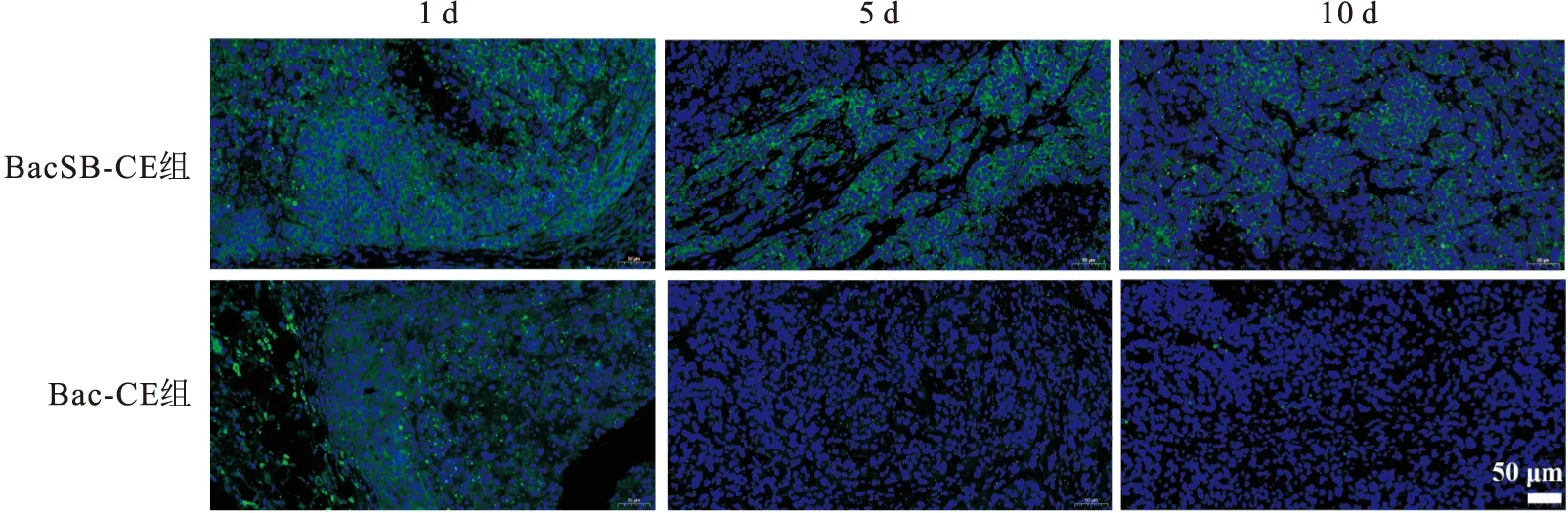
图6 组织免疫荧光分析重组杆状病毒介导的EGFP在体内的转导效率 ×100
2.6 重组杆状病毒在体内的转导效率
为了评估重组病毒BacSB-CE在体内的转导效率,建立裸鼠皮下胶质瘤模型,通过组织免疫荧光检测EGFP在肿瘤内的表达情况。结果如图6所示,在注射后的第1天,BacSB-CE和Bac-CE组,都能检测到荧光细胞,在第5天的时候Bac-CE组基本看不到荧光细胞,而BacSB-CE组在第10天时仍能检测到发荧光的细胞。这些结果表明,SB转座子介导的重组病毒能有效地提高外源基因在体内的转导效率。3 讨论
杆状病毒由于对人和哺乳动物不具备感染性,因此无针对杆状病毒的特异免疫原性,而且能够容纳至少50 kb以上的外源片段插入以及重组病毒的获得简单快速等优点,使得杆状病毒在疫苗生产、真核蛋白表面展示等方面的报道屡见报端。近年来,越来越多的研究表明,在合适的功能启动子作用下,杆状病毒能将外源基因有效地转移到宿主细胞中,使得杆状病毒作为基因传递载体的应用时有报道。然而,杆状病毒的基因组在哺乳动物细胞中随着时间的延长逐渐被降解,外源基因无法持续表达,限制了其在该领域中的进一步应用。
为了克服杆状病毒在哺乳动物体内瞬时表达的缺陷,本研究以pFastBac DUAL质粒为骨架,构建了含有SB转座子的嵌合杆状病毒表达系统(图1~3),并证实了重组病毒载体携带EGFP
基因对U87细胞的增殖没有影响(图4),说明重组病毒对哺乳动物细胞的生长无副作用。进一步研究表明,在SB转座子系统的作用下,BacSB-CE可明显延长EGFP在U87细胞中的表达时间(>60 d,本实验只设计了60 d),而对照组Bac-CE在第15天的时候已基本看不到荧光细胞(图5A);流式细胞仪检测结果(图5B)也表明,BacSB-CE和Bac-CE组在转导初始都有很高的表达效率,而随着时间的增加,二者的表达率急剧下降,在15 d之后BacSB-CE组仍能稳定检测到约10a.u的TFI,而Bac-CE组已经降到检测下限(10~10a.u.)。这个结果可能由于大量外源基因失败整合到宿主基因组中,并且随着传代次数的增加,外源基因逐渐被降解、稀释,从而导致转导效率的急剧下降。体内裸鼠胶质瘤实验同样证实了SB转座子可以提高外源基因EGFP在体内的表达效率(图6)。这些结果说明在SB转座子系统的介导下,外源基因成功整入到了宿主细胞的基因组中,并随着宿主细胞的增殖而稳定表达。这与Pan et al的研究结果一致。根据相关文献报道,oriP/EBNA1,AAVITR等重组嵌合杆状病毒载体均被开发,这些载体均可不同程度的延长外源蛋白在宿主细胞中的表达时间。为了提高病毒转导效率,除了优化载体设计外,转导条件也应考虑,如根据细胞的不同,可以将病毒和细胞的孵育时间增加到4~6 h;最好在26~27 ℃条件下转导,37 ℃可能会破坏病毒的完整性;添加3 mmol/L丁酸钠(高浓度的丁酸钠对细胞有毒性)等,这些都可有效地提高病毒的转导效率。
