FMS样酪氨酸激酶3配体在急性髓系白血病患者血清中的表达及其临床意义
宋辉,于艺冰,郭媛媛
(秦皇岛市第一医院 血液内科,河北 秦皇岛 066000)
急性髓系白血病(acute myeloid leukemia,AML)是成年人中最常见的血液系统恶性肿瘤,预后较差,患者5年生存率较低,耐药和复发是患者死亡的主要原因[1]。虽然国内外关于AML的研究已有很多,但是其发病机制仍尚未明确。早期对AML预后进行评估是临床和基础研究的重点。FMS样酪氨酸激酶3(Fms- like tyrosine kinase 3,Flt3)也被称为胎肝激酶2,具有促进造血干细胞增殖的作用。Flt3基因异常表达(突变、缺失或者过表达)均可能出现在AML中。既往研究[2- 3]显示,Flt3内部串联重复突变预示AML患者预后不良。
FMS样酪氨酸激酶3配体(Flt3 ligand,Flt3L)对维持机体造血有重要作用[4]。Flt3L是一种造血细胞生长因子,可以促进造血干细胞和造血祖细胞的增生、分化及动员,并且能促进淋巴细胞的增生[5- 6]。当造血微环境受损时,Flt3L表达水平明显降低[7]。外周血Flt3L在范科尼贫血、再生障碍性贫血和杂合子GATA2突变引起的疾病中表达水平异常[7]。AML患者外周血Flt3L水平的变化及其意义既往少有报道。与健康人比较,AML患者入院时外周血Flt3L水平明显较低;AML诱导治疗后的1~15 d,患者外周血中Flt3L表达水平逐渐升高,最后逐渐下降;Flt3L对AML的早期诊断有一定价值[8]。但是该研究未分析Flt3L与AML病情发展和预后的关系。本研究旨在分析血清Flt3L表达水平与AML患者疾病进展和预后的关系。
1 资料与方法
1.1 一般资料
纳入标准:(1)诊断及疾病分期均符合2017年美国国家综合癌症网络制定的AML诊治指南[9];(2)年龄≥18岁;(3)临床资料完整。排除标准:(1)合并其他血液系统疾病;(2)合并肿瘤;(3)肝肾等重要脏器功能不全;(4)失访。选取2017年10月至2019年1月本院收治的符合上述条件的200例AML患者为研究对象。其中男104例,女96例;年龄19~60岁,平均(47.12±10.09)岁;FAB分型为M0 26例,M1 28例,M2 39例,M3 34例,M4 24例,M5 49例。 将200例患者分为初治组(n=124)、缓解组(n=39)和复发组(n=37)。3组基本资料差异无统计学意义(P>0.05),见表1。所有患者的治疗均参考2017年美国国家综合癌症网络制定的AML诊治指南[9]。本研究经过本院伦理委员会批准。
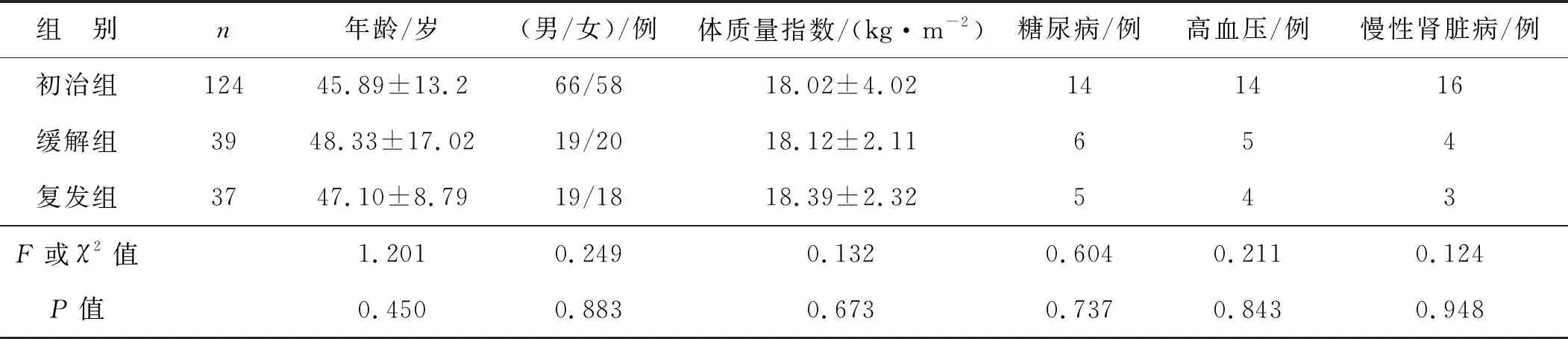
表1 3组患者一般资料比较
1.2 血清Flt3L检测方法
入组时采集所有AML患者晨起空腹肘静脉血5 ml,置于EDTA抗凝管中以2 500 r·min-1离心15 min,收集上层血清。用酶联免疫吸附试验检测血清中Flt3L浓度,试剂盒购于北京百奥莱博科技有限公司,货号:ZN2182。检测时严格按照试剂盒说明书操作。检测所用Spectra Max190酶标仪为美国MD公司生产,检测时波长设置为450 nm。
1.3 预后评价
出院后以门诊或电话方式对124例初治AML患者进行随访,每月随访1次,持续随访1年。记录AML患者的死亡情况。
1.4 统计学处理
采用SPSS 19.0统计软件进行统计学分析。初治组、缓解组和复发组3组资料的比较用单因素方差分析(两两比较用LSD-t检验)或卡方检验;存活组和死亡组资料的比较用独立样本t检验;不同FAB分型患者Flt3L质量浓度比较用单因素方差分析;AML患者预后的影响因素用Cox多因素分析;采用受试者工作特征(ROC)曲线分析Flt3L预测AML患者预后的价值。P<0.05为差异有统计学意义。
2 结 果
2.1 3组血清Flt3L表达水平比较
3组血清Flt3L表达水平的差异有统计学意义(F=16.872,P<0.001)。初治组血清Flt3L质量浓度为(83.09±12.09)pg·ml-1,复发组为(91.76±20.23)pg·ml-1,均低于缓解组的(133.08±30.24)pg·ml-1(均P<0.001),初治组与复发组血清Flt3L质量浓度的差异有统计学意义(P<0.001)。
2.2 生存组和死亡组血清Flt3L表达水平比较
存活组血清Flt3L质量浓度为(88.07±11.82)pg·ml-1,高于死亡组的(78.07±10.09)pg·ml-1,但差异无统计学意义(t=1.372,P>0.05)。
2.3 血清Flt3L与AML患者临床特征的关系
血清Flt3L与性别、年龄、基础疾病及FAB分型无关(P>0.05),见表2。
2.4 影响AML患者死亡的多因素分析
以随访1年内AML患者是否存活作为应变量,以年龄、性别、FAB分型、糖尿病、高血压、慢性肾脏病和血清Flt3L为自变量,建立Cox回归模型进行多因素分析,结果显示,血清Flt3L是影响AML患者死亡的独立因素(P<0.05),见表3。
2.5 血清Flt3L预测AML患者预后的价值
血清Flt3L预测AML患者1年内死亡的ROC曲线下面积(AUC)为0.823(P=0.031)。当血清Flt3L截断值为75.08 pg·ml-1时,约登指数最大(0.625),此时血清Flt3L预测AML患者死亡预后的价值最高,灵敏度为84.15%,特异度为79.83%。
3 讨 论
AML的发病机制目前尚未完全明确,可能与电离辐射、化学物质、细胞毒物、病毒感染和遗传等有关[10]。临床上的常规化疗方案对AML的治疗效果不甚理想,核型异常、基因突变和某些特定基因的异常表达是影响化疗效果及预后的重要因素[11]。寻找潜在的AML生物学标志物对疾病的早期诊治及预后判断有重要意义。血清学检测具有方便、快捷、稳定性高等特点。血清学AML标志物是近年来研究的热点。
AML患者中Flt3基因突变较为常见,Flt3基因突变与AML的预后有关。提取骨髓中DNA检测Flt3基因突变对疾病预后的早期评估有一定价值[12- 14]。Flt3选择性抑制剂如CEP- 701、CT53518、AC220和PKC412对AML有一定治疗作用[15- 16]。Flt3L是Flt3的配体,在机体造血中发挥重要作用,被认为是一种造血细胞因子。正常情况下,Flt3L主要由骨髓基质干细胞分泌,在祖细胞、干细胞、树突细胞和NK细胞增殖的过程中发挥一定作用[17]。Flt3L在血液疾病、风湿性疾病、免疫性疾病、缺血再灌注损伤和肺部疾病中的作用日益受到重视[6,18- 20]。现已证实,Flt3L可以发挥造血、抗肿瘤和免疫佐剂等作用[18- 19,21]。
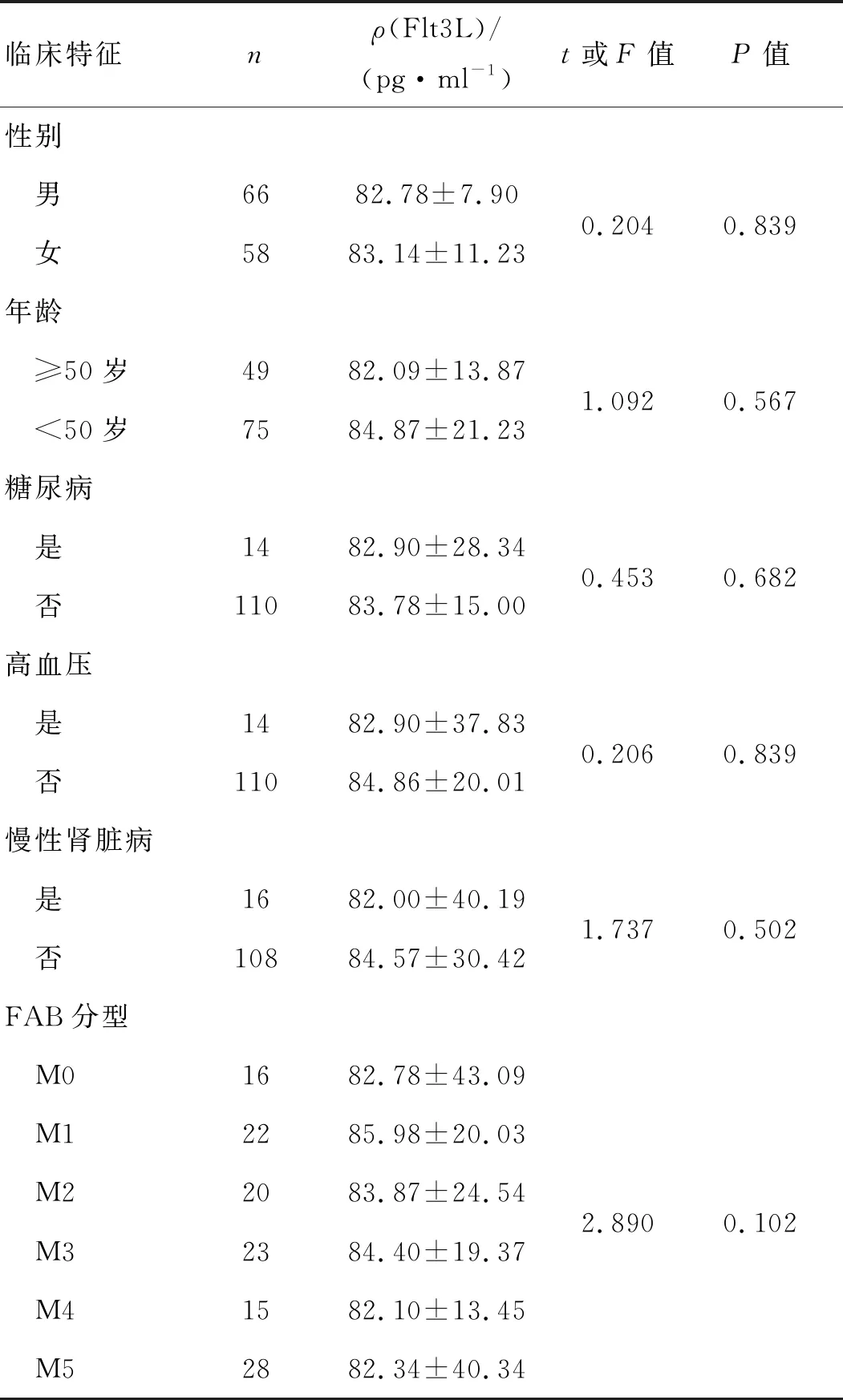
表2 124例初治AML患者Flt3L质量浓度与临床特征的关系
以往报道[22]显示,与健康人比较,AML患者血清Flt3L水平明显降低。外周血Flt3L有助于评价化疗后AML的病情缓解,在化疗第1个和第2个疗程后Flt3L水平逐渐升高[8]。本研究也显示,初治组和复发组血清Flt3L质量浓度均低于缓解组,提示Flt3L可能有助于AML的病情评估。本研究采用酶联免疫吸附实验检测血清Flt3L水平,操作简便,成本较低,因此可能适合于AML患者的动态监测。Peterlin等[8]检测了化疗诱导前后血浆Flt3L水平,发现诱导后Flt3L水平逐渐升高患者的总体生存率和无复发生存率明显较高。本研究对124例初治AML患者进行为期1年随访,存活组血清Flt3L质量浓度高于死亡组,但差异无统计学意义,考虑这与死亡组样本量小有关。以随访1年内AML患者是否存活作为应变量,年龄、性别、FAB分型、糖尿病、高血压、慢性肾脏病和血清Flt3L为自变量,建立Cox回归模型进行多因素分析结果显示,血清Flt3L是影响AML患者死亡的独立因素。另外,血清Flt3L预测AML患者1年内死亡的AUC为0.823,灵敏度为84.15%,特异度为79.83%。
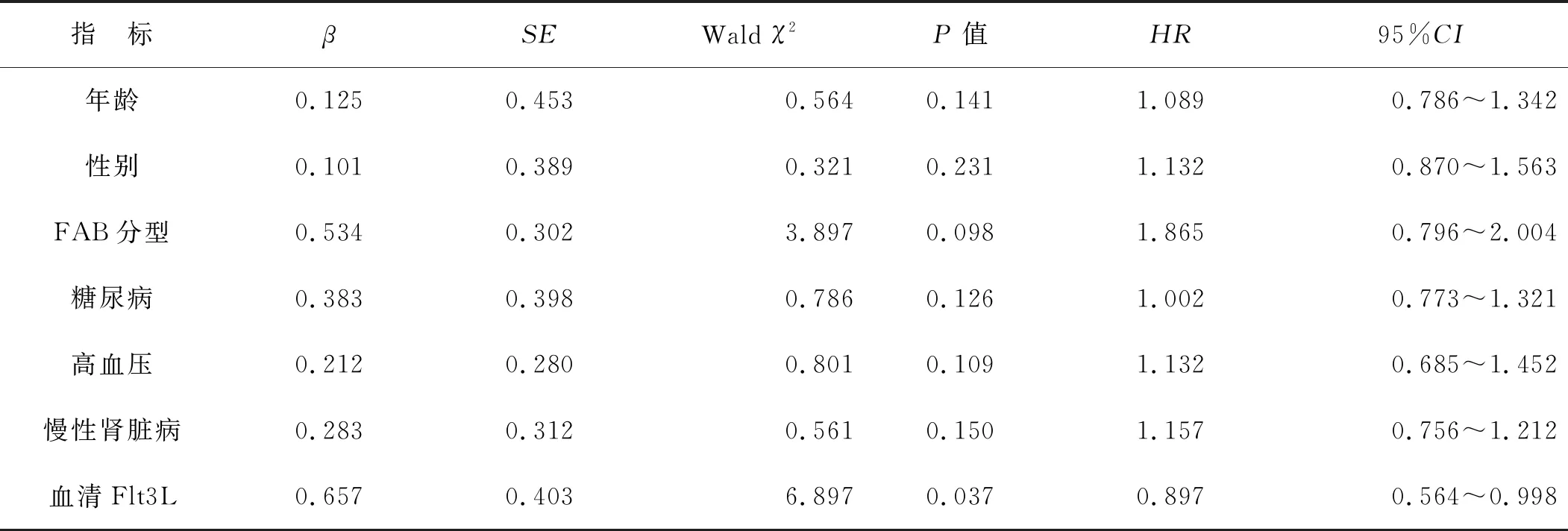
表3 影响AML患者死亡的Cox多因素分析
综上所述,血清Flt3L对AML患者病情及预后早期评价有一定价值。未来需要开展细胞或动物学研究,深入探讨Flt3L在AML中的生物学机制。此外,Flt3基因突变与AML的临床特征及预后密切相关[23- 24],Flt3基因突变后Flt3L表达水平有何变化,有何临床意义,需要进一步分析。

