单次大分割放疗在体外对树突状细胞激活T细胞的影响
郑声琴,范璟,郑勤,童金龙,田小强
(南京中医药大学附属南京医院/南京市第二医院 1.肿瘤科, 2.中心实验室, 江苏 南京 210003)
肝细胞性肝癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,在全球恶性肿瘤发病率中排名第5位,而其死亡率位于恶性肿瘤死亡率的第4位,且有逐年上升趋势[1]。放射治疗在肝癌局部治疗中受到越来越多的重视,相继被列入各国肝癌的治疗指南当中,成为近年来肿瘤放疗学者关注的最新热点,在肝癌、早期非小细胞肺癌、椎体转移癌的治疗中发挥显著的局部控制疗效[2]。
肿瘤的免疫治疗是近年来最瞩目的治疗手段。肿瘤免疫治疗的研究方向主要是两个方面:一是在体外对T细胞进行基因修饰再回输到体内;二是通过抗体刺激免疫细胞使其发挥抗肿瘤作用[3]。本研究将从后者角度出发,以单次大分割放疗后肝癌细胞释放的蛋白为抗原负载树突状细胞(dendritic cell,DC),探究其对DC表型、细胞因子分泌、功能的影响,旨为肝癌的临床治疗提供数据支撑。
1 资料与方法
1.1 一般资料
选取2017年8月至2018年8月南京中医药大学附属南京医院收治的5例肝癌患者。纳入标准:通过病理学、CT和MRI检测,确诊为原发性肝癌的患者;患者无其他重要脏器重大疾病;患者签订本研究的知情同意书。采集患者外周血5 ml,用于后续研究。
1.2 主要试剂
RPMI- 1640和DMEM培养基均购自Gibco公司;淋巴细胞分离液购自南京三生生物技术有限公司;磁珠分选试剂盒购自美天旎公司;细胞因子IL- 4、GM- CSF和TNF- α购自PeproTech公司;流式抗体均购自eBioscience公司;ELISA试剂盒购和MTT试剂盒购自杭州联科生物技术股份有限公司;胞内染色试剂盒购自BD公司。
1.3 DC的体外培养
利用Ficoll密度梯度离心法分离经肝素抗凝的肝癌患者外周血单核细胞(PBMC)。经PBS洗涤后,利用磁珠分选法分选PBMC获得CD14+单核细胞,CD14+细胞>95%。将获得的单核细胞以2×106ml-1的浓度接种到RPMI- 1640培养基中,在37 ℃体积分数5% CO2的细胞培养箱中进行孵育,并加入细胞因子GM- CSF(500 U·ml-1)和IL- 4(200 U·ml-1)。每隔3 d对细胞进行半量换液并补充上述细胞因子。在培养到第5天时,加入促进DC成熟因子LPS(100 ng·ml-1)。再经48 h培养,即可获得成熟DC细胞。
1.4 DC表面表型的流式细胞仪测定
分别收集上述培养到第5天和第7天的非成熟和成熟DC,经PBS洗涤后,转入流式管中,分别加入PerCP、PE、FITC或APC标记的抗人HLA- DR、CD40、CD80、CD83、CD86抗体,置4 ℃避光孵育30 min后,用PBS洗涤2次,加入250 μl PBS悬浮细胞,最后利用流式细胞仪检测分析DC表型。
1.5 肝癌肿瘤相关抗原的制备
用含5%胎牛血清的DMEM培养基对肝癌细胞HepG2进行培养,将HepG2细胞悬液浓度调整为1×106ml-1,接种到25 cm2培养瓶中,在37 ℃体积分数5% CO2的培养箱中培养24~48 h。待HepG2细胞铺满瓶底时,进行放疗照射。将培养的HepG2细胞分为两组,即一组照射剂量为15Gy/1f,另一组照射剂量为5Gy/3f。照射完成后,细胞继续培养48 h,收集细胞上清,以1 600 r·min-1离心5 min后,继续收集上清,重复上述步骤1次。将获得的上清以10 000 r·min-1离心20 min,取获得的沉淀作为HepG2细胞释放的肿瘤相关抗原(tumor- associated antigen, TAA),用PBS溶解后存贮于-80 ℃备用。
1.6 ELISA
将上述培养的成熟DC分为3组:一组加入25 μg·ml-115 Gy/1f TAA进行刺激(以下称为15 Gy/1f组);一组加入25 μg·ml-15 Gy/3f TAA(以下称为5 Gy/3f组);一组作为阴性对照。在37 ℃体积分数5% CO2条件下继续培养48 h,以1 600 r·min-1离心5 min,取细胞培养上清。利用ELISA试剂盒检测DC分泌细胞因子IL- 12p70、IL- 1β、IL- 6、IL- 18的情况。
1.7 免疫磁珠法(MACS)分离纯化T淋巴细胞
取上述提取的肝癌患者外周血PBMC,用PBS洗涤细胞,以1 600 r·min-1离心5 min,取沉淀的细胞,加入80 μl PBS重悬细胞,加入20 μl CD3磁珠,置4 ℃ 孵育30 min;用PBS洗涤细胞,以1 600 r·min-1离心5 min,取500 μl PBS重悬细胞。将LS分离柱放置在MACS分离器磁场中,用1 ml PBS冲洗分离柱,重复操作3次。收集流出液,流出液中含有T淋巴细胞。
1.8 DC与T细胞的共培养
根据上述方法将DC分为3组,分别为15 Gy/1f TAA+DC组、5 Gy/3f TAA+DC组和仅DC组。将DC细胞浓度调整到1×104ml-1,接种到24孔板中,DC∶T细胞以1∶10的比例接种上述分选的T淋巴细胞,并以仅加入T细胞组作为阴性对照。在37 ℃体积分数5% CO2的培养箱中继续培养7 d。通过胞内染色法,利用流式细胞仪分别检测CD4+T细胞和CD8+T细胞分泌IFN- γ情况。
1.9 MTT法测定活化T细胞的杀伤活性
取上述DC和T细胞共培养7 d后的细胞,制备成5×105ml-1的单细胞悬液,加入含有HepG2细胞的96孔细胞培养板(20∶1),作为实验组。另外单独加入未经DC激活的T细胞作为对照组,每孔均设3个复孔。放置在37 ℃体积分数5% CO2的培养箱中继续培养48 h,以1 600 r·min-1离心5 min,弃去上清,每孔加入10 μl MTT溶液(5 mg·ml-1),继续孵育4 h,离心去上清,每孔加入100 μl二甲亚砜,振荡后溶解15 min。利用酶标仪在570 nm处测定OD值。T细胞杀伤活性(%)=(实验组OD570 nm-对照组OD570 nm)/HepG2 OD570 nm×100%。
1.10 统计学处理
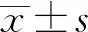
2 结 果
2.1 肝癌患者外周血体外DC的培养及鉴定
利用细胞因子IL- 4和GM- CSF刺激肝癌患者PBMC,在培养第5天收获非成熟DC。在15Gy条件下对肝癌细胞HepG2进行照射,通过反复离心法获得15Gy/1f TAA。利用流式细胞仪检测非成熟DC和负载了15Gy/1f TAA的DC细胞表面HLA- DR、CD40、CD80、CD83、CD86分子的表达情况。由图1和图2结果可知,负载TAA的DC[15Gy/1f TAA +非成熟DC(iDC)]细胞表面HLA- DR、CD40、CD80、CD83、CD86分子表达的百分比和平均荧光强度(mean fluorescence intensity,MFI)均高于iDC:(1) HLA- DR百分比,(90.48±3.09)%vs(68.08±6.29)%,P=0.009 5;CD40百分比,(50.23 ±8.81)%vs(8.43±1.29)%,P=0.017 9;CD80百分比,(36.38±8.06)%vs(2.44±0.99)%,P=0.026 9;CD83百分比,(45.50±13.55)%vs(2.48±0.95)%,P=0.045 4;CD86百分比,(56.75±10.8)%vs(21.43±3.55)%,P=0.029 2。(2) HLA- DR的MFI,3 478 ±494.3vs682.5±97.45,P=0.007 5;CD40的MFI,876.3±53.38vs280±17.76,P<0.001;CD80的MFI,331±44.27vs130±11.02,P=0.016;CD83的MFI,265.8 ±39.42vs87.33±12.03,P=0.033 7;CD86的MFI,18 189±428.7vs3 020±477.1,P=0.044 3。
2.2 单次大分割放疗后HepG2细胞释放的TAA对DC细胞因子分泌的影响
在成熟DC中分别加入15Gy/1f和5Gy/3f条件下的TAA。通过ELISA法检测细胞培养上清中DC分泌的细胞因子浓度。负载了TAA的DC分泌细胞因子IL- 12p70、IL- 1β、IL- 6、TNF- α的浓度均高于未加TAA的DC组。其中15Gy/1f组(15Gy/1f TAA+DC)的DC分泌细胞因子IL- 12p70和IL- 18的浓度高于5Gy/3f组(5Gy/3f TAA+DC)。15Gy/1f TAA+DC组、5Gy/3f TAA+DC组和DC组各细胞因子分泌比较:IL- 12p70的质量浓度,(996.6±118.0)pg·ml-1vs(564.4±54.04)pg·mlvs(327.2±30.63) pg·ml-1,P=0.000 2;IL- 1β的质量浓度,(196.2±31.32)pg·ml-1vs(187.4±22.14)pg·ml-1vs(86.40±8.19)pg·ml-1,P=0.008 6;IL- 6的质量浓度,(2 215±192.8) pg·ml-1vs(1 395±122.9)pg·ml-1vs(887±51.12) pg·ml-1,P=0.000 1;TNF- α的质量浓度,(1 099±109.4)pg·ml-1vs(1 023±81.06)pg·ml-1vs(571.2±66.68)pg·ml-1,P=0.002 2。见图3。

灰色曲线代表同型对照,深灰色曲线代表DC,黑色曲线代表15Gy/1f TAA+iDC
2.3 负载TAA的DC刺激特异性T细胞分泌IFN- γ情况
分别用15Gy/1f组和5Gy/3f组的TAA负载DC,然后与自体T细胞共培养,利用流式细胞仪分别检测特异性CD4+T细胞和CD8+T细胞分泌IFN- γ的情况。负载15Gy/1f TAA的DC刺激特异性CD4+T细胞和CD8+T细胞分泌IFN- γ均高于5Gy/3f组 (P<0.05),见表1。
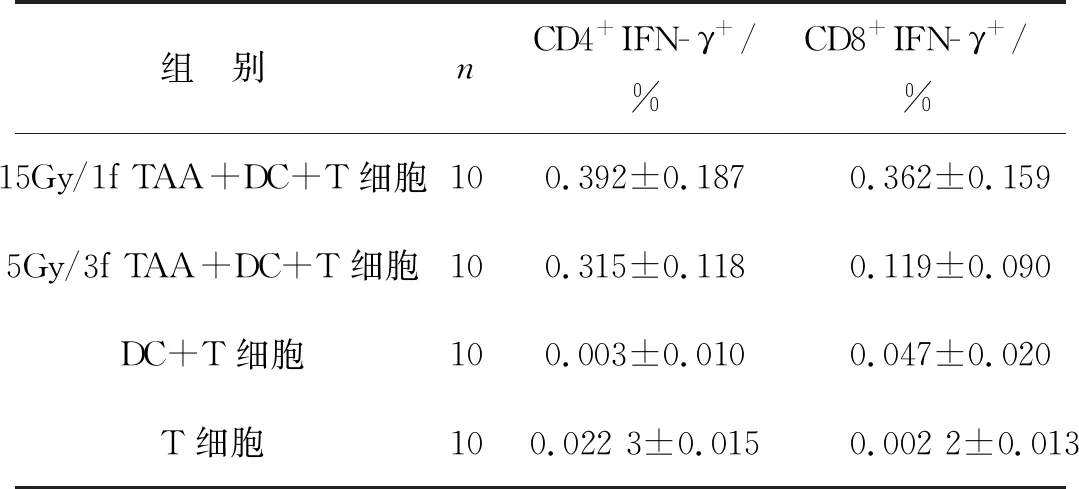
表1 不同抗原负载DC刺激特异性T细胞分泌IFN- γ情况
2.4 活化后T细胞的杀伤活性
15Gy/1f组刺激的T细胞杀伤活性最高,达到(38.33±1.76)%,显著高于5Gy/3f组的(29.33±2.19)%(P<0.05),见图4。
3 讨 论
原发性肝癌是起源于肝细胞或肝内胆管上皮细胞的恶性肿瘤。2018年我国肝癌发病率、死亡率和1年患病率分别为18.3/10万、17.1/10万和10.8/10万[4]。原发性肝癌具有发病迅速、致死率高、生存期短等特点,这严重影响了我们人民的生命健康,因此寻求切实有效的临床治疗方法迫在眉睫。
放疗在肝癌的局部治疗中越来越受重视,特别是单次大分割放疗也有应用到临床的实例[5- 6]。放疗一方面可以提高肿瘤细胞上主要组织相容性复合物- I(MHC- 1)的表达,这有利于提高细胞毒性T细胞对肿瘤细胞的识别[7];另一方面也可以提高肿瘤死亡受体(如Fas等)的表达,这有利于免疫细胞通过Fas配体与肿瘤细胞Fas受体的结合传递信号,引起靶细胞凋亡[8]。但单次大分割放疗对免疫细胞功能影响的研究较少。DC是人体内最强的抗原提呈细胞(antigen- presenting cells, APC),能摄取、加工、处理抗原从而启动激活T细胞,在肿瘤免疫中发挥重要作用。因此,本研究将在体外模拟体内环境,探讨单次大分割放疗对DC细胞表型、细胞因子分泌及T细胞功能的影响。
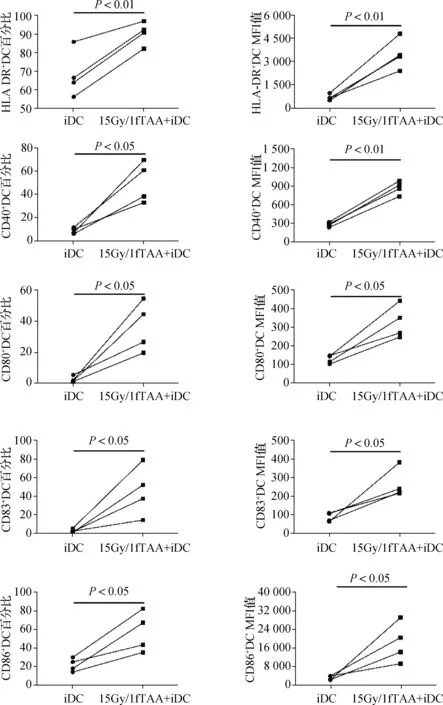
图2 体外培养DC细胞表面分子表达的百分比和MFI值(n=4)
首先,本研究利用单次大分割放疗(15Gy)照射肝癌细胞HepG2。利用反复离心法获得TAA,通过流式细胞仪检测负载了15Gy/1f TAA的DC细胞表面分子的表达。本研究结果显示,通过15Gy照射肿瘤细胞释放的抗原可以促进DC细胞表面分子HLA- DR、CD40、CD80、CD83和CD86表达的提高。HLA- DR是DC激活CD4+T细胞的关键分子,CD40、CD80和CD86与DC刺激T细胞抗原提呈能力有关,而CD83是DC成熟的标志[9]。这些分子的表达都有利于DC发挥免疫刺激作用,说明经过单次大分割放疗后肝癌细胞释放的TAA有利于DC的成熟,这一功能与促进DC成熟的细胞因子TNF- α、LPS及CD40L等类似[10- 11]。为了进一步验证这一结果,通过ELISA法检测了15Gy/1f TAA对DC细胞因子分泌的影响。结果提示,经过抗原刺激后,DC分泌细胞因子IL- 12p70、IL- 1β、IL- 6、IL- 18均高于未刺激组。同时,以5Gy/3f TAA为对照组,实验结果显示高剂量放疗组更能刺激DC分泌细胞因子。因此,单次大分割放疗更有利于DC对免疫细胞的激活。这一结果与Kulzer等[12]的研究结果一致。
TAA负载DC15Gy/1f组相比5Gy/3f组更能刺激CD4+和CD8+T细胞分泌IFN- γ。这一研究结果在小鼠体内也有一致的实验结果。Gupta等[13]在小鼠中发现,单次大分割放疗(10 Gy)可以通过DC激活肿瘤特异性CD8+T细胞发挥抗肿瘤免疫作用。最后,被激活的T细胞对肝癌细胞HepG2具有杀伤作用,而且相比5Gy/3f组,15Gy/1f组对肿瘤细胞的杀伤作用更强。

图3 负载TAA的DC分泌细胞因子情况
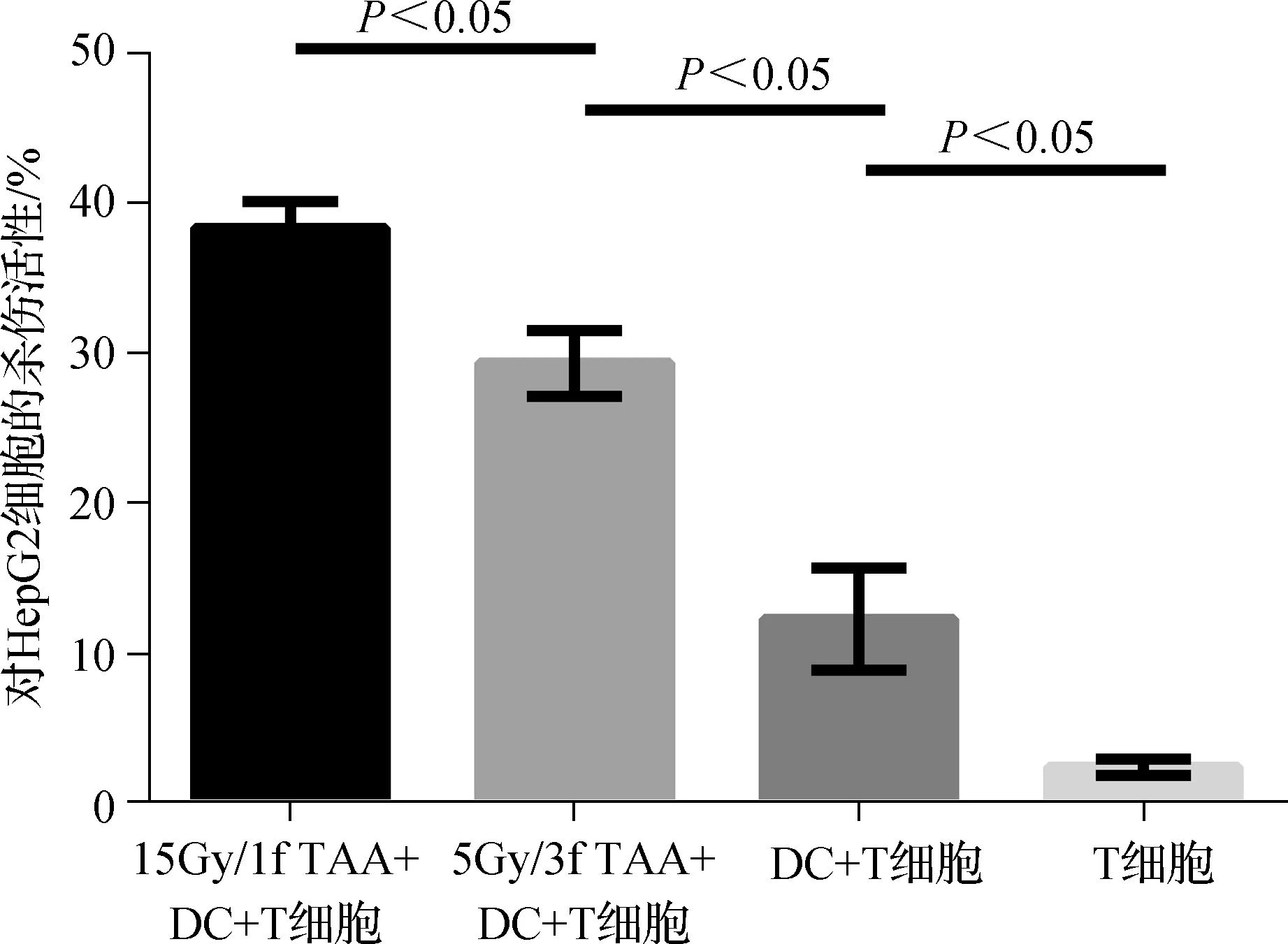
图4 不同抗原负载DC激活的T细胞对HepG2细胞的杀伤活性
综上所述,单次大分割放疗更能刺激DC发挥免疫激活作用,可促进DC的成熟、细胞因子分泌及激活T细胞特异性杀伤肿瘤细胞。

