LINC00958与肿瘤预后的Meta分析及生物信息学分析
田胜伟,张光远,许斌,陈明
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学附属中大医院 泌尿外科,江苏 南京 210009)
癌症已经成为全球范围内人类发病与致死的首要疾病之一[1]。根据国际癌症研究机构(International Agency for Research on Cancer)发布的数据显示,2018年全世界约有1 800万癌症新发病例,约960万病人因癌症死亡[2]。仅仅在中国,2018年因癌症而死亡的人数就高达290万[3]。在过去的数十年里,尽管在肿瘤治疗技术上面人类有了重大的进步,比如手术治疗、化学治疗、放射治疗、靶向治疗[4]以及免疫治疗[5],但是各类癌症患者的总生存期(OS)依然较低,预后依然较差[6]。现有的肿瘤标志物以及常规检查,对肿瘤进行早发现、早诊断、早治疗以及判断预后的作用有限。所以,有必要去探索一些新的特异性生物标志物,用于预测肿瘤的预后。
长链非编码RNA(long- chain non- coding RNA,lncRNA),是一种包含200个核苷酸序列以上的非编码RNA,可以调节基因表达与后转录过程[7- 10]。近年来,大量的研究[11- 14]表明,lncRNA参与调控各类肿瘤的发生发展,包括增殖、侵袭与转移。一些lncRNA可以作为某些肿瘤诊断的特异性生物标志物,并与肿瘤的预后有关[15- 17]。
LINC00958是一种新型的lncRNA。2017年,Seitz等[18]首次发现LINC00958在膀胱癌中高表达。多项研究[19- 28]表明,LINC00958在多种肿瘤中异常表达,且与肿瘤患者的临床病理分期以及OS有关。然而,在不同种类的肿瘤中LINC00958的表达水平与肿瘤的临床病理特征以及预后存在差异。本研究通过Meta分析和生物信息学分析的方法归纳总结LINC00958的表达水平与多种肿瘤预后的关系。
1 资料与方法
1.1 检索策略
在PubMed、Web of Science、Elsevier、Springer、知网的数据库中进行相关文献检索,检索时间截至2020年4月3日。检索的关键词为“LINC00958”“long intergenic non- protein coding RNA 958”“cancer” “tumor”“neoplasia”“prognosis”“outcome”。本研究是按照Meta分析的标准指南来进行的[29- 30]。
1.2 纳入标准与排除标准
纳入标准:(1) 能查阅到全文的文献;(2) 按照LINC00958的表达高低进行分组并描述检测方法;(3) 入 组的患者被明确诊断为某类肿瘤;(4) 文献中对患者的生存率进行了分析或包含生存曲线。排除标准:(1) 快报、病例报道、综述、会议摘要等非论著文章;(2) 原文中无法提取相关数据;(3) 数据重复或重叠研究。
1.3 文献筛选和数据提取
为了确保数据提取的准确性,由两人分别对文献进行数据提取。有争议的信息将由第3人进行讨论并统一。提取的数据包括第一作者姓名、出版年份、国家、肿瘤类型、患者总人数、LINC00958的检测方法、OS的风险比(HR)和95%置信区间(95%CI)、临床病理学特征(性别、年龄、肿瘤大小、肿瘤分化程度及肿瘤转移)。
1.4 质量评估
按照Reporting Recommendations for Tumor Marker Prognostic Studies (REMARK)指南[30]对纳入文献进行质量评估。
1.5 统计学处理
采用Stata 12.0 MP软件进行数据分析。计数资料采用HR与优势比(OR)为效应量,并计算相应的95%CI。HR及其95%CI用于分析LINC00958 与OS之间的相关性。OR及其95%CI用于分析LINC00958与肿瘤临床病理特征间的相关性。如果原文未直接给出HR与95%CI,则用Engauge Digitizer 4.1软件从原文中的Kaplan- Meier图提取数据,并用Stata 12.0 MP 与Graphpad Prism 5 软件对提取的数据进行分析获得相应的HR与95%CI。通过Chi- SquaredQ检验与I2统计用于评估纳入文献的异质性。如果I2<50%或P>0.1认为无明显异质性时,采用固定效应模型(fixed- effects model);如果I2>50%或P<0.1认为存在异质性时,则采用随机效应模型(random- effects model)。进行敏感性分析检验结果的稳定性,绘制Begg’s检验的漏斗图用于评估是否存在发表偏倚(P<0.05表示存在发表偏倚)。
1.6 生物信息学分析
基因表达谱交互分析(Gene Expression Profiling Interactive Analysis,GEPIA,http://gepia.cancer- pku.cn)在线分析数据库是一种新开发的网络服务器,可以根据TCGA与GTEx数据提供多种服务,包括分析肿瘤组织与正常组织之间的基因表达差异以及生存分析。(1)基因表达差异分析:① 选择expression DIY,点击Box plot,检索LINC00958;② “Log2FC cutoff”值取1,“P- value cutoff”值取0.01;③ Datasets Selection:依次输入各类肿瘤英文简称,如“BLCA”;④ 数据来源选择TCGA与GTEx数据库(P<0.01被认为有统计学意义)。(2) 生存分析:① 选择survival,点击survival plots并输入LINC00958;② 设定methods:overall survival;③ Datasets Selection: 依次输入各类肿瘤英文简称,如“BLCA”;④ 使用Log- Rank检验进行假设评估;⑤ 运用Kaplan- Meier法绘制LINC00958表达水平-患者的OS关联曲线(P<0.05为差异有统计学意义)。
2 结 果
2.1 纳入文献基本情况
共检索文献84篇,根据标题、摘要以及重复文献共筛除文献64篇;经过全文阅读,按照纳入与排除标准继续筛除12篇;最终纳入8篇原始文献。见图1。
纳入文献均为英文文献,发表时间为2017年1月1日至2020年4月3日,研究人群均来自中国,研究内容均包含OS。其中8项研究,总计1 060例癌症患者(其中关于头颈鳞状细胞癌的生存曲线来源于TCGA数据库),平均132.5例,按照LINC00958在肿瘤组织中的表达水平,患者被分为高表达组与低表达组;共8类肿瘤,包括肝细胞肝癌(HCC)、子宫颈癌(CC)、鼻咽癌(NPC)、头颈鳞状细胞癌(HNSCC)、口腔鳞状细胞癌(OSCC)、胃癌(GC)、膀胱癌(BC)、神经胶质细胞瘤(glioma);均采用定量实时聚合酶链反应(quantitative real time polymerase chain reaction, qRT- PCR)来验证患者肿瘤组织中的LINC00958表达水平高低;2篇研究的HR值和95%CI从原文结果中直接获得,6篇研究利用软件从原文的Kaplan- Meier图中提取。见表1。
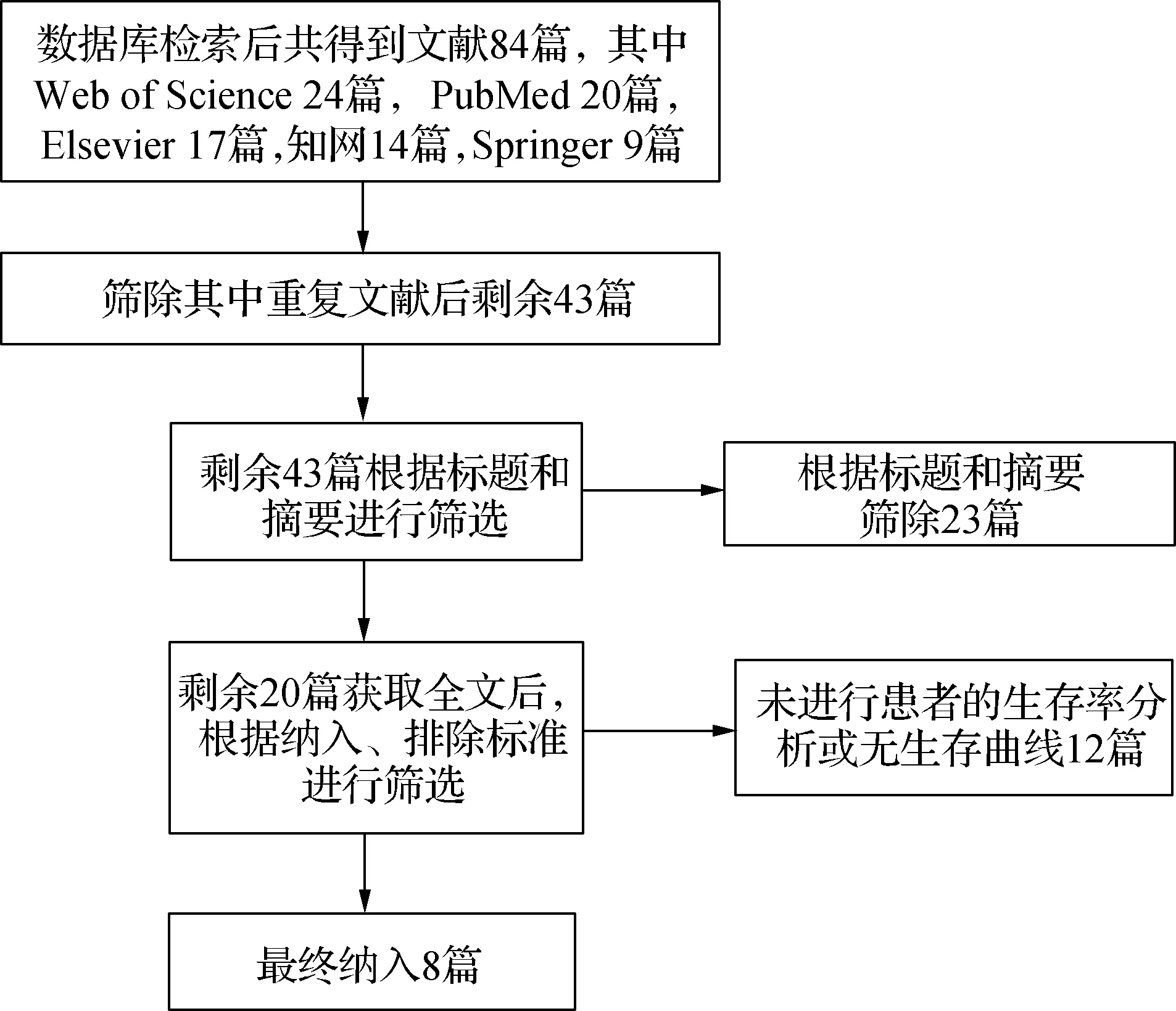
图1 文献检索流程图
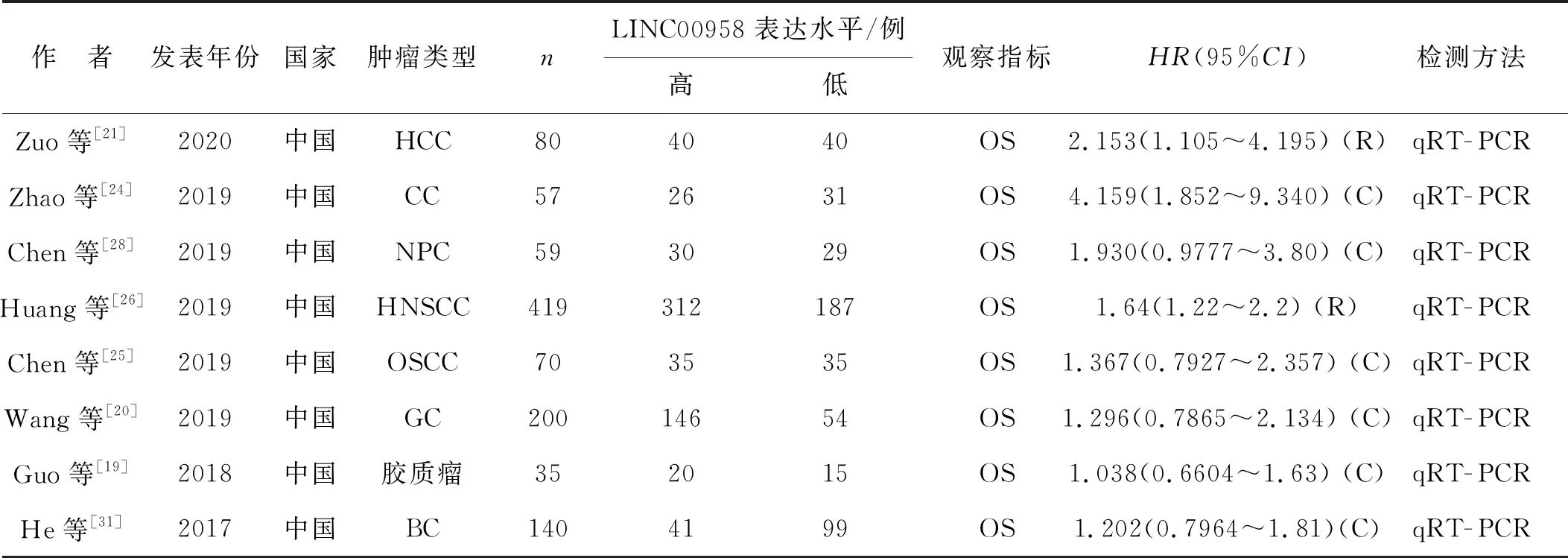
表1 纳入文献基本情况
2.2 LINC00958与癌症患者OS的关系
与LINC00958低表达组患者相比,LINC00958高表达组患者的OS较短,HR为1.533, 95%CI为1.212~1.940,P<0.001,随机效应模型; 图2A)。敏感性分析显示结果稳定(图2B)。Begg’s检验结果显示关于OS发表偏倚风险较小(P=0.063,图2C)。
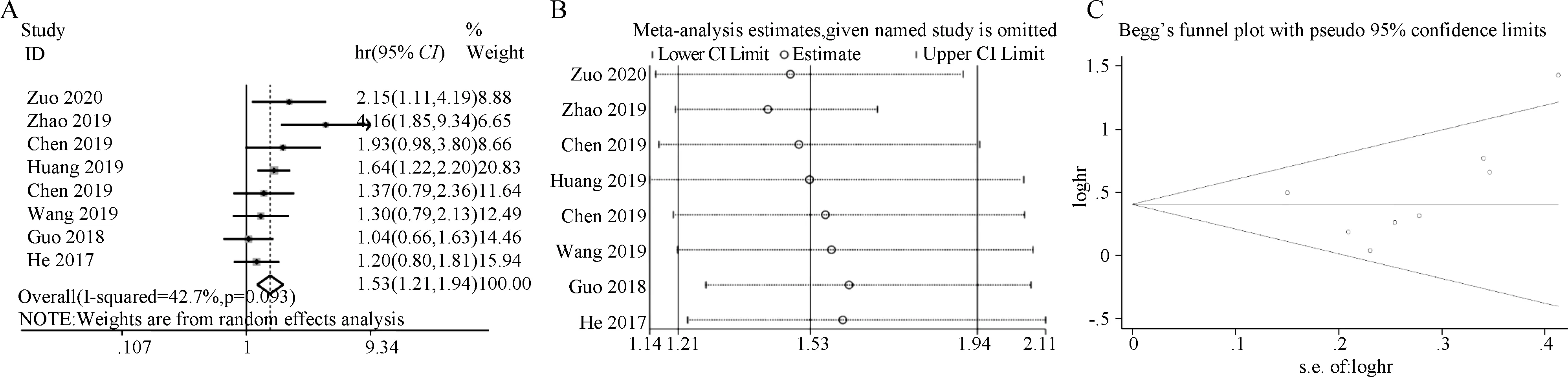
A.LINC00958表达与OS森林图;B.敏感性分析(OS);C.发表偏倚(OS,Begg’s漏斗图)
2.3 LINC00958与肿瘤临床病理特征的关系
LINC00958高表达与促进肿瘤转移(包括淋巴结转移与远处转移)有关,而年龄、性别、肿瘤大小、肿瘤分化程度与LINC00958高表达无关。Begg’s检验结果显示发表偏倚风险较小(年龄P=0.462,性别P=0.462,肿瘤大小P=0.308,肿瘤分化程度P=0.296,肿瘤转移P=0.707)。见表2。
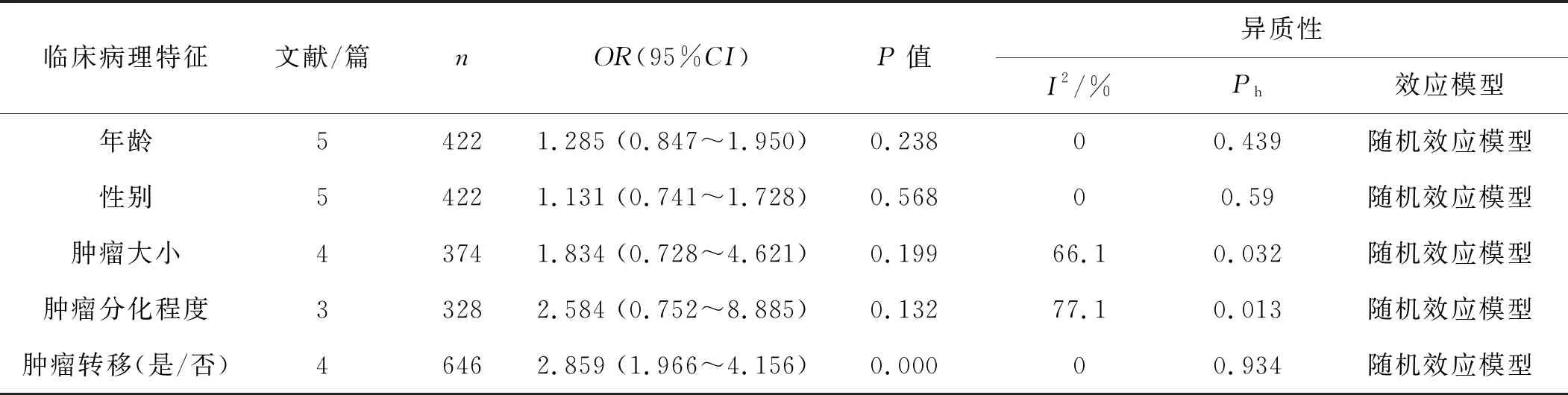
表2 LINC00958表达与肿瘤临床病理特征的关系
2.4 GEPIA数据库分析LINC00958在肿瘤和非肿瘤组织中的表达差异以及生存分析
通过GEPIA数据库分析获取LINC00958高表达肿瘤组织样本数据。LINC00958在8类肿瘤中表达水平明显高于非肿瘤组织,包括膀胱尿路上皮癌(BLCA)、子宫颈鳞癌与腺癌(CESC)、子宫内膜癌(UCEC)、子宫肉瘤(UCS)、卵巢浆液性囊腺癌(OV)、HNSCC、甲状腺癌(THCA)、肺鳞癌(LUSC),差异有统计学意义[Log2fold change (FC) cutoff>1,P<0.01],见图3。在8类癌症患者总样本中,与LINC00958低表达组相比,LINC00958高表达组的OS较低,差异具有统计学意义(P<0.05),见图4A。在HNSCC中,LINC00958高表达组的生存率明显低于低表达组的生存率(P<0.05),见图4B。在UCEC中,与LINC00958低表达组相比,LINC00958高表达组的OS较长,差异具有统计学意义 (P<0.05),见图4C。在BLCA、CESC、UCS、OV、THCA、LUSC中,LINC00958高低表达肿瘤患者OS之间差异无统计学意义(P>0.05)。
3 讨 论
近年来,越来越多的研究显示,LINC00958在多种肿瘤中异常表达,并且与某些肿瘤的预后有关。本Meta分析归纳总结了LINC00958与多种肿瘤的预后及临床病理特征之间的关系。分析结果显示,与LINC00958低表达组相比,LINC00958高表达组的肿瘤患者的OS较短,且与促进肿瘤转移风险有关。此外,用生物信息学分析方法去进一步验证LINC00958在肿瘤中的表达水平以及与肿瘤预后的关系。GEPIA的数据分析显示,LINC00958在8类肿瘤中高表达,且LINC00958高表达的8类肿瘤患者的OS较短,这与本Meta分析所得出的结果一致;且LINC00958高表达的HNSC患者OS较短,而LINC00958高表达的UCEC患者OS较长,这与之前的研究结果相符合。

图3 LINC00958在8种肿瘤组织中的表达水平
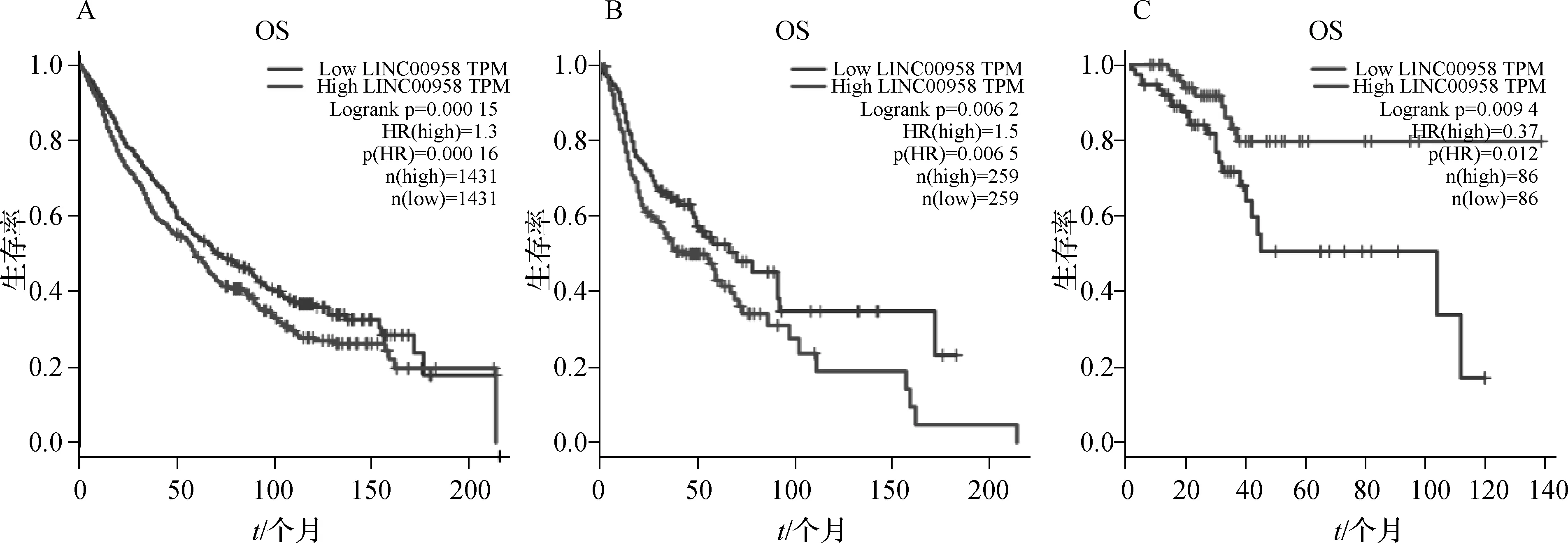
图4 肿瘤患者的生存曲线
LINC00958作为促癌基因被广泛研究并报道,但在某些肿瘤中也可以作为抑癌基因。Guo等[19]发现,在神经胶质细胞瘤中LINC00958可以作为miRNA的内源性竞争RNA(ceRNA),通过miR- 203/CDK2信号通路促进神经胶质瘤细胞的发生发展。Zuo等[21]发现,在HCC的发生发展中LINC00958可以通过miR- 3619- 5p/HDGF信号通路促进肝癌细胞的增殖、侵袭与转移。Chen等[22]发现,敲低LINC00958后可以下调miR- 330- 5p/PAX8,从而抑制胰腺癌细胞的上皮间质转换(EMT)、侵袭与转移。Wang等[23]研究发现,LINC00958可以抑制miR- 625- 5p而上调LRRC8E的表达,从而促进宫颈癌细胞增殖与转移。Zhao等[24]表明,通过抑制LINC00958的表达,经miR- 5095/RRM2信号通路可以抑制细胞癌变,减少癌细胞增殖,促进癌细胞凋亡,并增强CC细胞对放疗的敏感性。Chen等[25]认为,LINC00958可以作为OSCC的新型预后生物标志物,并且其通过调控miR- 627- 5p/YBX2信号通路而发挥作用。Huang等[26]发现,LINC00958- c- Myc信号通路对HNSCC发生发展过程具有正反馈调解作用,并且可以减弱放化疗效果。Chen等[28]发现,LINC00958作为促癌基因,通过抑制miR- 625而抑制下游NUAK1的表达,从而促进NPC细胞的发生发展。Wang等[32]发现,LINC00958作为促癌基因通过LINC00958/miR- 185- 5p/YWHAZ信号通路促进OSCC细胞发生发展。Yang等[33]发现,在肺腺癌细胞中通过转录因子SP1可引起LINC00958的过表达,并且LINC00958可以抑制miR- 625- 5p而上调CPSF7的表达,从而促进肺腺癌细胞的发生发展。然而,在UCEC的研究中LINC00958作为抑癌基因被报道。Wang等[34]发现,LINC00958也许可以通过抑制miR- 761从而调控DOLPP1,对UCEC的良好预后有积极作用。这一现象与基因在不同肿瘤中的生存特性不完全相同有关[35]。lncRNA MALAT1虽然在多数肿瘤中作为促癌基因,但是在乳腺癌中其可抑制乳腺癌细胞转移;Linc- ROR在乳腺癌、GC、肝癌中作为促癌基因,而在胶质瘤中低表达并抑制肿瘤的发生发展[36]。
本研究也有一些不足之处:(1) 本次分析所纳入的所有文献都来自于中国,存在着地域偏倚,所以这些数据不能代表所有种族与人种,可能仅仅适用于亚洲黄色人种;(2) 只检索了中文与英文文献,所以也许会遗漏其他语言发表的类似文献;(3) 本次分析中的HR与CI多数是用软件从K- M图中提取,而不是由原文中的数据直接获得,所以也许会存在误差;(4) 本次纳入的HNSCC研究,对LINC00958与肿瘤临床病理特征之间的关系进行了分析,但未对入组的患者进行生存分析,该研究的生存曲线来源于TCGA数据库,而非该研究的原始数据,所以这也会导致一定程度的误差;(5) 对于LINC00958与肿瘤转移风险之间的分析,本次研究将淋巴结转移与远处转移统一为肿瘤转移,而未对两者进行单独分析;(6) 本次分析仅有8篇文献入组,且高质量文章数量较少,不管是患者数量还是肿瘤类型都较为有限。所以,仍须进行大量相关高质量的研究,提高入组患者数量,增加肿瘤种类,从而得出更可靠的结果。
4 结 论
LINC00958在多数肿瘤中作为促癌基因,该基因的高表达与多数类型肿瘤的不良预后相关,且与促进肿瘤发生转移的风险有关。但是,该研究仍存在着一些不足,将来须进行更多的相关研究。

