沉默JMJD2B通过诱导DNA损伤抑制人胃癌细胞的恶性表型
陈丽莎,徐永成,曾书君,陈惠新
(中山大学附属惠州市中心人民医院 消化内科,广东 惠州 516000)
近年来涌现了大量的关于表观遗传修饰、DNA损伤反应、肿瘤发生发展三者之间关系的研究,其中包括是否可通过调节组蛋白甲基化修饰状态改变肿瘤细胞对DNA损伤的反应,从而降低肿瘤的耐药性。磷酸化H2AX(serine 139,γH2AX)是反映DNA损伤的重要指标,为细胞发生最严重的DNA损伤—DNA双链断裂(DNA double- strand break, DSB)的标志[1]。对结肠癌的研究[2]显示,含Jumonji结构域的蛋白2B(Jumonji domain- containing protein 2B, JMJD2B)可通过STAT3信号通路调节DNA损伤反应,但JMJD2B在胃癌中是否也可通过调节DNA损伤反应影响肿瘤的发生发展,尚无相关研究。
1 材料与方法
1.1 材料
人胃癌细胞株MGC803、SGC7901来自惠州市中心人民医院消化实验室。胎牛血清及RPMI- 1640培养基购自美国Gibco公司。JMJD2B siRNA、阴性对照siRNA(与任何靶基因无序列同源性)购自上海吉玛公司。一抗:兔抗JMJD2B单克隆抗体(美国Bethyl Laboratories公司)、兔抗phorsphor- H2AX(Ser 139)多克隆抗体(美国Millipore公司)、兔抗α- tubulin抗体(内参照,美国Cell Signaling Technology公司);二抗:山羊抗兔 HRP(上海康成公司)。
1.2 方法
1.2.1 细胞培养 对MGC803、SGC7901细胞使用含10%胎牛血清的RPMI- 1640培养基培养,并置于恒温37 ℃、体积分数5% CO2的培养箱,95%湿度条件下进行培养。
1.2.2 siRNA转染 取对数生长期细胞种植于6孔板中,按细胞2×105孔-1进行接种,24 h后待细胞生长至密度约50%时,将JMJD2B siRNA或阴性对照siRNA使用转染试剂Lipofectamine 2000(美国Invitrogen公司)转染,48 h后收集细胞或进行后续实验。
1.2.3 彗星实验 采用0.25%胰蛋白酶消化对数生长期细胞,以1 000 r·min-1离心10 min,PBS调整细胞浓度为5×104ml-1。使用彗星实验试剂盒(Comet assay,北京博乐通生物科技有限公司),取100 μl 0.5%正常熔点琼脂糖铺于磨砂载玻片上,盖上盖玻片,置于冰上固化5~10 min;移去盖玻片,在第一层胶上铺上100 μl 0.5%低熔点琼脂糖与10 μl细胞悬液(约500个细胞)的混合液,盖上盖玻片,置于冰上固化5~10 min;移去盖玻片,细胞裂解2.5 h,电泳缓冲液中放置20 min使DNA解链,电泳25 min,中和,DAPI 染色,荧光显微镜下观察结果。
1.2.4 Western blotting 细胞转染JMJD2B siRNA或阴性对照siRNA 48 h后,以0.25%胰蛋白酶消化收集,离心抽提蛋白,BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司)进行蛋白定量。取50 μg蛋白,进行SDS- PAGE电泳分离,稳压冰浴电转至NC膜,5%脱脂奶粉常温封闭1 h,一抗4 ℃孵育过夜、二抗孵育1 h,常规ECL曝光,扫描蛋白条带,进行灰度分析。
1.2.5 Cell Counting Kit- 8(CCK- 8)实验 于96孔板中按5×103孔-1接种对数生长期的MGC803、SGC7901细胞,每孔200 μl,24 h 后待细胞生长至密度约50%时转染siRNA,分别于48、72 h后收集细胞进行CCK- 8实验。设不含细胞、只含培养基的空白组、阴性对照siRNA组和JMJD2B siRNA组,每组设3个复孔。按照CCK- 8试剂盒(日本同仁化学研究所)说明书操作,以酶标仪读取各孔450 nm波长处吸光度值(A值)。
1.2.6 细胞周期分析 培养MGC803、SGC7901细胞24 h至对数生长期,按阴性对照组、实验组分别转染siRNA 48 h,每组设3个复孔。用0.25%胰蛋白酶消化、收集细胞,预冷体积分数70%乙醇4 ℃固定过夜,PBS洗涤,加入100 U·ml-1RNA酶A(D202,TaKaRa公司)1 ml,37 ℃水浴30 min,加入含Triton X- 100(上海碧云天生物技术有限公司)的50 g·ml-1碘化丙啶染液(propidium iodide,PI,上海碧云天生物技术有限公司)0.5 ml,4 ℃避光30 min,进行流式细胞仪检测。
1.2.7 细胞凋亡分析 培养MGC803、SGC7901细胞24 h至对数生长期,按阴性对照组、实验组分别转染siRNA 48 h,每组设3个复孔。按照Annexin V Apoptosis Detection Kit I(美国BD Pharmingen公司)说明书操作,进行流式细胞仪检测。
1.3 统计学处理
2 结 果
2.1 沉默人胃癌细胞JMJD2B的表达诱导细胞发生DNA损伤反应
人胃癌细胞株MGC803、SGC7901于相同条件下培养,并分别给予阴性对照siRNA、JMJD2B siRNA的处理,采用Western blotting检测DNA损伤特异性标志物γH2AX的表达,同时应用彗星实验检测DNA损伤情况,结果均显示沉默JMJD2B表达的人胃癌细胞发生DNA损伤(图1)。

图1 沉默人胃癌细胞JMJD2B的表达诱导细胞发生DNA损伤反应
2.2 沉默人胃癌细胞JMJD2B的表达对增殖的影响
对转染JMJD2B siRNA的MGC803、SGC7901细胞行CCK- 8实验的结果显示,实验组相对存活率低于阴性对照组(图2),说明沉默JMJD2B表达的人胃癌细胞的增殖明显受到抑制。

图2 沉默人胃癌细胞JMJD2B的表达对细胞增殖的影响
2.3 沉默人胃癌细胞JMJD2B的表达对细胞周期分布的影响
对转染JMJD2B siRNA的MGC803、SGC7901细胞分别行流式细胞仪分析的结果显示,MGC803细胞发生G0/G1期细胞周期阻滞,而SGC7901细胞发生G2/M期细胞周期阻滞(图3),说明沉默JMJD2B表达诱导了细胞周期阻滞的发生,从而抑制细胞的增殖。
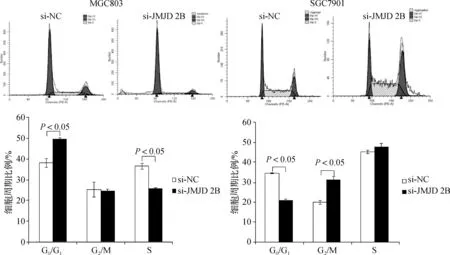
图3 沉默人胃癌细胞JMJD2B的表达对细胞周期的影响
2.4 沉默人胃癌细胞JMJD2B的表达对凋亡的影响
对转染JMJD2B siRNA的MGC803、SGC7901细胞行流式细胞仪分析的结果显示,凋亡细胞比例明显上升(图4),说明沉默JMJD2B的表达诱导了细胞发生凋亡,从而抑制细胞的增殖。

图4 沉默人胃癌细胞JMJD2B的表达对细胞凋亡的影响
3 讨 论
组蛋白甲基化修饰以及DNA损伤反应在肿瘤发生发展中的作用早有研究,近年来关于两者之间的相互关系在肿瘤中的研究[3- 4]越来越多。本研究结果显示,沉默人胃癌细胞组蛋白去甲基化酶JMJD2B的表达可诱导DNA损伤反应的发生(图1)。在肿瘤早期,人体细胞通过诱导DNA损伤反应来抑制肿瘤的发生发展,而DNA损伤反应则通过激活信号通路来维持基因组的稳定性,其中包括:(1) 由DNA损伤修复蛋白介导细胞进行DNA损伤修复,细胞发生周期阻滞;(2) 更严重的DNA损伤会进入p53介导的细胞凋亡途径[5]。人胃癌细胞发生DNA损伤反应后,导致细胞周期阻滞、细胞凋亡的细胞比例增加(图3、4)。然而,在肿瘤细胞中改变组蛋白甲基化修饰状态诱导DNA损伤的具体机制尚未阐明。
组蛋白甲基化修饰在DNA损伤反应的很多环节发挥重要作用,包括解开高度有序的染色质结构、启动细胞信号级联反应、募集蛋白质至DSB位点以及促进DNA断裂修复过程等。细胞发生DSB时,组蛋白翻译后修饰在诱导及调节细胞对损伤的反应中至关重要。沉默组蛋白甲基转移酶EZH2的表达可激活细胞发生DNA损伤反应[6],组蛋白甲基转移酶SET7和去甲基化酶LSD1均可通过调节UHRF1的甲基化水平在DSB修复中发挥重要作用[7]。H3K9me3去甲基化酶JMJD2D和JMJD2A通过下调H3K9me3的甲基化水平,抑制了Tip60激活ATM介导的DNA损伤反应,磷酸化ATM下调,其介导的p53和chk2磷酸化受抑制,DNA损伤反应异常,诱导细胞发生转化甚至癌变。抑制组蛋白去甲基化酶PHF2的表达可上调DNA复制相关基因启动子上H3K9me3的水平,诱导细胞发生DNA损伤[8- 9]。抑制JMJD2B可诱导DNA损伤反应介导的p21和PIG3的表达,同样,细胞发生DNA损伤后,JMJD2B作为p53的靶基因在调节DNA损伤反应中亦发挥重要作用[10]。
然而,组蛋白甲基化在DNA损伤反应及修复过程发挥作用的机制尚不十分清晰。细胞在受到电离辐射后会发生DNA损伤,通过抑制组蛋白去甲基化酶KDM2B的活性,组蛋白H3赖氨酸36二甲基化水平增加,DSB位点上含Ku70的DNA- PK募集增加,DNA损伤修复途径NHEJ被激活,发生放疗抵抗,细胞存活率提高[11]。接受电离辐射的细胞通过抑制JMJD2B或甲基转移酶SUV39H1的表达可延缓结构性异染色质DNA修复的进程,进而降低细胞存活率[12]。临床上,脑胶质瘤易复发,同时放化疗抵抗率高,而使用H3K9甲基转移酶G9a特异性抑制剂BIX- 01294可提高胶质瘤细胞的放疗敏感性,其机制包括抑制DSB的修复[13],促进肿瘤细胞死亡。目前使用的很多化疗药属于DNA损伤药物。Mar等[14]报道,组蛋白甲基转移酶SETD2突变可通过影响细胞对DNA损伤的识别,诱导细胞对DNA损伤药物的耐药性。组蛋白甲基转移酶MMSET调节H4K20甲基化水平,有利于53BP1募集至DSB位点[15];同样,抑制H3K79甲基转移酶DOT1L的表达,也抑制了53BP1募集至DSBs位点[16- 17],细胞发生DNA损伤,利用该特点在结直肠癌细胞中使用siRNA或小分子抑制剂抑制DOT1L的表达可通过调节DNA损伤修复途径,提高肿瘤细胞对化疗药的敏感性[18]。
JMJD2B是抗肿瘤药物作用的重要靶点[19]。在耐顺铂的人非小细胞肺癌[20]细胞中,JMJD2家族,特别是JMJD2B的表达明显上调,而使用JMJD2家族蛋白的特异性抑制剂可增加癌细胞对顺铂的反应[21]。本研究结果显示,抑制JMJD2B可诱导人胃癌细胞发生DNA损伤,抑制癌细胞的恶性表型。因此,进一步深入研究JMJD2B与DNA损伤反应之间的关系和机制,有望可减少肿瘤的放化疗抵抗性。

