肝细胞癌组织中基质金属蛋白酶14的表达及其与预后的关系
杨涛,苏忠,杨奕,刘剑,李高岩
(秦皇岛市第一医院 普外科,河北 秦皇岛 066000)
肝细胞癌(hepatocellular carcinoma,HCC)是常见的消化道肿瘤之一,其发病机制尚未完全明确,严重影响人的生命健康并给家庭及社会带来沉重的负担。HCC具有易侵袭、易转移的特点,虽然近年来肝癌的诊疗技术有了飞速发展,但是HCC患者5年生存率仍未见明显提高[1]。寻找HCC新型分子生物学标志物是基础及临床研究的重点。既往研究发现,细胞外基质(extracellular matrix,ECM)的蛋白水解是肿瘤浸润和转移的关键步骤,而基质金属蛋白酶14(matrix metalloprotease 14,MMP14)被证实在此过程中发挥重要作用[2]。MMP14也被称为膜型1 MMP(MT1- MMP),是MMP家族新成员,能够参与细胞基底膜和ECM的降解,促进肿瘤细胞的侵袭和转移[3]。MMP14通过上皮间质转化参与HCC的侵袭和远处转移[4]。本研究旨在探讨HCC组织中MMP14的表达水平及其与患者预后的关系。
1 材料与方法
1.1 样本来源
选取2008年6月至2013年5月本院手术切除的248例HCC癌组织标本及其配对的癌旁组织标本(距离癌组织边缘≥5 cm)。纳入标准:(1) 术前未接受放疗、化疗或免疫治疗;(2) 术后病理学检查确诊为HCC;(3) 病历资料完整。排除标准:(1) 合并其他部位肿瘤;(2) 随访资料不全。其中男173例,女75例;年龄43~71岁,平均(53.78±16.09)岁;HBsAg阳性179例;有肝门淋巴结转移140例;低分化139例,中高分化109例;TNM分期为Ⅰ~Ⅱ期111例,Ⅲ~Ⅳ期137例。将术中切取的组织分成两部分:一部分冻存于-70 ℃冰箱,用于Western blotting检测;另一部分用福尔马林固定并用石蜡包埋,用于免疫组织化学染色。
1.2 Western blotting检测组织中MMP14的表达水平
随机选取6例HCC癌组织及其配对的癌旁组织进行检测。取组织100 g,冰上充分研碎后加入蛋白裂解液(武汉博士德生物工程有限公司),以12 000 r·min-1离心15 min,收集上清液。用BCA试剂盒(美国Pierce公司)检测蛋白浓度,随后进行10% SDS- PAGE凝胶电泳,将蛋白转移至PVDF膜上。用脱脂奶粉封闭1 h,孵育一抗(MMP14单克隆抗体,稀释500倍,美国Sigma公司),4 ℃过夜后弃去一抗。温室孵育二抗(羊抗兔IgG,稀释2 000倍,美国Sigma公司),2 h后弃去二抗。以GAPDH作为内参,用ECL发光仪成像,最后采用Image J软件分析灰度值,计算蛋白相对表达量。
1.3 免疫组织化学染色法检测组织中MMP14表达水平
石蜡切片由本院病理科制备,切片厚度为4 μm。检测所有HCC癌组织及癌旁组织中MMP14的表达水平。检测时常规脱蜡至水,随后放入预热的柠檬酸缓冲液中,高压处理2 min,冷却至室温。滴加3%过氧化氢溶液除去内源性过氧化物酶,温室孵育10 min。滴加MMP14单克隆抗体(稀释500倍),4 ℃过夜。滴加生物素标记的羊抗兔IgG。最后用DAB显色,苏木紫复染,常规脱水、透明、干燥、封片。在显微镜下观察细胞染色强度和阳性细胞比例。染色强度:阴性为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。阳性细胞比例:0%~10%为1分;11%~50%为2分;51%~80%为3分;81%~100%为4分。将以上两个评分相乘,0分为MMP14阴性表达;1~3分为弱阳性表达;4~8分为中等阳性表达;9~12分为强阳性表达。0~3分为MMP14低表达;4~12分为MMP14高表达。
1.4 随访
术后对所有患者进行门诊及电话随访。前2年每3个月随访1次;第3年后每半年随访1次。随访时进行血清甲胎蛋白、腹部B超、CT或MRI检查。随访截至2019年7月。
1.5 统计学处理
应用SPSS 20.0统计软件进行分析。计量资料以均值±标准差表示,两组间比较用t检验;计数资料的比较用卡方检验。生存分析用Kaplan- Meier法,建立Cox比例风险回归模型分析影响HCC的因素。P<0.05为差异有统计学意义。
2 结 果
2.1 Western blotting检测组织中MMP14的表达
HCC癌组织中MMP14蛋白相对表达量为0.91±0.08,明显高于癌旁组织的0.24±0.08(P<0.05),见图1。

1.癌组织;2.癌旁组织
2.2 免疫组织化学染色法检测组织中MMP14
MMP14主要定位于细胞质中,在癌组织中高表达,在癌旁组织中呈阴性或弱阳性表达(图2)。癌组织中MMP14表达率为62.10%(154/248),明显高于癌旁组织的26.61%(66/248),差异有统计学意义(χ2=63.258,P<0.001)。

A.癌旁组织;B.癌组织
2.3 癌组织中MMP14表达与HCC临床病理特征的关系
MMP14与HCC分化程度及TNM分期有关(P<0.05),与性别、年龄、HBsAg、甲胎蛋白水平、肿瘤大小、肿瘤数量和肝门淋巴结转移无关(P>0.05),见表1。
2.4 影响HCC患者预后的单因素和多因素分析
以患者是否存活或是否无瘤存活作为因变量,性别、年龄、肿瘤大小、甲胎蛋白水平、HBsAg、肿瘤数量、肝门淋巴结转移、分化程度、临床分期和MMP14表达水平为自变量,进行Cox多因素分析。结果显示,肿瘤低分化、高TNM分期和MMP14高表达是HCC患者总生存期和无瘤生存期的独立影响因素(P<0.05),见表2、3。
2.5 MMP14与HCC患者生存预后的关系
MMP14高表达患者的总体生存时间和无瘤生存时间明显短于低表达患者(P值分别为0.008和0.004,Log- Rank检验),见图3。
3 讨 论
肝癌是消化系统最常见的恶性肿瘤,死亡率较高,其发病与遗传、环境、病毒感染、体质等有关。肝癌患者预后较差的原因是复发和转移,而MMP又与两者密切相关。因此,探讨MMP与肝癌临床病理特征及预后的关系有重要意义。MMP是一组锌依赖性内肽酶,除可以降解细胞外基质外,还可以作用于蛋白激酶、生长因子、细胞表面分子和细胞趋化因子等[5]。MMP在生理状态及癌症进展时细胞外基质重塑过程中起重要作用[6]。MMP14也被称为MT1- MMP,是MMP家族新成员,被认为是MMP家族中与肿瘤浸润和转移最为相关的酶[7]。MMP14与宫颈癌[8]、胃癌[9]、结直肠癌[10]、肺癌[11]等的发生及发展有关。本研究结果显示,HCC癌组织中MMP14蛋白表达水平明显高于癌旁组织,并且其表达水平与HCC分化程度、TNM分期有关,提示MMP14可能参与了HCC的发生和进展。

表1 MMP14与HCC临床病理特征的关系例
肿瘤的进展与肿瘤细胞的增殖、侵袭及转移有关。MMP14参与肿瘤进展的机制[12- 15]可能为:(1) 降解Ⅰ~Ⅲ型胶原、纤维粘连蛋白、蛋白多糖和纤维素等细胞外基质;(2) 激活MMP2、MMP13,使蛋白水解效应放大;(3) 通过与细胞黏附分子作用,影响细胞在细胞外基质上的迁移;(4) 上调血管生成因子表达,促进血管形成,进而促进肿瘤浸润和转移;(5) 促进上皮间质转化,进而影响肿瘤细胞的侵袭和迁移。
影响HCC预后的因素较多。本研究发现,肿瘤低分化、高TNM分期是HCC患者总生存期和无瘤生存期较短的独立影响因素。这与既往报道[16- 18]一致。增殖和侵袭是影响癌症患者生存预后的重要因素,而MMP14又参与了此过程,因此MMP14可能有助于预测HCC的预后。MMP14与结直肠癌[10]、膀胱癌[19]、胃癌[9]及乳腺癌[20]等的生存预后有关。本研究同样发现,高MMP14表达的HCC患者的生存预后较差,并且MMP14是影响HCC患者总生存期和无瘤生存期的独立因素。
在治疗方面,MMP14与乳腺癌放疗及化疗的敏感性有关[21]。Ager等[22]也发现,阻断MMP14可降低免疫抑制性转化生长因子β,抑制小鼠乳腺癌肿瘤生长,并且对放疗的反应性增强。因此,可以推测,MMP14可能与HCC的放化疗敏感性有关,但是本研究并未对此进行分析,需要未来进一步探讨。

表2 HCC患者总生存期的单因素和Cox多因素分析
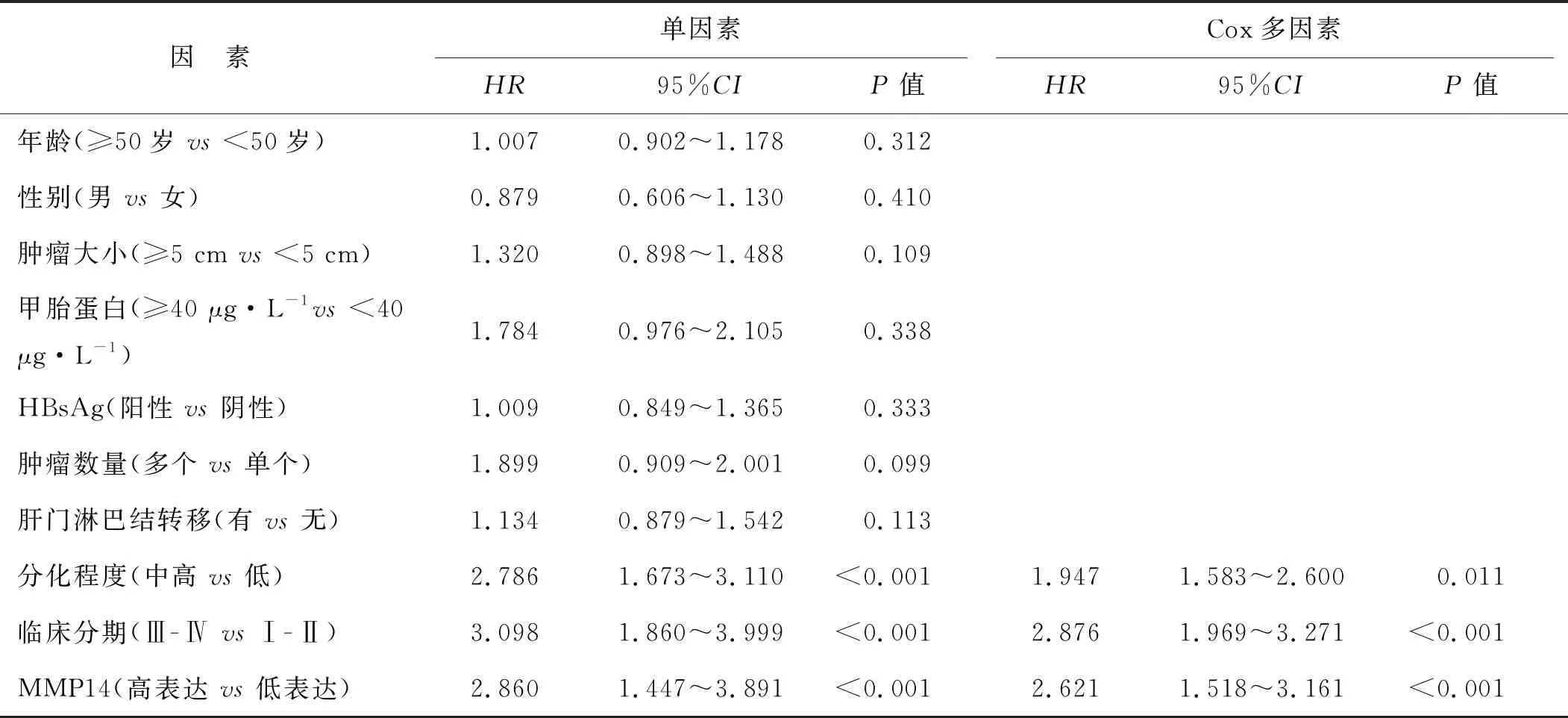
表3 HCC患者无瘤生存期的单因素和Cox多因素分析

图3 MMP14与HCC患者总生存期及无瘤生存期的关系(Kaplan- Meier生存曲线)
综上所述,HCC癌组织中MMP14表达水平明显高于癌旁组织。MMP14表达水平与HCC分化程度及TNM分期有关。MMP14是HCC预后的独立影响因素,其表达水平越高,患者总生存期和无瘤生存期越短。本研究也存在一些局限性:未检测患者血清中MMP14的表达水平,MMP14早期诊断及鉴别诊断HCC的价值须进一步分析;未探讨MMP14在HCC中的作用机制,需要今后深入分析。

