肺叶切除术患者中心静脉导管相关性血栓形成的危险因素分析
樊孟涛 龙勇 苏彦河
中心静脉置管(Central venous catheters,CVC)在肺叶切除术患者中应用广泛[1],用以建立稳定的静脉通路,监测中心静脉压,提供快速输血、输液,可以指导治疗和评估疗效。其主要并发症有导管感染、导管堵塞、气胸、血肿、空气栓塞及静脉血栓形成等。导管相关性血栓(CRT)是置管后比较常见的并发症。CVC 过程中损伤血管壁、导管置入后所致的湍流及血流减缓等多种因素可促使血栓形成,其发生不仅可以导致导管功能丧失及深静脉血栓形成,严重时血栓可能脱落导致肺栓塞症,危及患者生命[2]。本研究旨在分析CRT 发生的危险因素,为其早期预防及治疗提供临床依据。
1 材料与方法
1.1 一般资料回顾性分析我院胸外科2019年1月~2020年6月行肺叶切除术治疗并置入CVC 的患者119例,其中男80例,女39例,年龄36~84岁。根据有无血栓形成分为血栓阴性组(n=58)和血栓阳性组(n=61)。纳入标准:①年龄≥18岁;②导管留置时间≥72h;③经验丰富的麻醉科医师术前置入右侧颈内静脉或右侧锁骨下静脉。排除标准:①既往有血栓史;②伴有严重血液系统疾病;③术前使用过相关抗凝药物;④术前进行放化疗。本研究经医院伦理委员会批准,术前告知患者置管及拔管风险并签署知情同意书。
1.2 CVC置管方法 手术均为全身麻醉,并于术前在超声引导下完成CVC 置管。具体方法:患者麻醉成功后,去枕平卧,右肩背部垫高,头后仰并轻度左偏,充分伸展颈部,消毒右侧颈部至锁骨下侧。对患者右侧颈内静脉及锁骨下静脉进行超声检查,观察有无血管本身病变(血管狭窄、血栓形成等),了解血供情况或与重要血管的关系,筛选出较为合适的静脉。术者左手食指与中指于胸锁乳突肌中点前缘触及颈总动脉搏动,选颈总动脉外缘0.5cm处为穿刺点,穿刺进针方向与皮肤呈30°~40°,针尖指向同侧乳头;或者选择锁骨中点内下1cm 处为穿刺点,穿刺进针方向与同侧胸锁关节方向与冠状平面成15°~30°。CVC 均采用由聚氨酯材料制成(规格:2.3mm×20cm;Lepu medical,中国)的含药双腔导管,内含利福平、盐酸米诺环素,再用Seldinger穿刺技术将导管置入。穿刺过程保持负压,抽出暗红色血液证实进入静脉腔内,取金属导丝送入血管腔,扩张皮肤隧道、导入静脉留置导管,拔除导丝,以注射器回抽证实无误后生理盐水冲净管腔,以肝素帽封闭末端,导管皮肤缝合固定,穿刺点以3M 透明敷料覆盖。置入后超声再次确认导管位置是否正确。记录置管位置、穿刺次数、置管是否顺利。术后均由护士按照标准及操作规范护理,以避免发生导管相关性感染,经导管输液及采血时要严格无菌操作,穿刺部位每日消毒换药,观察有无红肿及脓性分泌物。为避免CRT 形成堵塞导管,采血及输液后使用浓度为10U/ml 的肝素钠行脉冲式冲管,正压封管,封管前常规评估导管功能。
1.3 观察指标术前收集并记录患者的姓名、年龄、体质指数(BMI)、D-二聚体(D-D)及纤维蛋白原(FIB)水平,术后收集并记录手术类型、手术方式、手术时间。密切观察患者置管周围情况及患者临床症状,直至拔管,同时记录拔管时间。CRT 的诊断标准:拔除导管后观察并立即剖开导管确定有无导管内血栓(静脉导管腔内和尖端的血栓)形成,统计血栓发生率。
1.4 统计学方法数据均应用SPSS 25.0 软件进行统计分析,均为双侧检验。计量资料用表示,服从正态分布者采用独立样本t检验进行组间比较;不服从正态分布者采用Mann-Whitney U 检验进行组间比较;计数资料用率(%)表示,采用χ2检验进行组间比较。以P<0.05 为差异具有统计学意义。将单因素分析中具有统计学意义的变量进行二元Logistic回归分析,筛选出肺叶切除术后患者中心静脉导管相关性血栓形成的独立危险因素。
2 结果
2.1 血栓发生率术后CRT 的发生率为51.26%(61/119);其中仅有3例出现了临床症状,发生率为2.52%(3/119),1例表现为右上肢疼痛伴轻度水肿,1例导管完全堵塞,局部疼痛伴肿胀、肤色发红、皮温增高,另1例诊断为肺栓塞(期间出现胸痛、呼吸困难症状),经正规溶栓治疗后未发生致死性事件。血栓大小0.8~39mm,平均(12.06±12.67)mm。
2.2 单因素分析两组患者性别、BMI、手术时间及FIB水平比较差异无统计学意义(P>0.05)。年龄、手术类型、手术方式、置管静脉位置、置管时间、D-D水平比较差异具有统计学意义(P<0.05),见表1。
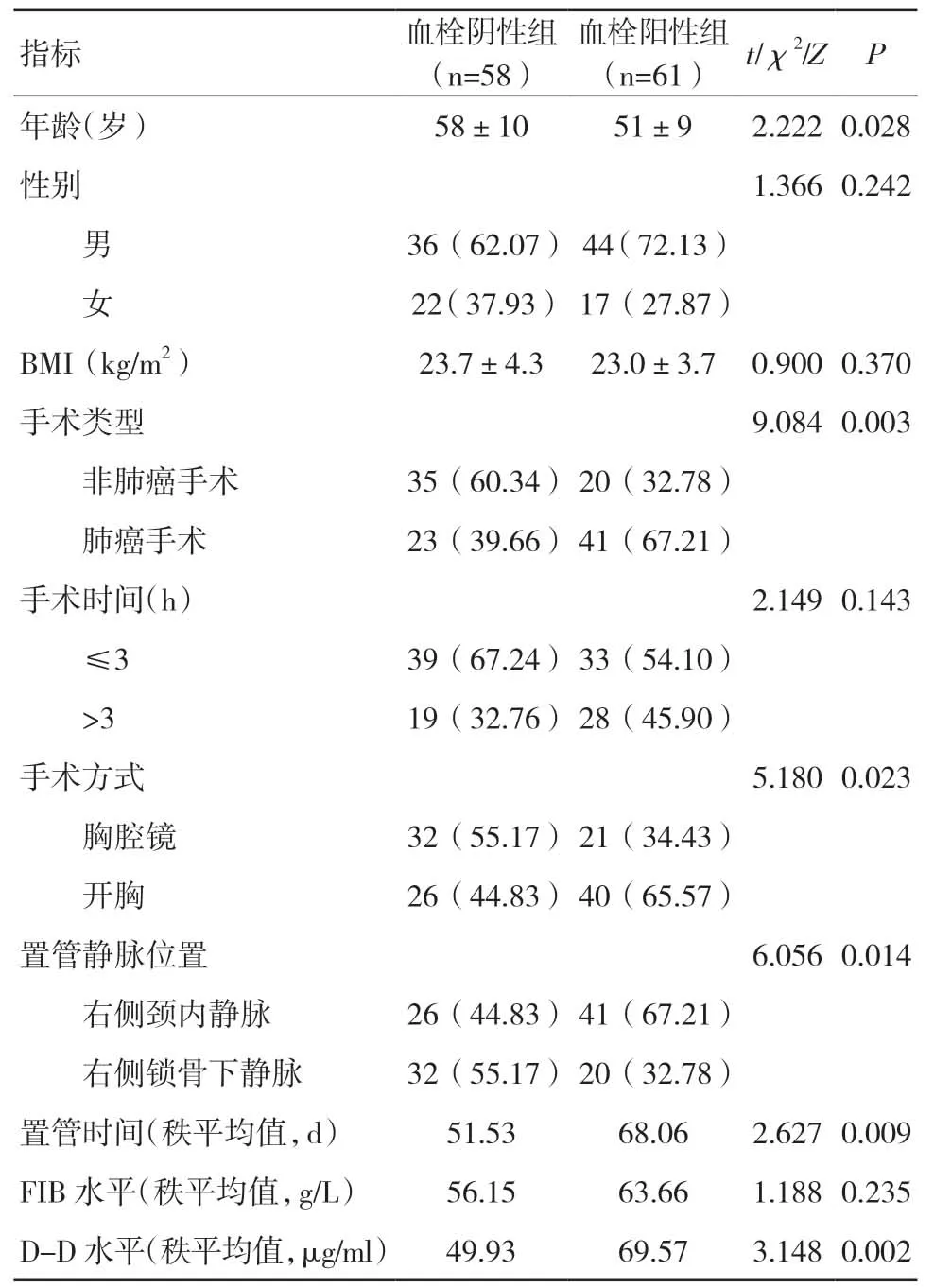
表1 单因素分析[n(%)]
2.3 二元Logistic回归分析将单因素分析中差异具有统计学意义的变量进行二元Logistic回归分析,D-D水平、手术类型及置管静脉位置均为肺叶切除术后中心静脉导管相关性血栓形成的独立危险因素(P<0.05),见表2。
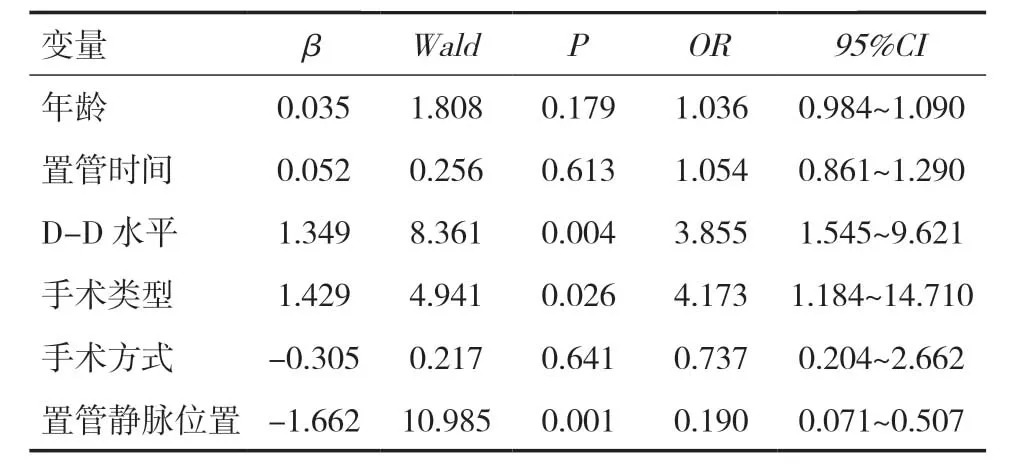
表2 二元Logistic回归分析
3 讨论
CVC 在胸外科围手术期中应用广泛,但是临床工作中对CRT 关注度不高。目前报道的CRT 的发生率差异较大,可能受研究结果、患者群体、导管相关因素和操作、治疗相关因素等影响。朱晓刚等[3]对112例腹部手术患者研究发现腹部手术患者导管相关性右颈内静脉血栓的发生率为12.8%;Zhou等[4]对接受CVC 的1 532例患者回顾性研究发现CRT 的发生率为1.83%。本研究CRT 的发生率为51.26%,均高于上述两项研究,可能与本研究患者年龄低于50岁的比例高、肺癌患者比例高及导管留置时间长相关。仅有1%~5%的CRT 患者会出现明显的症状,但仍可导致深静脉血栓(DVT)形成、肺栓塞和血栓形成后综合征(PTS)以及导管功能丧失、感染和潜在治疗延误[5]。而本研究有症状的CRT 发生率为2.52%,与其他研究结果大致相符[6]。Ellis 等[7]通过对需CVC 的3 130 成年癌症患者研究发现颈内静脉CRT 形成风险大约是锁骨下静脉导管的4 倍。本研究锁骨下静脉CRT 的发生率明显低于颈内静脉[OR=0.190,95%CI(0.071,0.507)]。这可能因颈内静脉随体位活动及结构等因素易于萎陷造成相应血管壁直接机械性损伤,容易导致血栓形成[8];头颈部运动时导管运动对血管壁造成较大的机械损伤,与颈内静脉置管相比,锁骨下静脉置管并发症发生率低也可能与锁骨下静脉置管位置固定受身体活动影响小,相关感染风险低等相关[9]。Hrdy 等[10]对入住ICU 并置入CVC 的危重症患者进行前瞻性分析,建议优先在锁骨下静脉插管,而不是颈内静脉,以降低CVC 相关性DVT 形成的风险。
目前多数研究报道了CRT 形成的危险因素,尚未形成一致意见。Leung 等[11]通过Meta 分析提示年龄、恶性肿瘤、肥胖等是CRT 形成的重要危险因素。成芳等[12]也认为恶性肿瘤是导致血栓形成的重要危险因素。更有报道称恶性肿瘤患者的DVT形成风险明显增加,接受手术可能叠加风险[13,14]。恶性肿瘤患者机体往往处于血栓前状态[15],但其对CRT 的影响尚无统一定论。本研究报道血栓阳性组接受肺癌手术患者比例明显高于血栓阴性组,提示肺癌是CRT 发生的重要危险因素之一。
开胸手术相比于胸腔镜手术创伤大,术后恢复时间长,术后疼痛导致卧床时间长,这可能是CRT高发的原因。同时肺叶切除术损伤重要血管,释放凝血因子,增加了血栓形成的风险。目前证据表明CRT 风险的增加与导管留置时间存在必然联系[16]。有研究认为导管留置时间越长,CRT 的发生率就越高。本研究中亦可以看出随着置管时间的延长,CRT 的发生率相应升高。
Nañez-Terreros 等[17]通过48例癌症患者无症状中心静脉导管相关性血栓发生的原因进行分析,并测定CVC 和外周静脉血中D-D水平发现,D-D是FIB 降解产物之一,其阴性结果对血栓性疾病的排除有参考价值,但D-D水平检测对 CRT 的诊断价值有限。范华颖等[18]通过回顾性分析186例行外周CVC 的肺癌化疗患者研究发现,D-D水平是反映术前凝血状态或血栓形成的重要且敏感指标,是纤溶过程标记物,反映FIB 溶解功能,其水平升高说明继发性纤溶活性增强,意味着机体处于高凝状态,且其水平升高对静脉血栓形成早期具有参考意义。本研究中,血栓阳性组的D-D水平明显高于血栓阴性组(P<0.05)。急性心肌梗死、重症感染、脑出血、恶性肿瘤、近期手术等情况均可导致D-D水平增高,且急性DVT、肺血栓栓塞症(PTE)时D-D水平异常增高,故对D-D水平的动态监测在临床格外重要。
本研究发现术前D-D水平异常增高、肺癌患者手术及右侧颈内静脉置管均为肺叶切除术后中心静脉导管相关性血栓发生的独立危险因素。肺叶切除围手术留置CVC患者中,尤其是恶性肿瘤患者及术前D-D水平异常增高患者,置管前应全面评估患者病情,严密观察患者局部状况,警惕导管相关性感染及脓毒血症的发生,可疑CRT 发生时建议行血管超声检查以排除血栓,及时纠正高凝状态和血栓形成倾向,部分患者可预防性抗凝治疗,控制液体输注速度。加强胸外科手术患者的CRT 管理,鼓励胸外科手术患者置管后使用各种非药物方式预防血栓,包括尽早适度地活动肢体,置管侧肢体进行日常活动以及轻度的肢体锻炼(例如握拳运动),补充足够的水分。尽可能缩短CVC 置管时间,根据情况拔管,拔管动作轻柔,以免血栓脱落造成肺栓塞。尽可能减少CRT 形成及其并发症的发生。对于无症状的附壁血栓,是否需要进一步治疗和处理目前尚无定论。冯文浩等[19]认为对于无症状的附壁血栓可不予常规抗凝治疗。也有报道称尚无明确的临床证据支持无症状血栓需要治疗[20],建议无症状血栓给予观察及随访;DVT 首选抗凝作为核心治疗手段[21]。虽然低分子肝素可用于预防静脉血栓栓塞,但其对CRT 发生率的影响尚不明确[22]。绝大多数CRT 患者不需溶栓治疗。抗凝治疗期间要密切观察患者局部症状和体征,观察有无全身出血倾向和肺栓塞等并发症,并定期监测凝血功能和复查血管超声造影。
本研究数据统计样本量不大,结论具有一定的局限性,需要未来更大样本数据用于此研究结论的验证。并且CRT 的一些影响因素(如导管尖端位置、静脉穿刺次数以及术后抗凝相关因素分析等)因为统计局限未纳入,这些未收集的因素对肺叶切除术患者CRT 发生率的预测价值需要进一步的回顾性研究。
综上所述,肺叶切除术后中心CRT 发生率较高,术前D-D水平增高、肺癌患者手术及颈内静脉置管是肺叶切除术后中心静脉导管相关性血栓形成的独立危险因素,右侧锁骨下静脉置管是肺叶切除术后降低中心静脉导管相关性血栓发生率的较合适选择。

