肌筋膜疼痛综合征患者25羟基维生素D水平及危险因素分析
潘帅 郭安梅
肌筋膜疼痛综合征(myofascial pain syndrome,MPS)是一种全身性慢性疼痛疾病,临床表现为躯干或四肢肌肉酸胀疼痛、僵硬、运动受限及无力等,以局部肌肉紧张、有一个或多个触发点、牵涉痛甚至局部肌肉跳动为特征的疾病[1]。近年研究发现,维生素D 除了参与钙、磷代谢和调节机体免疫功能,同时在维持肌肉健康中发挥着重要作用,血清25羟基维生素D[25-(OH)D]水平是反映机体维生素D代谢情况的重要指标,临床研究发现大多数非特异性肌肉骨骼疼痛患者血清25-(OH)D水平存在不同程度的下降[2~4],但目前MPS 的病因及发病机制尚不明确,并缺乏可靠的评估指标及预防措施。因此本研究通过检测血清中25-(OH)D水平,探讨其对MPS 的影响,并分析MPS患者发病的危险因素,以尽早识别此类疾病,发现相关危险因素进行早期干预以防止或延缓患者病情进展。
1 材料与方法
1.1 临床资料选取2018年10月~2020年8月就诊于我院疼痛科的85例MPS患者为研究对象并作为MPS组,同时选取来我院体检的85例健康者作为对照组,MPS组和对照组的性别、年龄和BMI 比较差异均无统计学意义(P>0.05),具有可比性,见表1。患者入院后,将MPS患者按照25-(OH)D水平分为:严重缺乏组(<25.00nmol/L)、轻度缺乏组(25.00~49.99nmol/L)、不足组(50.00~74.99nmol/L)、正常组(≥75.00nmol/L)[5]。本研究经石河子大学医学院第一附属医院伦理委员会批准通过,参与者均自愿参与研究且签署知情同意书。
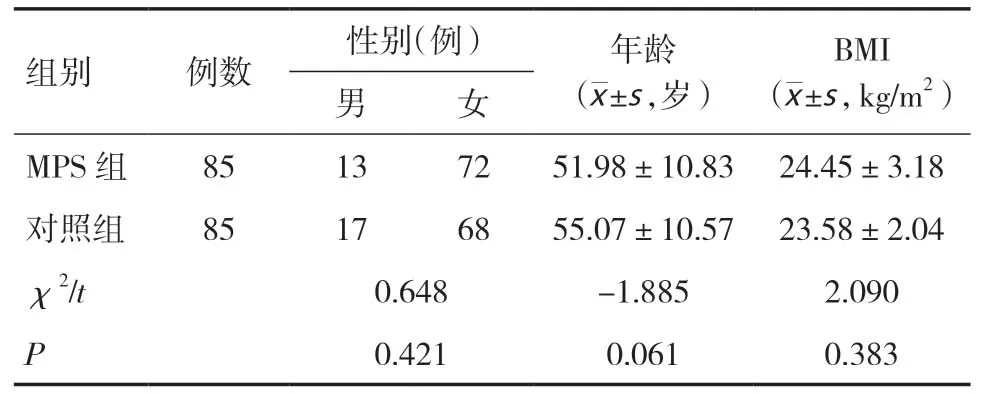
表1 两组一般资料比较
1.2 纳入与排除标准纳入标准:年龄18~80岁,汉族,符合MPS 诊断标准的患者[6]。排除标准:①有免疫性或代谢性疾病病史者;②慢性消化系统、血液、肺、心脏、血管、内分泌和肾脏疾病者;③近1年内服用维生素、钙、类固醇、抗惊厥药物及节食者;④限制体力活动者;⑤病程超过2年或已有并发症的糖尿病患者;⑥严重骨质疏松或有其他肌肉骨骼疾病者;⑦恶性肿瘤患者和近1个月服用过止痛药者。
1.3 观察指标
1.3.1 一般信息 将符合纳入与排除标准的参与者进行问卷调查以收集以下信息,人口统计学特征:姓名、性别、年龄、身高、体重、民族、职业;生活方式:环境潮湿(是/否)、饮食习惯(荤/素/均衡)、户外活动时间(每日户外运动时间是否大于30min)、吸烟饮酒(是/否)等。
1.3.2 临床指标 由研究者对患者进行问诊查体并记录病程,疼痛强度采用视觉模拟评分量表(Visual analogue scale,VAS)对患者的疼痛程度进行评估,采用一把从左到右依次标记“0~10”数字的刻度尺,随着数字的不断增大表示疼痛的程度随之加重,0 为无疼痛,10 为极度疼痛。健康调查简表(SF-36)评分用于评估患者生活质量,通过生理功能、躯体疼痛、精神状况、社会关系、总体健康5个项目评估患者生活质量,满分100分,评分越低患者生活质量越差。
1.3.3 实验室指标 清晨采集患者空腹状态下的静脉血5ml,离心分离血清送往我院检验科实验室进行检测,血清25-(OH)D水平的测定使用液相串联质谱法;PTH 测定采用酶联免疫法测定;血清钙、磷等离子水平采用离子电极法测定;采用免疫比浊法测定C反应蛋白(C-reactive protein,CRP)水平;采用ELISA 测定红细胞沉降率水平(Erythrocyte sedimentation rate,ESR)。操作均严格按照试剂盒、仪器说明书及科室SOP 操作规程进行,由同一专业人员成批检测,确保结果的准确性和可比性。
1.4 统计学方法采用SPSS 21.0 统计学软件进行分析,计数资料采用χ2检验,正态分布计量资料采用表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析;偏态分布计量资料采用M(P25,P75)表示,比较采用Kruskal-Wallis 检验;采用Pearson 检验分析25-(OH)D 与疾病严重程度的相关性;MPS患者的发病影响因素分析采用Logistic回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清25-(OH)D分布情况比较MPS组患者中,25-(OH)D 严重缺乏15例(17.65%),轻度缺乏57例(67.06%),不足11例(12.94%),正常2例(2.35%);对照组25-(OH)D 严重缺乏1例(1.18%),轻度缺乏23例(27.06%),不足48例(56.47%),正常13例(15.29%)。MPS组25-(OH)D水平严重缺乏和轻度缺乏者明显多于对照组(P<0.05),且正常者明显少于对照组(P<0.05),两组差异均具有统计学意义(P<0.05)。
2.2 两组实验室指标比较MPS组血清25-(OH)D水平较对照组明显降低,MPS组血磷水平较对照组偏高,两组差异均有统计学意义(P<0.05),两组的PTH、血钙水平比较差异无统计学意义(P>0.05),见表2。
2.3 MPS患者临床指标比较4 组MPS患者病程、VAS评分、SF-36评分、ESR 水平比较差异均具有统计学意义(P<0.05),4 组CRP水平比较差异无统计学意义(P>0.05)。严重缺乏组的病程明显长于不足组和正常组(P<0.05),轻度缺乏组的病程明显长于正常组(P<0.05),严重缺乏组的ESR 水平、VAS评分明显高于轻度缺乏组、不足组和正常组(P<0.05),严重缺乏组、轻度缺乏组的SF-36评分明显低于不足组和正常组(P<0.05),见表3。
表2 两组实验室指标比较()
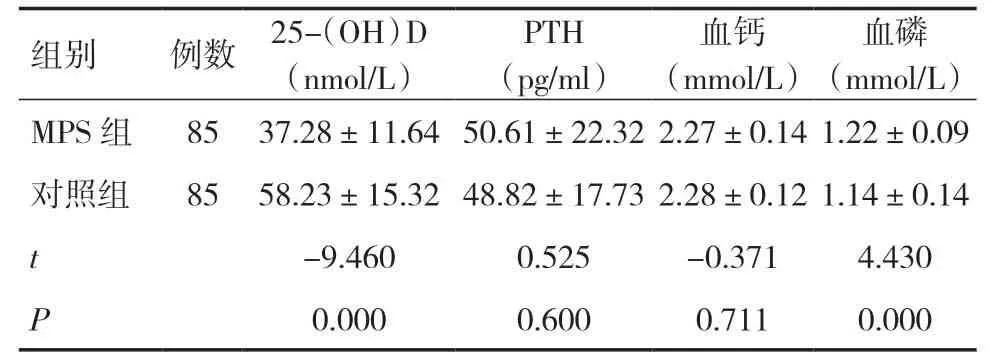
表2 两组实验室指标比较()
组别例数 25-(OH)D(nmol/L)PTH(pg/ml)血钙(mmol/L)血磷(mmol/L)MPS组 85 37.28±11.64 50.61±22.32 2.27±0.14 1.22±0.09对照组 85 58.23±15.32 48.82±17.73 2.28±0.12 1.14±0.14 t-9.460 0.525 -0.371 4.430 P 0.000 0.600 0.711 0.000

表3 MPS患者临床指标比较
2.4 25-(OH)D水平与疾病严重程度的相关性MPS组中严重缺乏组、轻度缺乏组、不足组、正常组的VAS评分分别为(5.73±0.79)分、(4.84±1.07)分、(4.27±0.78)分、(4.12±1.10)分,Pearson 相关分析结果显示,MPS患者的25-(OH)D水平与VAS评分呈中等程度的负相关(r=-0.541,P<0.05)。
2.5 MPS发病影响因素的Logistic回归分析以研究对象是否发生MPS 为因变量,一般资料、实验室指标为自变量,进行单因素分析,结果显示,性别、体质指数(BMI)、25-(OH)D水平、户外活动时间、环境潮湿、血磷水平是发生MPS 的影响因素(P<0.05),见表4。由于纳入实验对象的血磷全部在正常范围内,存在差异可能是由于发生偏倚,实际临床研究意义不大,故排除,选取其他相关因素进行Logistic回归结果显示,女性、超重/肥胖、环境潮湿、户外活动时间、25-(OH)D水平是发生MPS的独立危险因素,见表5。

表4 MPS发病影响因素的单因素分析[n(%)]
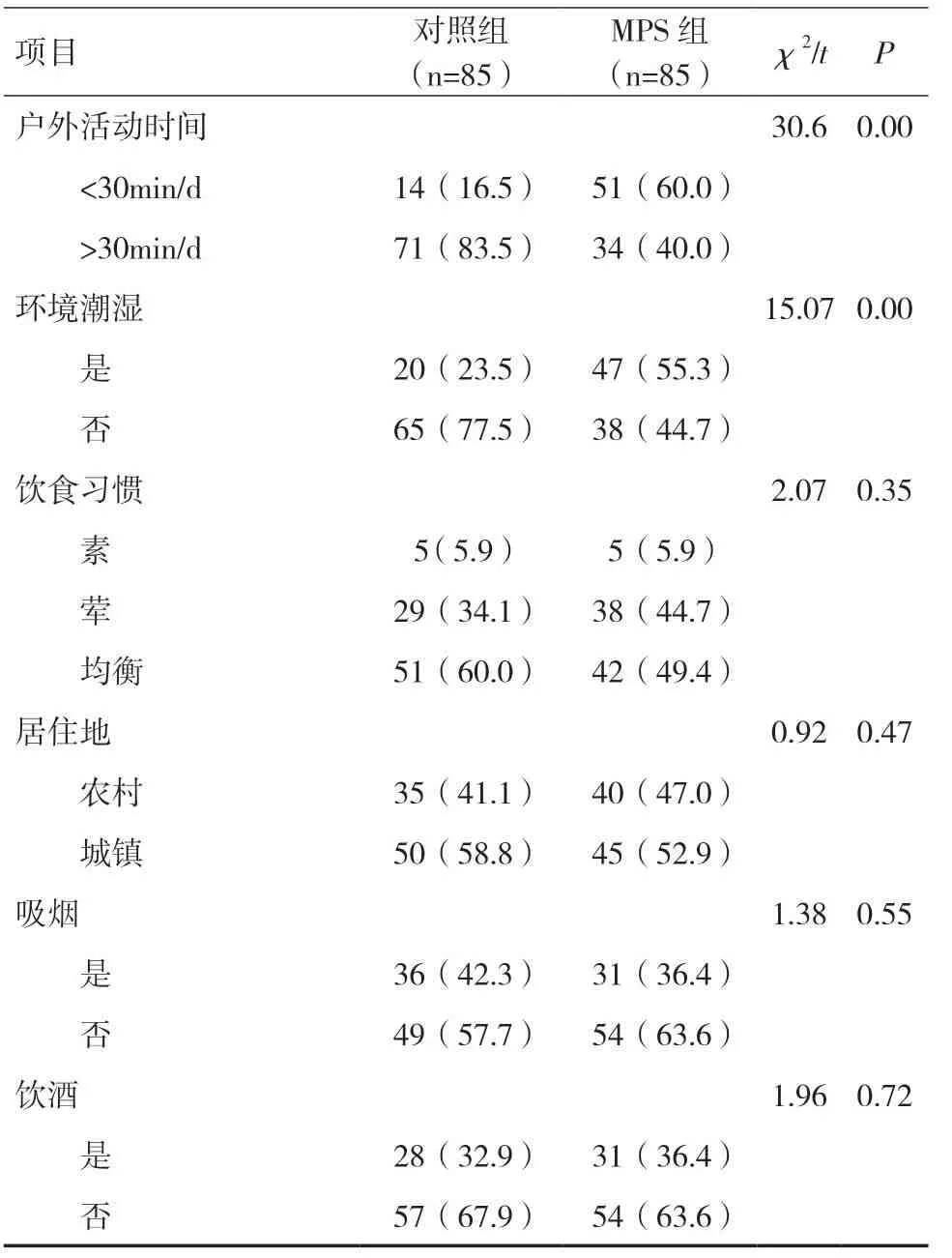
续表4

表5 MPS发病危险因素的Logistic回归分析
3 讨论
MPS是疼痛科最常见的疾病之一,据国外研究报道,国外疼痛中心的患者约有85%初步诊断为MPS[7],该病发病人群年龄跨度大,病情缠绵,治疗费用较高,不仅对患者身体造成影响,严重者同时会影响心理健康(如过度焦虑、失眠等)[8],并有较高的复发率,由于该疾病早期症状轻,难以得到重视,往往延误治疗使病情进展。
近年来,维生素D 缺乏是一个世界性的健康问题,全球大约有10亿人深受其害,欧美一些国家对其水平与肌肉骨骼疾病进行了部分研究,结果表明两者之间存在相关性[9],但他们的研究对象基本为白种人和黑种人,关于黄种人的研究非常少,所以我们进行了这项研究。
研究通过对25-(OH)D缺乏程度进行检测,进一步探讨维生素D 与MPS发病的关系,结果发现,肌筋膜炎患者的血清25-(OH)D水平分布主要集中于缺乏范围,正常人25-(OH)D水平也处于亚健康水平,主要集中于不足范围,但MPS患者25-(OH)D水平明显低于正常人,这说明在MPS患者体内维生素D水平呈现下降趋势。MPS患者血钙水平与健康人无明显差异,而血磷水平略高于健康人,这与Sherman 等[10]的研究结果不同。维生素D 严重缺乏组的血清ESR 明显高于其他组,这与McBeth 等[11]的研究相同,严重缺乏使患者的免疫系统受到了影响,可能是通过25-(OH) D 作用于靶细胞维生素D 受体,影响炎症反应的信号通路,从而抑制过度的炎症反应,当维生素D水平较低不能够很好地抑制炎症反应出现了无菌性炎症反应,患者体内各炎症因子发生激化,其中ESR是诱导机体炎症反应的重要促炎因子,随着机体炎症反应的加重,它的水平也随之升高[12]。在本研究中,Pearson 相关性分析显示,4 组MPS患者的25-(OH)D水平与其VAS评分呈中等程度负相关(r=-0.541,P<0.05),这也与Wu 等[13]研究结果相似,并且4 组SF-36评分为严重缺乏组>轻度缺乏组>不足组>正常组,这说明25-(OH) D水平可以间接反映MPS的严重程度[14,15],可作为MPS 严重程度的有效血清学指标,同时随着25-(OH)D水平的降低患者病程也逐渐变长,这说明25-(OH)D 在鉴别MPS发病时间上具有一定的指导意义。
Paul 等[16]对3 369例欧洲男性MPS患者横断面研究显示,极低水平的25-(OH)D、肥胖、户外运动时间、抑郁情况是男性患者发生MPS 的危险因素。本研究Logistic回归分析结果显示,女性、超重/肥胖、环境潮湿、户外活动时间、低25-(OH)D水平是发生MPS 的独立危险因素。女性发病率为男性的3 倍,这与Atherton 等[3]研究结果相似,女性发生MPS 可能与女性体内雄激素水平低有关。25-(OH)D <75nmol/L 发生MPS 的风险显著增加,这似乎与不良生活习惯和环境因素有关,尤其是户外运动时间短和环境潮湿。
综上所述,25-(OH)D缺乏与MPS患者的临床指标密切相关,提示25- (OH)D缺乏程度可以评估MPS 病情。因本研究在西北地区实施,地理位置所带来的差异未能明确,且本实验因民族及实验场地限制,样本量有待于扩充,需进一步研究探讨。

