电针风池对急性脑梗死大鼠脑星形胶质细胞和神经元的保护效果
王琼芬,王风波,王科,钟永强,王娇娇
成都医学院第一附属医院康复医学科,四川成都市610500
急性脑梗死是神经内科的常见病,约占全部脑血管病的60%,发病急,死亡率、致残率和复发率高,是全球关注的健康难题,目前研究多集中于脑梗死后神经功能的康复问题[1-3]。脑缺血发作后,核心区脑组织发生不可逆损伤,神经元在很短的时间内死亡[4]。星形胶质细胞是中枢神经系统中最丰富的细胞,脑梗死时,星形胶质细胞被激活,形成胶质瘢痕,在脑损伤中起重要作用[5-6]。
针灸是中医传统治疗方法。缺血前给予单次或多次电针干预,可诱导脑缺血耐受,减轻缺血再灌注后脑损伤程度,发挥脑保护作用[7]。电针可以通过减少细胞凋亡,减轻脑梗死损伤程度[8]。电针对缺血性脑卒中动物模型有神经保护、抗炎和抗凋亡作用等[9]。电针预处理可减轻急性脑梗死大鼠神经损伤,减少脑梗死体积[10]。
风池穴属足少阳胆经,主治头痛、眩晕、气闭、中风等病。针刺风池可增强脑膜中动脉肌球蛋白轻链激酶激活,预防和治疗急性偏头痛[11];可促进血液流动,改善由眩晕与后循环缺血引起的眩晕症状[12]。本研究探讨电针风池对急性脑梗死大鼠的脑保护作用。
1 材料与方法
1.1 实验动物及分组
清洁级Sprague-Dawley 雄性大鼠64 只,8~12 周龄,体质量250~280 g,购自中国科学院昆明动物研究所,合格证号SCXK(滇)K2016-0001。适应性饲养1周后,统计分析软件SPSS 20.0 产生随机数字,将大鼠编号与随机数字匹配,分为假手术组、模型组、非穴组和风池组,每组16只。
本实验所有涉及动物的操作均符合动物伦理学要求。
1.2 主要试剂和仪器
TUNEL 试剂盒和DAB 显色试剂盒:上海碧云天生物科技有限公司。TTC 染色剂:北京索莱宝科技有限公司。Trizol:美国INⅤITROGEN 公司。caspase-3、Bcl-2、β-actin 聚合酶链反应(polymerase chain reaction,PCR)上下游引物:上海生工公司。Bcl-2 小鼠单克隆抗体、Cleaved caspase-3 兔多克隆抗体(货号:ab201566、ab49822):美国ABCAM 公司。山羊抗鼠二抗,山羊抗兔二抗(货号:C50113-05、C50331-05):美国LI-COR 公司。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、神经元特异性烯醇化酶(neuron-specific enolase,NSE) ELISA 试剂盒:南京建成生物工程研究所。
HANS-200电针仪:南京济生医疗科技有限公司。实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,qPCR)仪:美国BIO-RAD 公司。Z216 MK 型冷冻离心机:德国HERMLE 公司。酶标仪:美国THERMO 公司。脱水机、包埋机:武汉俊杰电子有限公司。石蜡切片机:上海徕卡仪器有限公司。烤箱:天津市莱玻瑞仪器设备有限公司。正置光学显微镜:日本尼康公司。
1.3 造模方法[13]
大鼠0.6%戊巴比妥钠80 mg/kg 腹腔注射麻醉,固定,颈正中切口,暴露并钝性分离左侧颈总动脉、颈外动脉、颈内动脉;在颈总动脉远心端、近心端和分叉前挂线备用。手术缝合线结扎颈总动脉近心端和颈外动脉,不剪断颈外动脉,用动脉夹夹闭颈内动脉;在距动脉分叉4 mm 处斜行剪一小口,插入线栓,缓慢经颈内动脉插入大脑前动脉,至大脑中动脉入口,深度约18~20 mm,稍遇阻力停止,持续3~5 min;结扎颈总动脉,逐层缝合。
假手术组不行线栓与结扎,其余步骤相同。
1.4 干预方法[14]
风池组参照《动物针灸穴位图谱》和《实验针灸学》,取大鼠双侧风池,毫针直刺,深约3 mm。接电针仪,疏密波,频率2/15 Hz,电流0.5~1 mA,以大鼠安静无躁动,耳廓轻度扇动或肌肉局部收缩为度。每次20 min,每天1次,连续治疗7 d。
非穴组电针操作和参数同风池组,施针部位为风池穴左侧旁开0.5 cm。
1.5 观察指标
治疗后,所有大鼠采用以下指标进行观察。
1.5.1 神经功能缺损评分
观察大鼠肢体瘫痪、站立、肢体屈曲和行走情况,采用5 级4 分法进行评分[15]:无明显神经功能缺为0分;对侧前肢伸展为1分;行走时向对侧旋转为2分;行走时向对侧倾倒为3 分;不能自发行走,意识丧失,昏迷为4 分;死亡为5 分。评分为0、4 和5 分的大鼠被剔除,另选大鼠补充。
1.5.2 脑梗死面积和脑组织含水量测定
神经功能缺损评分后,各组随机取4 只大鼠,麻醉处死后取完整左侧脑组织,立即电子天平称湿质量;脑组织烘箱内110 ℃烘烤24 h,再次称量干质量,计算脑组织含水量。

各组随机取4 只大鼠,麻醉处死后快速取脑组织,-20 ℃冰箱冷冻15 min 取出,除去小脑和低位脑干,沿冠状面进行连续切5 片,厚约2 mm,置于2%TTC 溶液中,37 ℃避光水浴25 min。Image pro Plus 6.0图像分析软件分析脑梗死面积。

1.5.3 HE染色
其余大鼠麻醉处死取海马组织。部分组织生理盐水漂洗,滤纸吸干,10%中性福尔马林液固定48 h。脱水,石蜡包埋,切片,厚4 μm。烘箱65 ℃烘干2 h,依次放入二甲苯20 min、无水乙醇、95%乙醇、90%乙醇、85%乙醇、75%乙醇、50%乙醇各5 min。苏木精、酒精-伊红染色。中性树脂封片,镜下观察组织形态及病理改变。
1.5.4 ELISA
部分海马组织按体质量/体积比1∶9 加入生理盐水,冰浴充分研磨,制成10%脑匀浆。5000 r/min 离心20 min,取上清,ELISA 法检测BDNF、GFAP 和NSE水平。
1.5.5 TUNEL
部分海马组织切片,抗原修复,脱蜡,PBST 洗涤3 次。按TUNEL 试剂盒说明书操作。蛋白酶k 20 mg/ml 消化,滴加平衡缓冲液,孵育30 min;弃缓冲液,滴加TdT 缓冲液孵育,再孵育于TUNEL 反应液中。0.01 mol/L PBS 漂洗后滴加碱性磷酸酶,PBS 漂洗。置于碱性磷酸酶显色底物NBT/BCIP 溶液中,避光显色后荧光显微镜下观察,正常细胞核为蓝色,凋亡细胞核为棕黄色,高倍镜下随机计数10个视野阳性细胞数。
1.5.6 Western blotting及PCR
部分海马组织加RIPA 细胞裂解液裂解,提取总蛋白。BCA 测定蛋白浓度。10% SDS-PAGE 凝胶电泳,湿转法转印至PⅤDF膜上,5%脱脂奶粉封闭1 h,TBST洗膜后加入Cleaved caspase-3 一 抗(1∶500)、Bcl-2 一抗(1∶500),4 ℃冰箱孵育过夜;TBST 洗膜,加辣根过氧化物酶标记的二抗(1∶3000),室温1 h;TBST 洗膜,ECL 化学发光,暗室成像拍照,以GAPDH 为内标蛋白,Image J 分析软件Cleaved caspase-3和Bcl-2蛋白相对表达水平。
Trizol 法提取海马组织RNA,逆转录获得cDNA,采用qPCR仪检测各组脑组织caspase-3和Bcl-2表达。
引物由上海生工公司设计合成。
caspase-3 上游5'-GGT ATT GAG ACA GAC AGT GG-3';下游5'-CAT GGG ATC TGT TTC TTT GC-3'。
Bcl-2 上游5'-GGG ACG CGA AGT GCT ATT GGT A-3';下游5'-CAG GCT GGA AGG AGA AGA TGC-3'。
β-actin 上游5'-ATT TGC ACC ACA CTT TCT ACA-3';下游5'-TCA CGC ACG ATT TCC CTC TCA G-3'。
95 ℃预变性3 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,共40 个循环。每个样本重复测3次,计算2-△△Ct。
1.6 统计学分析
采用SPSS 20.0 统计软件进行数据分析。所有数据符合正态分布,数据以(±s)表示,大鼠神经行为学评分和梗死面积采用Kruskal-Wallis秩和检验,其他数据采用单因素方差分析,两两比较采用LSD-t检验。显著性水平α=0.05。
2 结果
2.1 神经功能缺损评分
造模后,模型组和非穴组各死亡1 只,选取同一批次2 只大鼠再次造模成功。与假手术组相比,其余三组神经功能缺损评分显著升高(P<0.001);与模型组和非穴组相比,风池组神经功能缺损评分降低(P<0.05)。见表1。

表1 各组神经功能缺损评分比较
2.2 HE染色
假手术组海马细胞排列整齐,细胞形态、结构和层次清晰完整,无空泡,间质无水肿。模型组和非穴组可见坏死灶,细胞排列紊乱,细胞核固缩,核仁消失,细胞间隙增宽,出现水肿。风池组脑组织水肿减轻,细胞排列紊乱现象有所改善。见图1。
2.3 脑梗死面积和脑组织含水量
与假手术组相比,其余三组脑组织脑梗死面积和含水量明显升高(P<0.05);与模型组和非穴组相比,风池组脑梗死面积和含水量降低(P<0.05)。见图2、表2。
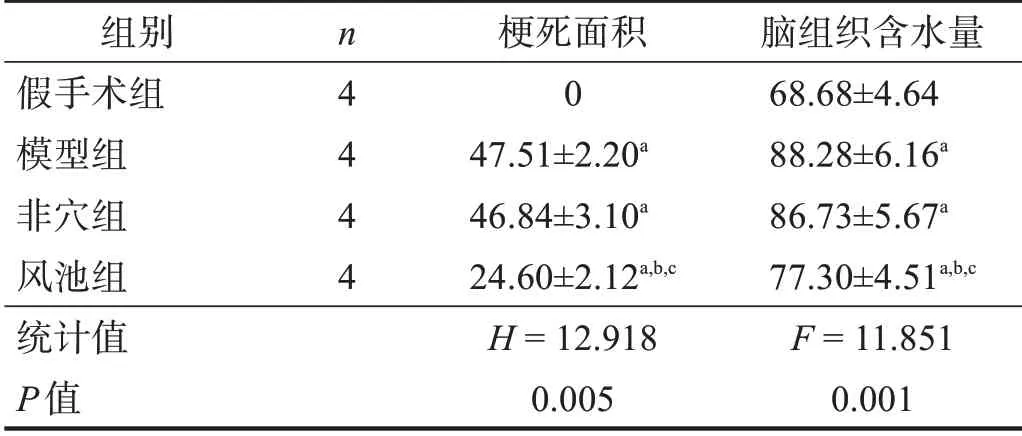
表2 各组大鼠脑梗死面积及脑组织含水量(%)
2.4 ELISA
与假手术组相比,其余三组海马组织GFAP、NSE 水平升高,BDNF 降低(P<0.05);与模型组和非穴组相比,风池组GFAP、NSE 降低,BDNF 升高(P<0.05)。见表3。
2.5 TUNEL
与假手术组相比,其余三组海马组织神经元凋亡细胞数明显升高(P<0.05);与模型组和非穴组相比,风池组神经元凋亡细胞数降低(P<0.05)。见表4、图3。
2.6 Western blotting及PCR
与假手术组相比,其余三组caspase-3蛋白表达升高,Bcl-2 蛋白表达降低(P<0.05);与模型组和非穴组相比,风池组Bcl-2 蛋白表达增加,caspase-3 蛋白表达降低(P<0.05)。见表4、图4。
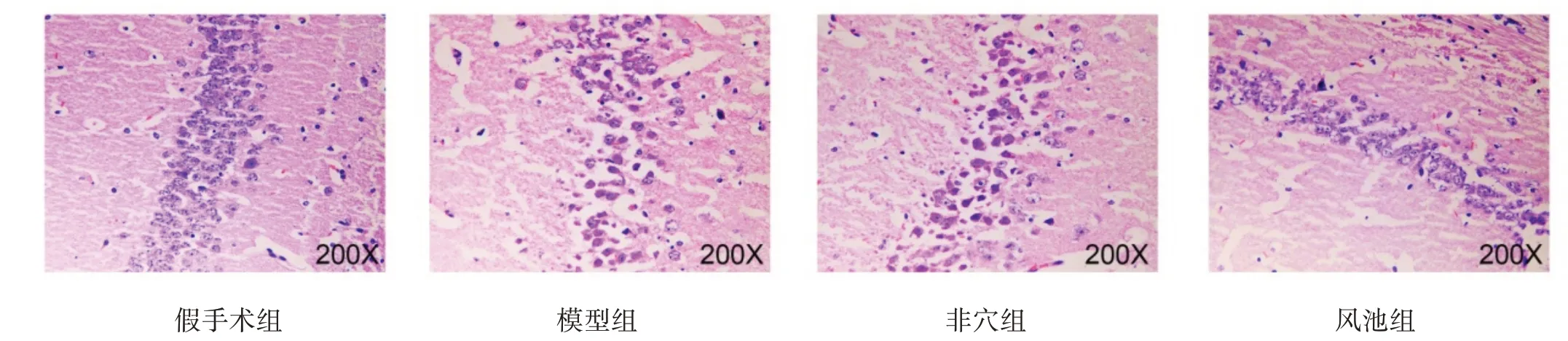
图1 各组海马组织病理学改变(HE染色,×200)
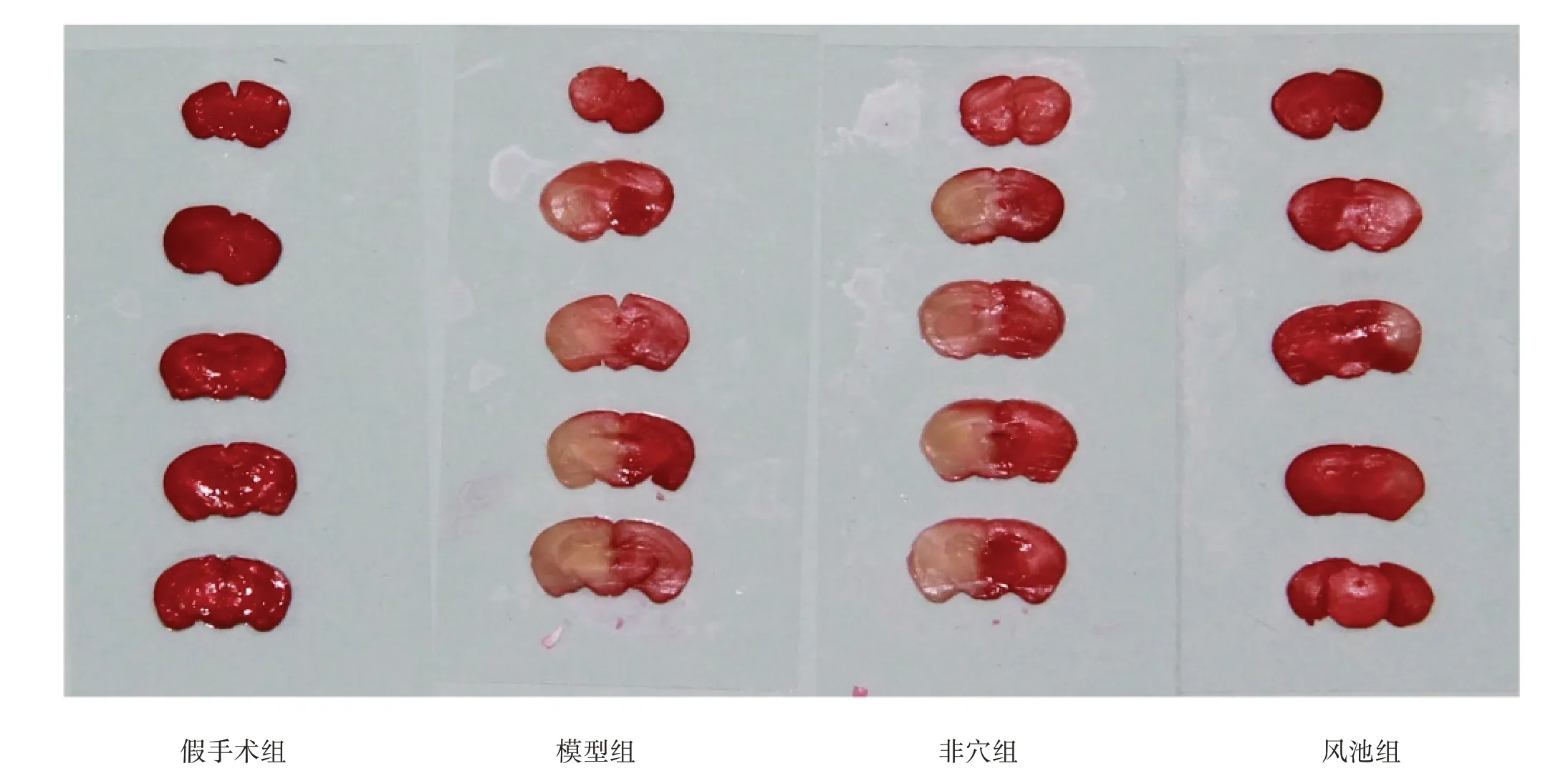
图2 各组脑组织脑梗死面积(TTC染色)
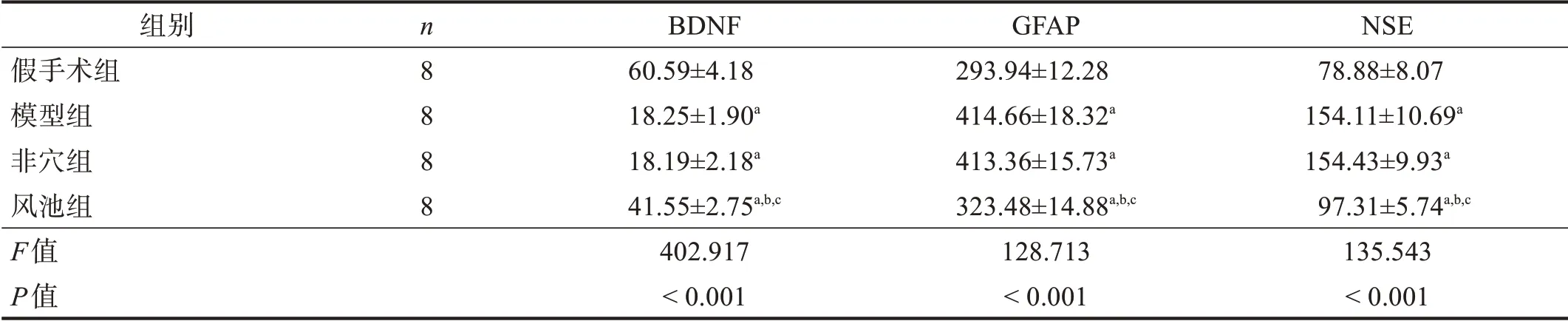
表3 各组海马组织BDNF、GFAP和NSE水平(pg/ml)

图3 各组大鼠脑海马神经元细胞凋亡数(TUNEL,×200)
与假手术组相比,其余三组caspase-3 mRNA表达水平升高,Bcl-2 mRNA 表达降低(P<0.05);与模型组和非穴组相比,风池组Bcl-2 mRNA表达增加,caspase-3 mRNA表达降低(P<0.05)。见表4。
3 讨论
急性脑梗死是指脑部供血突然出现中断,导致脑组织出现坏死的现象。主要病因是脑部供血的动脉出现粥样硬化并有血栓形成[16]。GFAP 是星形胶质细胞的特征性标志蛋白,GFAP 水平与病情严重程度密切相关。正常情况下,GFAP 可维持胶质细胞结构的稳定,并参与神经电生理活动[17]。发生脑梗死后,大脑GFAP表达增加,反映星形胶质细胞的反应性和重塑,因此常作为分化和反应性胶质细胞的标记物[18]。脑梗死周围半暗区GFAP 阳性细胞数显著升高,伴随神经功能缺损程度增加,血清中GFAP水平上升[19-20]。NSE是神经元的标志酶,生理状态下主要存在于脑组织神经元和神经内分泌细胞中;当中枢神经系统处于缺氧缺血状态时,NSE 出现代偿性合成和分泌,使外周血NSE 水平明显升高;脑细胞损伤越严重,NSE 水平升高越明显[21-22]。
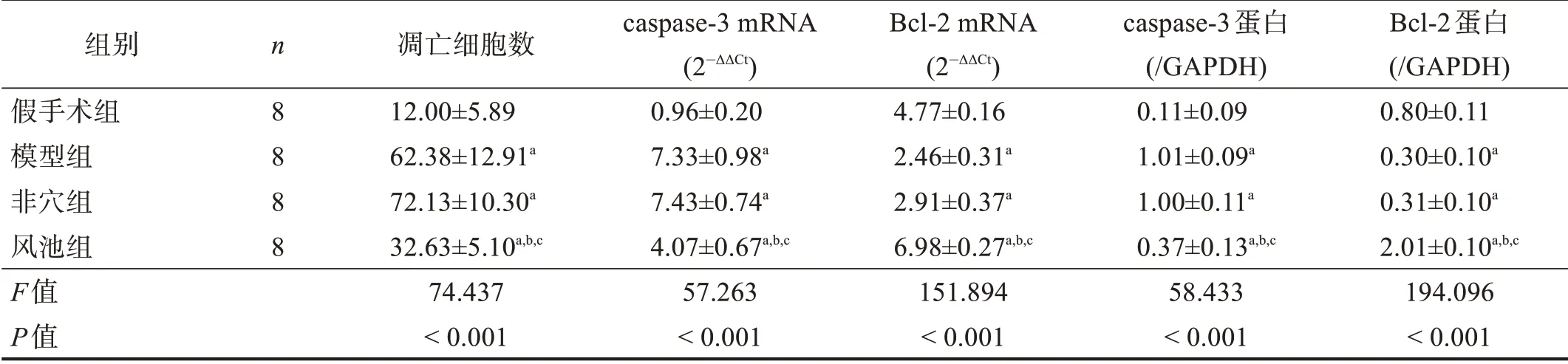
表4 各组海马神经元细胞凋亡数及凋亡相关基因的表达水平

图4 各组caspase-3和Bcl-2蛋白表达水平(Western blotting)
急性脑梗死属中医“中风”病范畴,主要为脉络空虚、风邪入中所致[23]。风池位于后颈部头骨下,胸锁乳突肌上端与斜方肌上端之间的凹陷中,与耳垂平齐处,具有壮阳益气、安神醒脑之功,为治风之要穴[24]。针刺风池可改善脑灌流和脑代谢,恢复神经细胞功能[25];可促进脑缺血再灌注模型大鼠生长相关蛋白-43 和突触素表达[26]。电针百会和水沟穴可降低败血症相关性脑病患者血清中C反应蛋白、白细胞介素-6 和NSE 水平,有效改善脑损伤[27]。BDNF 是神经营养因子家族的重要成员,对多种类型神经元发育、分化、生长、再生等起维持和促进作用,对脑梗死后神经功能的恢复有重要影响[28]。针刺可上调抑郁症大鼠海马组织BDNF含量,有效缓解抑郁[29]。
神经元凋亡是主动过程,是神经退行性病的主要病理基础[30-31]。电针可减少缺血再灌注大鼠脑梗死体积和神经功能缺损,减轻梗死周围皮质的细胞凋亡,具有神经保护作用[32]。神经元凋亡受多种因素调控,其中Bcl-2 和caspase-3 与细胞凋亡密切相关。Bcl-2 蛋白家族主要参与细胞内源性凋亡途径,完成对细胞凋亡的调控,被证实可抑制凋亡[33]。caspase-3 是caspase家族中关键蛋白酶,是凋亡启动的重要枢纽[34]。急性脑梗死后,Bcl-2 表达水平降低,caspase-3 表达水平升高,机体抗凋亡能力下降;过表达Bcl-2 可显著降低caspase-3 的表达[35]。电针可通过调节脑缺血再灌注损伤大鼠大脑Bcl-2 和Bax 的表达,改善大鼠认知功能[36]。电针干预还可上调海马Bcl-2 基因表达,下调caspase-3 表达,从而提高缺血性学习记忆障碍大鼠的学习记忆能力[37]。
本研究显示,电针风池能有效减轻脑梗死引起的急性损伤,可能与调节BDNF 水平有关;抑制神经元凋亡,可能与抑制促凋亡基因caspase-3表达上调,促进抗凋亡基因Bcl-2表达有关。
综上所述,电针风池可改善急性脑梗死大鼠神经功能、病理形态,调节脑BDNF 水平,减少星形胶质细胞和神经元损伤,抑制神经元凋亡,为深入研究电针对急性脑梗死脑保护作用机制提供新思路。
利益冲突声明:所有作者声明不存在利益冲突。

