奈韦拉平的制备工艺
马良秀,左 慧,徐 峰
(1.浙江乐普药业股份有限公司,浙江 台州 318000;2.台州职业技术学院 化学制药研究所,浙江 台州 318000)
在2004年,全球估计有3590至4430万人与人类免疫缺陷病毒相伴生存,其中430至640万人属于新发感染病例,另外有280至350万人死于艾滋病[1-3]。这些数字并在不断增长中,其中东亚、东欧、中亚等地区涨幅最快。感染最严重的地区仍然是撒哈拉以南非洲,其次是南亚与东南亚[4-5]。
微通道反应器技术就是近年来发展起来的一项用于化学合成技术,特别是用于制备医药中间体、医药产品等的具有一定危险性的新技术[6-7]。微通道反应器技术特别适合于强放热、高温高压的反应。新型的微通道反应器可以将液体的物料气化,再与负载型催化剂接触反应,反应的效率可以大幅提高,并降低副产物的产生。
目前奈韦拉平[8]在釜式反应器的工艺一般为2-氯烟酸为起始原料先跟氯化亚砜反应生成2-氯烟酰氯,再与2-氯-3-氨基-4-甲基吡啶反应得到中间体I,中间体I与环丙胺在高压条件下生成中间体II,中间体II在高温下分批加入氢化钠进行闭环反应得到奈韦拉平[9-10]。奈韦拉平的生产工艺涉及到高温高压的胺化反应,用到氢化钠等危险原料。然而凡涉及胺化等危险工艺的生产装置,称为较高危险工艺。采用传统的在间歇反应釜中进行胺化反应极易造成因温度失控而导致爆炸事故的发生。
采用欧世盛的微通道反应器为实验装备,以中间体I和环丙胺为起始原料,通过连续化技术研究其氨化和环化新工艺(Scheme 1)。通过考察反应温度、物料的摩尔比、进料流速和气体流速等反应条件对反应转化率及选择性的影响,优化工艺参数,获得最佳的合成条件,为其后续的实际生产应用奠定基础[11]。

Scheme 1
1 实验部分
1.1 仪器与试剂
XRC-1型熔点仪;Brucker AC400(400 MHz) 型核磁共振仪(CDCl3为溶剂,TMS为内标);1260型高效液相色谱仪。
所用试剂均为分析纯。
1.2 合成
(1) 中间体I的合成
氮气保护下,在50 L的玻璃反应釜中投入2-氯烟酸 1.58 kg(10.0 mol),二氯甲烷15 L,室温下搅拌至固体溶清,投入2-氯-3-氨基-4-甲基吡啶 1.43 kg(10.0 mol)。搅拌下固体溶清,降温至-5~0 ℃。滴加羰基二咪唑1.71 kg(10.5 mol) 和7.5 L二氯甲烷的混合溶液,2~3 h滴加完毕。滴完后在-5~0℃保温反应4 h,升温至20~30 ℃反应4 h,HPLC中控反应完全后加入5.0 L的水洗涤一次,有机层控制在60 ℃内,真空度不低于减压浓缩至干,有大量白色固体析出,加入7.5 L乙醇升温回流2 h,降温至0~5℃保温结晶3 h,过滤,滤饼用1000 mL乙醇洗涤,抽干。60~65 ℃真空干燥12 h,得中间体I2.68 kg,收率95%,纯度99.76%,m.p.190~192 ℃(189~191 ℃[12]);1HNMR(400 MHz,CDCl3)δ:2.42(s,3H),7.19(d,J=4.8 Hz,1H),7.40(dd,J=7.2 Hz,1H),8.11(s,1H),8.20(d,J=4.8 Hz,1H),8.31(d,J=4.8 Hz,1H),8.53(d,J=4.8 Hz,1H)。
(2) 中间体II的合成[13]
称取中间体I2.00 kg(7.09 mol) 和环丙胺485.8 g(8.51 mol)溶于20 L三氯甲烷中备用。在全自动反应器中装填150 mL负载型固体碱颗粒,开启氮气,将温度调整至反应温度,选择最优条件收集中间体II,所得中间体先用1%的冰醋酸水溶液洗涤,再用10%碳酸氢钠溶液洗涤,所得有机层HPLC纯度不低于99%,无水硫酸镁干燥后直接用于下一步。
(3) 奈韦拉平的制备
在全自动反应器中装填150 mL负载型固体超强碱颗粒,开启氮气,将温度调整至反应温度,选择最优条件收集奈韦拉平的反应液,所得产物先用水洗涤一次,再用10%碳酸氢钠溶液洗涤,所得有机层干燥脱色后浓缩至干,根据接收量,加入3倍中间体I重量的乙醇进行重结晶,连续两步的反应收率90%,HPLC纯度不低于99.7%,m.p.247~249 ℃(246~248 ℃[14]);1H NMR(400 MHz,CDCl3)δ:9.75(s,1H),8.31(dd,1H),8.20(dd,1H),7.99(d,1H),7.09(t,1H),6.89(d,1H),2.23(s,3H),0.92(m,1H),0.64(m,2H),0.49(m,2H)。
2 结果与讨论
2.1 中间体II的制备
(1) 氮气流速对中间体II制备的影响
保持中间体I进料流量和反应温度不变的情况下,研究不同氮气流速下对中间体II产率的影响。从表1中可见,根据HPLC分析结果可知,氮气的流速对原料的转化影响较大,当氮气的流速低于20 mL/min时,原料剩余的越多,且杂质会相应增加;当氮气的流速高于25 mL/min时,剩余的原料同样会增加,但是生成的杂质会变少。当氮气流速低于20 mL/min时,气体与液体的混合气化效果达不到最优状态,故转化不够彻底,但由于反应停留时间长杂质变高。当氮气流速高于30 mL/min时,反应时间变短导致反应不够彻底。优选氮气流速为25 mL/min。

表 1 氮气流速对合成中间体II的影响Table 1 Effects of Nitrogen flow rate on preparation of Intermediate II
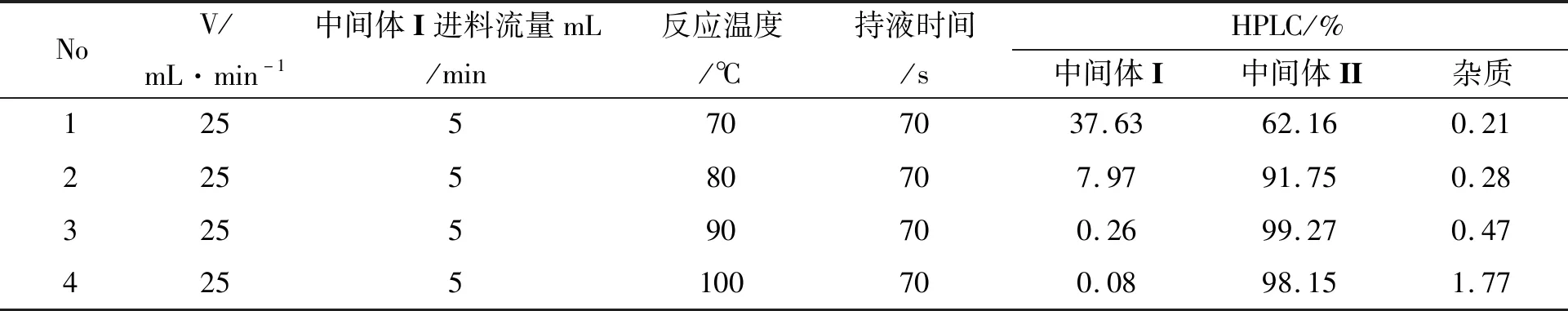
表 2 温度对合成中间体II的影响Table 2 Effects of temperature on preparation of Intermediate II
(2) 温度对中间体II反应的影响
确定氮气的流速后,对反应的温度进行了细致的研究。温度升高对设备的材质要求更高,设备内的压力也会增加,提高了反应的危险性(表2)。根据HPLC液相色谱的分析,当反应温度低于90 ℃时,原料转化不够彻底。在实验过程中70 ℃时原料有37.63%未转化,将未转化的反应液进行多次循环进入微通道反应,最终原料转化符合工艺要求,但考虑到车间生产效率,故不考虑低温反应,需一次性转化率符合要求。温度在90 ℃时原料转化更彻底且杂质较少,当温度大于90 ℃时,原料转化的更彻底但是杂质也会相应增加,且温度越高对设备的腐蚀也会增加。故选择90 ℃(微通道反应器的温控范围在±1 ℃以内)反应效果最为理想。
(3) 摩尔配比对中间体II反应的影响
由上表的HPLC的分析结果可知,中间体I与环丙胺的摩尔比对反应的影响也较明显。为此对中间体I与环丙胺的摩尔比的进行详细的研究,综合考虑选择n(中间体I)/n(环丙胺)=1/1.2,在此条件下得到的反应结果为最优,且最为经济。

表 3 摩尔比对合成中间体II的影响Table 3 Effects of mol ratio on preparation of Intermediate II
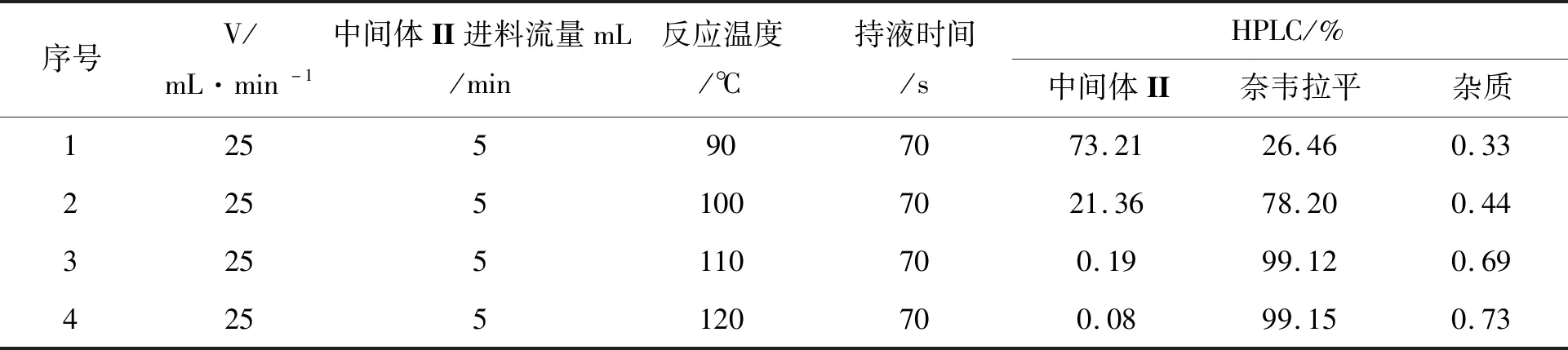
表4 反应温度对合成奈韦拉平的影响Table 4 Effect of reaction temperature on Nevirapine preparation
2.2 反应温度对奈韦拉平制备的影响
在物料性质没有明显变化的前提下,沿用上一步的气相流速和液相流速,将负载型固体碱催化剂更换为负载型固体超强碱催化剂,对反应的温度进行了细致的研究。根据釜式反应器的工艺条件,选定90 ℃开始研究,根据HPLC液相色谱的分析,当反应温度在90 ℃时,中间体II有70%以上未能转化,需要再经过5次循环才能达到转化的要求,影响生产效率。当反应温度升高至100 ℃时原料有21.36%未转化,再进行循环一次可达到工艺转化要求。温度在110 ℃时原料转化符合工艺要求,当温度大于90 ℃时,原料转化的更彻底但是杂质也会相应增加,且温度越高对设备的要求更高,产品的选择性没有明显的提高。
3 结论
以中间体I和环丙胺为原料,在全自动微通道反应器内实现了公斤级中间体II和奈韦拉平的连续生产研究,反应效果较好,要优于釜式反应器的结果,为以后工业化做好了技术储备。综合各工艺条件,中间体II的反应条件最终选择在90 ℃,液相流速5 mL/min,气相流速25 mL/min,负载型固体碱为催化剂,中间体II的质量符合要求;奈韦拉平反应条件最终选择在110 ℃,液相流速5 mL/min,气相流速25 mL/min,负载型固体超强碱为催化剂,奈韦拉平的转化率和选择性符合工艺要求,最终得到的产品符合质量标准。在各工艺条件确定的基础上,还研究全自动微通道反应内压力对实验的影 响,实验结果发现,压力对反应的影响较小,可以忽略不计,故中间体II和奈韦拉平步骤的压力都选择在1 MPa。以二氯烟酸为起始原料,经中间体I和中间体II得到奈韦拉平,总收率达到85.5%。

